
2024-03-11
背景
口腔菌群是人体微生物组重要组成部分,具有高度的多样性,包括数百种细菌、真菌、古菌和病毒等。不同的口腔部位如舌苔、口腔粘膜、牙菌斑具有独特的微生物物种组成,共同形成了复杂的生态系统。俗话说“病从口入”,口腔菌群在很多疾病的发生过程扮演重要的角色。近二十年,大量研究证实牙周病、龋齿、口腔癌等口腔疾病以及阿尔茨海默症、糖尿病、肠炎、癌症、肺炎等远端器官疾病与口腔菌群具有密切的关系。今天,小派就带你了解口腔菌群和疾病关联的研究趋势、研究方法和研究思路。
口腔菌群有哪些研究趋势?
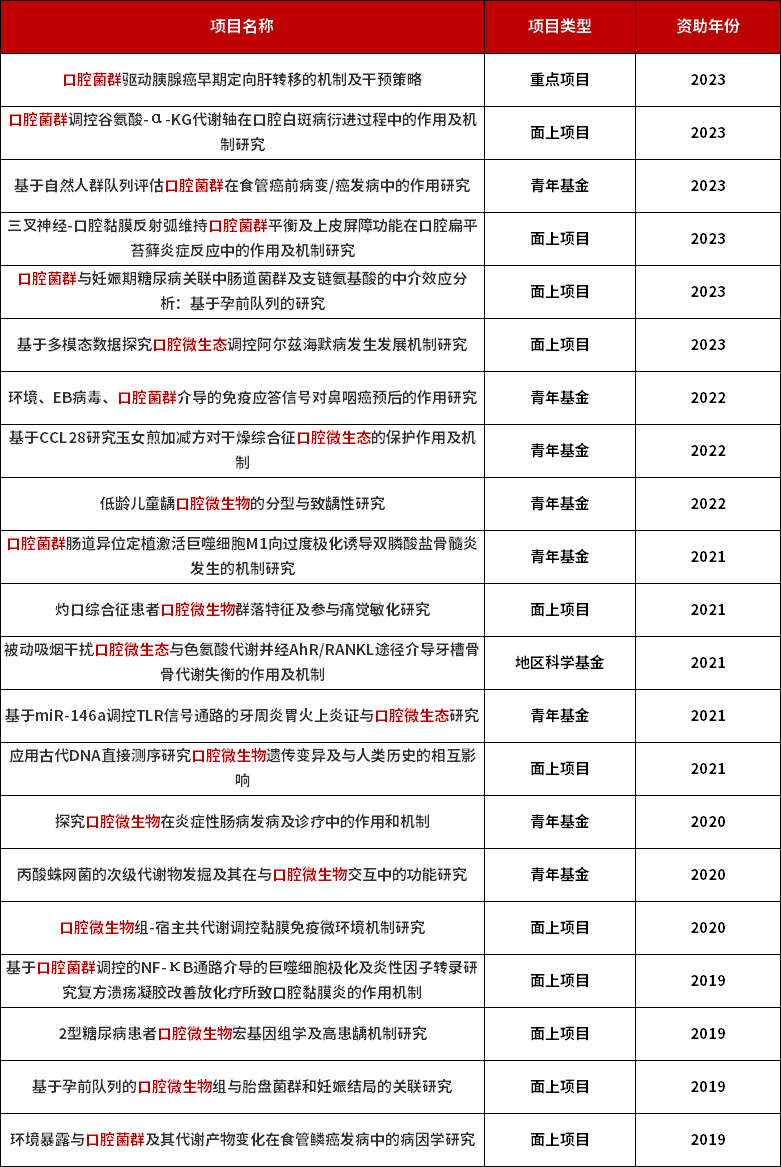
图1 口腔菌群研究论文主题词云图 通过在Web of Science以“oral microbiota”作为主题词进行检索,近10年累计发表1万余篇文章。通过对研究主题进行统计,口腔菌群的研究主要集中在感染、药学、消化系统、分子遗传等学科领域,充分显示了口腔菌群在健康与疾病研究中的重要意义。国自然基金当然少不了口腔菌群的身影。国自然基金近些年来资助了哪些口腔微生物相关的课题呢?据不完全统计,近五年国自然基金委资助了口腔微生物相关的项目不少于20项(表1),大部分集中医学方向,其中以口腔菌群与疾病的关联与机制探究方面为主。除此以外,还有中医药对口腔微生态的保护作用、环境暴露与口腔菌群的变化等研究方向。国自然资助的课题通常是相关领域的热点研究方向,准备开展口腔菌群研究的老师和同学可以借鉴一下了。 表1 近五年口腔菌群相关的国自然资助项目
口腔菌群研究需要什么技术方法?
想要开展口腔菌群的群落组装、微生态调控、疾病机制研究,首先我们要对口腔微生物组的结构和功能进行全面分析。随着技术的不断发展,口腔菌群研究的技术方法主要包括(1)基于测序的技术,如16S/ITS扩增子测序、宏基因组测序、宏转录组测序、宏病毒组测序以及蛋白组和代谢组分析。组学或多组学分析可以帮助我们认识口腔菌群的物种组成规律和功能。(2)基于成像的技术,如荧光原位杂交显微成像、质谱成像、拉曼光谱等。成像技术能有效的描绘口腔菌群的空间分布、动态变化、代谢交换、与宿主之间的互作交流。(3)基于培养的技术,如培养基设计依赖的培养组学、反向基因组依赖的培养组学等。培养组学的发展为难培养微生物的获取、下游干预的实施提高了更多可能性。不同的方法具有各自的优势和局限性,充分结合使用多组学方法是当前微生物组学研究的必备技术。 图2 口腔菌群研究的技术方法(1)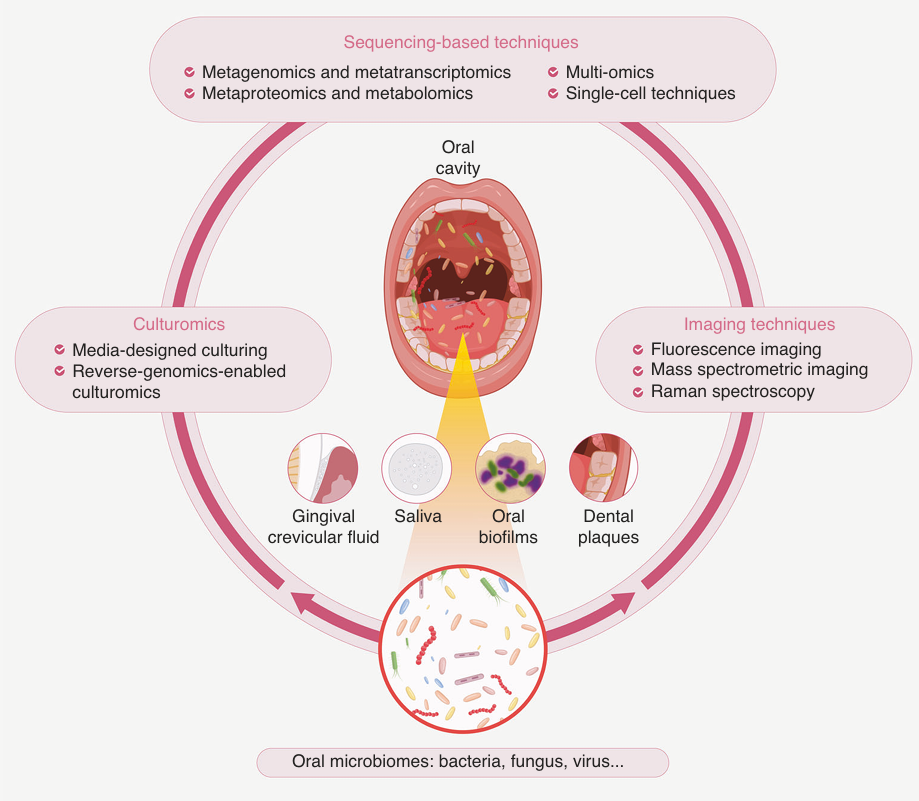
口腔菌群有哪些研究思路?
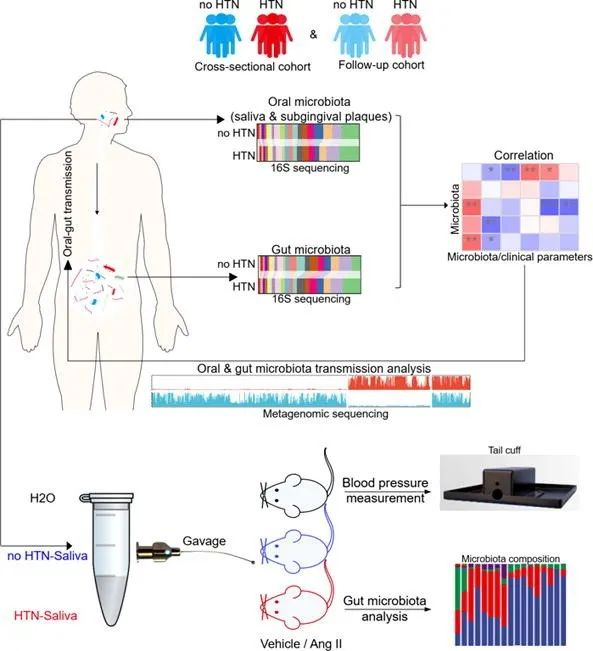
下面让我们通过几篇口腔菌群与疾病关系研究的高分文章学习一下高大上的研究思路吧。 案例一:口腔菌群-鼻咽癌 文章题目:Microbes translocation from oral cavity to nasopharyngeal carcinoma in patients(Nature Communications,2024)(2) 多组学技术:16S rRNA测序、宏基因组测序、宏转录组测序、培养组学 技术路线: 图3 本研究的技术路线 主要研究内容:口腔微生物在非口腔部位的异位定植与消化道癌症有关。然而,口腔菌群在鼻咽部的异位定植及对局部癌症发展的影响尚不明确。本研究通过收集分析鼻咽癌(NPC)患者及对照组的鼻咽-口腔菌群样本,揭示了一种与NPC风险增加相关的异常口腔至鼻咽部微生物转移现象。本研究鉴定出13种被归类为从口腔转移并富集在NPC患者鼻腔部的细菌物种。作者通过培养组学和克隆菌株鉴定验证了两株异位定植细菌Fusobacterium nucleatum(具核梭杆菌)和Prevotella intermedia(中间普氏菌)。鼻咽部活检组织宏转录组测序进一步证实了这些微生物存在于肿瘤内部,并影响局部微环境和细胞因子反应。这些微生物与鼻咽部的EB病毒载量显著相关,显示出剂量-效应关系增强的现象。综上,本研究识别出了迁移到鼻咽部、侵入肿瘤、影响肿瘤微环境并与EBV感染相关的口腔微生物。这些研究结果加深了我们对异常微生物通讯及其在癌症发生中作用的理解。 案例二:口腔菌群-阿尔茨海默症 文章题目:Periodontitis-related salivary microbiota aggravates Alzheimer's disease via gut-brain axis crosstalk (Gut Microbes, 2022).(3) 多组学技术:16S rRNA测序、转录组测序 技术路线: 图4 本研究技术路线 主要研究内容:越来越多的证据表明,牙周病原体及其后续的炎症反应在阿尔茨海默病(AD)的发生发展中起着重要作用。肠道和中枢神经系统共同参与交叉对话;微生物群介导的免疫通过肠-脑轴显著影响AD。然而,牙周炎与AD确切的关联机制尚不明确。本研究基于AD小鼠模型的肠-脑交叉对话,探讨了与牙周炎相关的唾液菌群对AD的影响。本研究收集了牙周炎患者及健康个体的唾液样本,并将这些唾液菌群连续灌胃小鼠两个月。结果显示,持续灌胃牙周炎相关唾液菌群的小鼠表现出认知功能受损、β-淀粉样蛋白积累增加以及神经炎症加剧等AD相关病理变化。此外,这些AD相关病理变化与肠道菌群失调、肠道促炎反应增强、肠道屏障功能受损以及随后全身性炎症加剧相一致,提示牙周炎相关的唾液菌群可能通过肠-脑轴的交叉对话加重AD的发病进程。本研究揭示了通过吞咽含牙周炎相关唾液菌群的方式,牙周炎可能参与AD的发病机制,验证了牙周炎在AD进展过程中的作用,并为AD的病因学研究及干预策略提供了新的视角。 案列三:口腔菌群-高血压 文章题目:Roles of oral microbiota and oral-gut microbial transmission in hypertension (Journal of Advanced Research, 2023).(4) 多组学技术:16S rRNA测序、宏基因组测序 技术路线: 图5 本研究技术路线(4) 主要研究内容:有相当多的证据表明牙周炎与高血压有关,但这种联系背后的机制尚不清楚。本研究以此为切入点,旨在表征口腔和肠道微生物群的变化及其在高血压中的作用。本文通过高血压和对照组的比较,分析口腔和肠道微生物群在高血压发生的作用。然后对小鼠模型进行抗生素预处理,以耗尽肠道微生物群,再通过灌胃移植人唾液,以检测口腔-肠道微生物异常传播对高血压的影响。本研究为支持口腔微生物群与高血压之间的强关联提供了全面的证据,发现在高血压患者中有14个唾液-属和15个龈下菌斑-属发生了显著改变。本研究鉴定了唾液、龈下菌斑和粪便中共存的物种,并说明了口腔和肠道样本类型之间的共存物种之间的关联。本研究确定了高血压患者中重要的口腔-肠道传播微生物。5个属水平下的16个物种被确定为口腔-肠道递质,特别是物种Veillonella被确定为在高血压参与者中稳定富集的口腔-肠道递质。在动物研究中证明了口肠微生物传播和高血压之间的潜在因果关系——来自高血压参与者的唾液加剧了血管紧张素-II诱发的高血压。Veillonella可以在所有接受人类唾液的小鼠的肠道中定植,而在接受高血压参与者唾液的小鼠的肠道中更丰富。

总 结
随着口腔微生物组学研究的深入,越来越多的证据显示很多疾病特别是非传染慢性疾病的发生发展与口腔微生物群系具有密切的关系。口腔菌群的研究为疾病的诊断、预防和治疗提供了新的视角。口腔菌群与疾病的相关研究应该关注以下几个方面:(1)口腔不同部位微生物群系组成具有特异性,应按照研究目的区分取样;(2)应考虑口腔菌群与其它器官微生物特别是肠道菌群的互作交流和异位定植,大规模的队列研究应采集口腔和粪便样本;(3)实验设计应充分考虑多组学的研究方法,有助于从多维度阐述口腔菌群的组成和功能;(4)当前口腔菌群研究主要的科学问题是群落组装的机制、影响菌群生态平衡和紊乱的因素、疾病诊断的标志物探究、调控口腔微生态的策略研究等。
派森诺生物在口腔菌群研究领域的优势 作为最早涉足微生物组高通量测序的生物技术公司之一,派森诺生物在口腔微生物组研究领域积累了丰富的项目经验,与国内二十余家科研单位建立了合作关系。目前我们在派森诺基因云平台上搭建了微生物多样性组成谱、宏基因组、宏转录组、非靶代谢组等宏组学分析平台,实现了实时可交互的分析模式。此外,派森诺生物研发了微生物组-代谢组、微生物组-基因组、微生物组-理化因子、转录组-代谢组等多组学联合分析平台,为口腔菌群数据的深入挖掘、机制探究提供了保障。据不完全统计,凭借派森诺的测序和数据分析优势,近两年合作客户在口腔菌群领域发表SCI论文二十余篇,影响因子合计100+。
近两年派森诺生物在口腔菌群研究领域的代表性合作案例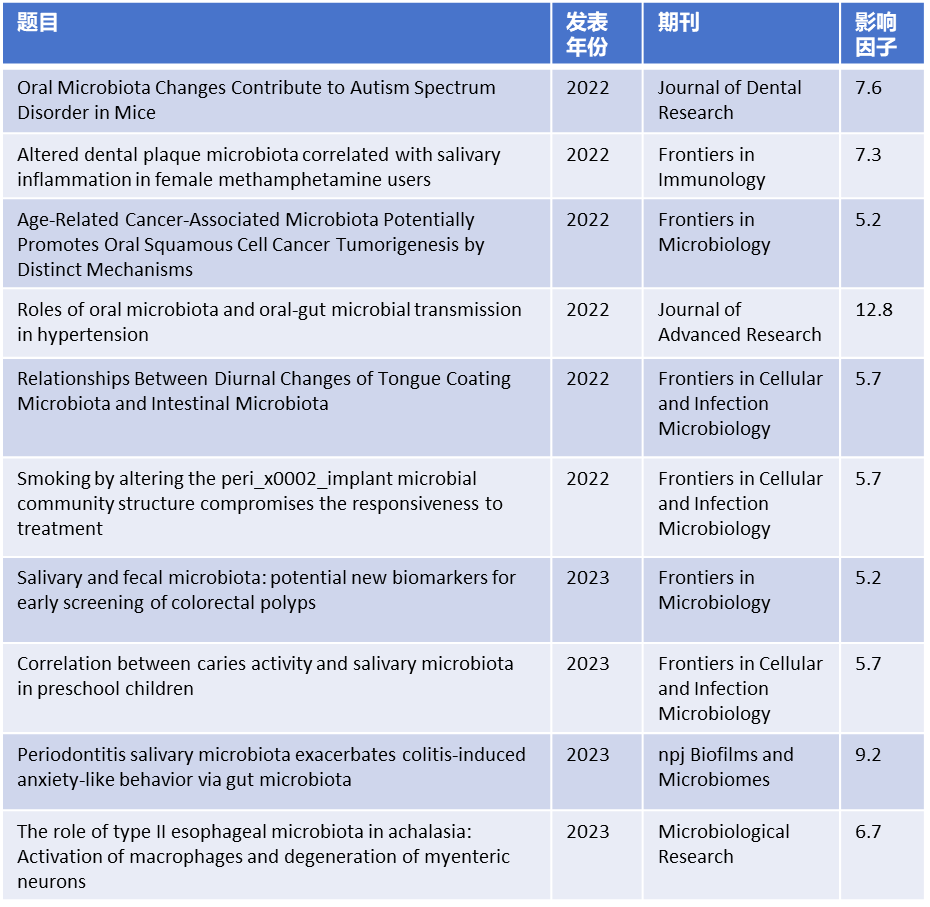
参考文献 1.Lin Y, Liang X, Li Z, et al.. Omics for deciphering oral microecology. Int J Oral Sci. 2024 Jan 9;16(1):2. 2.Liao Y, Wu YX, Tang M, et al.. Microbes translocation from oral cavity to nasopharyngeal carcinoma in patients. Nat Commun. 2024 Feb 22;15(1):1645. 3.Lu J, Zhang S, Huang Y, et al.. Periodontitis-related salivary microbiota aggravates Alzheimer's disease via gut-brain axis crosstalk. Gut Microbes. 2022 Jan-Dec;14(1):2126272. 4.Chen BY, Lin WZ, Li YL, et al.. Roles of oral microbiota and oral-gut microbial transmission in hypertension. J Adv Res. 2023 Jan;43:147-161.