2024-03-14
smRNAPSN-seq是派森诺新推出的一种高通量的微生物单细胞转录组分析工具,它不仅可以鉴定新的细胞亚群、分析微生物表型异质性的分子机制、而且可以在单细胞分辨率下应用于微生物演化及微生物与宿主相互作用等领域的研究,其主要实验流程包括对微生物细胞进行固定透化后进行rRNA的去除,然后制备成合适浓度的单细胞悬液进行10×上机及后续文库构建和测序。
为了获得理想的测序分析结果,最关键的就是制备高质量的单细胞悬液,而影响单细胞悬液主要因素之一是样本的质量。对于特殊处理样本,为了锁定实验样本初始转录本状态,同时减少寄送样本带来的影响,我们更建议老师在送样时选择先对样本进行甲醛固定后再寄送(详细描述见“微生物单细胞测序——送样指南篇”)。但因为不同地区距离长短导致快递送达时长不一,固定后样本长时间处于4℃环境下,会对样本本身质量有影响吗?会影响后续透化、去rRNA的效果吗?拒绝推测,我们用数据说话!
选择大肠杆菌为实验对象,将菌液进行过夜固定后分别置于4℃保存0~4 d,对获得的5份固定后样品进行RNA提取,并对其进行2100质检(如图1所示),结果发现5个样本峰型一致,未发生降解。后续将所得RNA进行rRNA去除、建库以及上机测序。
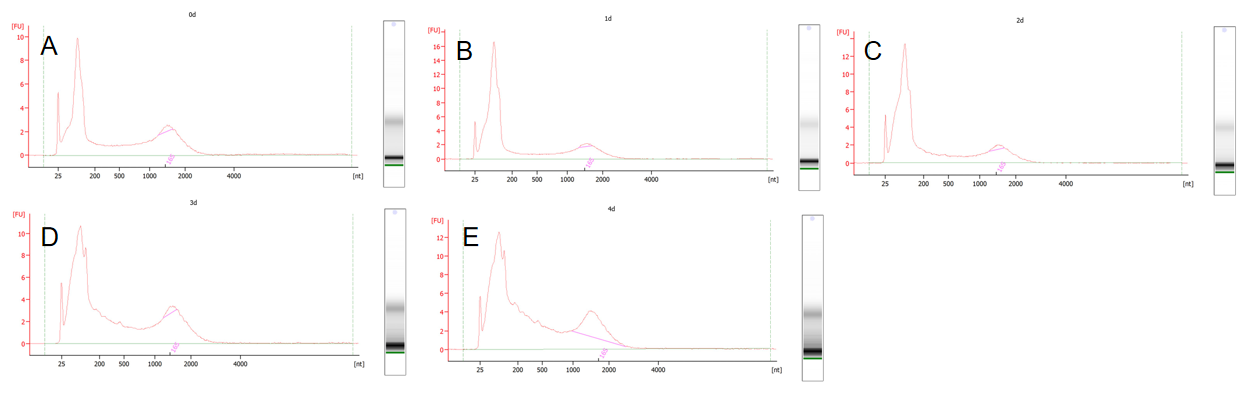
图1 RNA2100质检结果
A,0 d;B,1 d;C,2 d;D,3 d;E,4 d;
测序下机后对数据进行质检,如表1所示,下机数据Q30在96%以上,测序质量良好,然后对样本中rRNA占比进行分析(如图2),发现0 d时rRNA占比最低,但第1~3 d时rRNA占比仅增加0.7%~0.8%。接下来对区域分布进行统计(如图3),比对到Exon的reads比例最高,基因覆盖度好,最终对5个样本进行相关性检验(如图4),用皮尔逊相关系数表示样品间基因的表达水平相关性,与其他样本比较,皮尔逊相关系数均大于0.98,表明各样本之间的正相关性高。
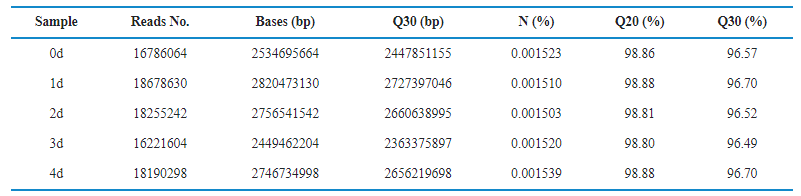
表1 下机数据统计
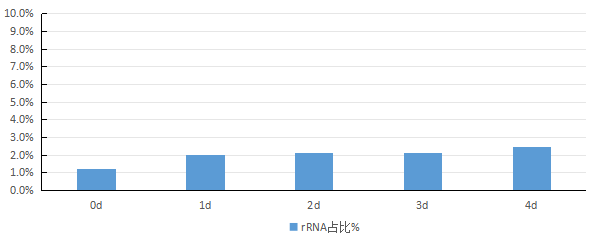
图2 固定后大肠杆菌不同保存时间处理下rRNA占比
图3 比对结果统计(基因区域)
A,0 d;B,1 d;C,2 d;D,3 d;E,4 d;
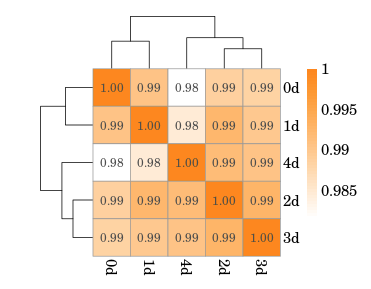
图4 样品相关性检验
对微生物细胞进行固定不仅可以锁定微生物细胞的瞬时状态解决原核细胞半衰期短的问题,也可以提高转录本捕获效率。目前,在单细胞测序中为了固定细胞内蛋白,常见的方法是通过多聚甲醛 (PFA) 固定,PFA固定不仅有更强的交联作用而且在测序中发现PFA 可以更好地保持细胞内结构的完整性,可检测更多数量的基因和转录本,同时利用PFA固定进行的FD-seq与Drop-seq对比发现,两者有相似的单细胞捕获效率及基因数[1]。Yunxia Guo [2]等人通过对脑组织进行单细胞测序发现,新鲜PFA固定和冻存样本有相似的转录组学特征,但PFA固定超过三天后真实的细胞状态被破坏,细胞比例发生变化。因此,虽然固定后大肠杆菌样本rRNA占比在1~3 d变化较小,但仍建议甲醛固定样本从样本制备到实验前应不超过48h。
[1]Phan, H.V., van Gent, M., Drayman, N. et al. High-throughput RNA sequencing of paraformaldehyde-fixed single cells. Nat Commun 12, 5636 (2021). https://doi.org/10.1038/s41467-021-25871-2. [2]Yunxia Guo a, Junjie Ma b, Zhengyue Li et al. Transcriptomic profiling of nuclei from paraformaldehyde-fixed and formalin-fixed paraffin-embedded brain tissues.Analytica Chimica Acta, 2023, 1281: 341861.


