
2024-03-26
随着人体微生物组的深入研究以及肿瘤内微生物的发现,人体共生微生物与肿瘤的研究越来越受到关注。微生物组在肿瘤诊断、发展、治疗领域的呈现了较高的应用潜力。胶质母细胞瘤是一种恶性脑部肿瘤,由于免疫抑制性的肿瘤微环境,其治疗具有很大难度。微生物组与胶质母细胞瘤的互作研究为肿瘤的治疗提供了新的视角。2023年10月,韩国研究人员在Cell Reports发表最新研究,通过动物实验和多组学研究发现高葡萄糖补充可以调节肠道微生物菌群,进而提高胶质母细胞瘤小鼠的存活率。
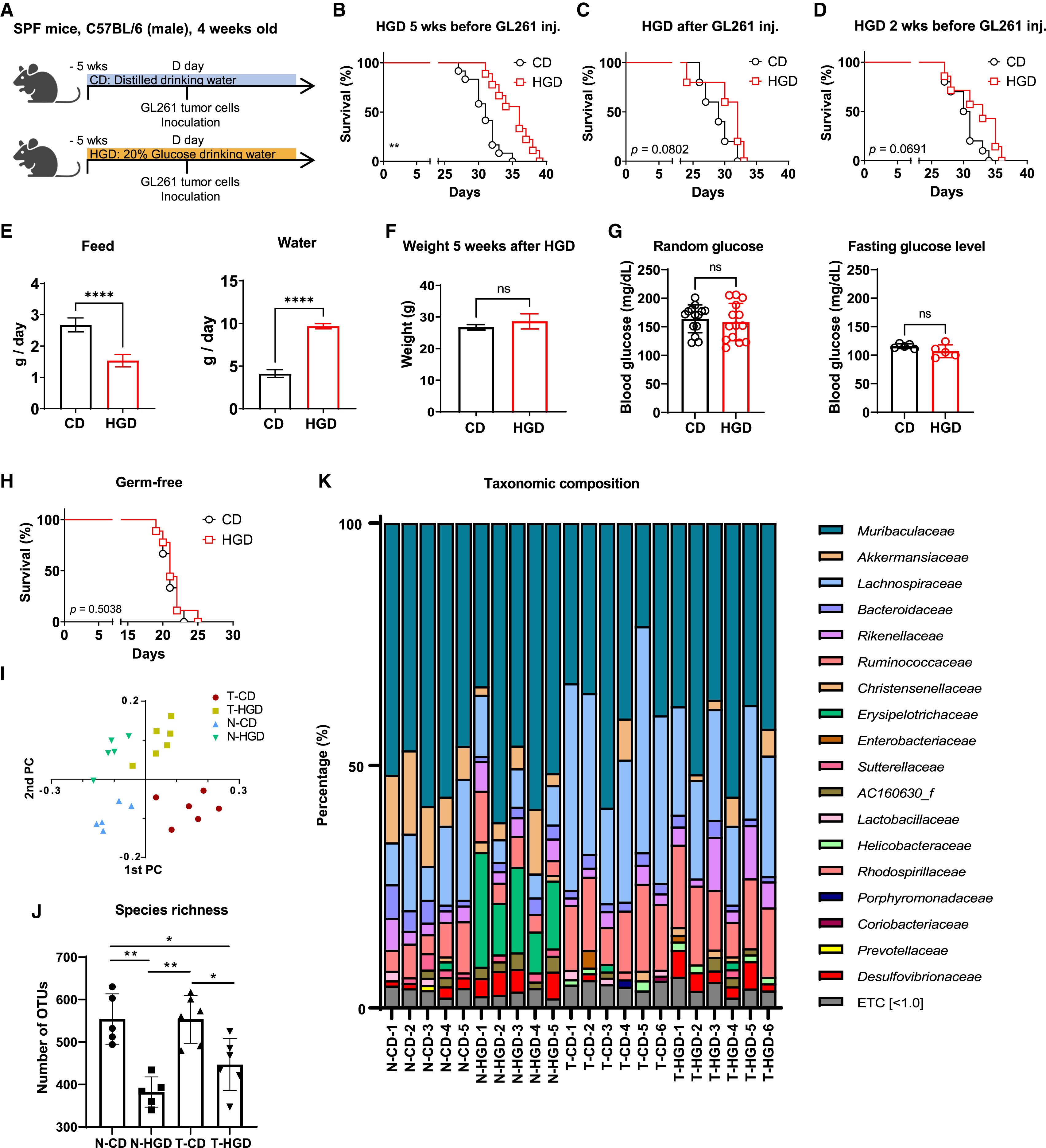
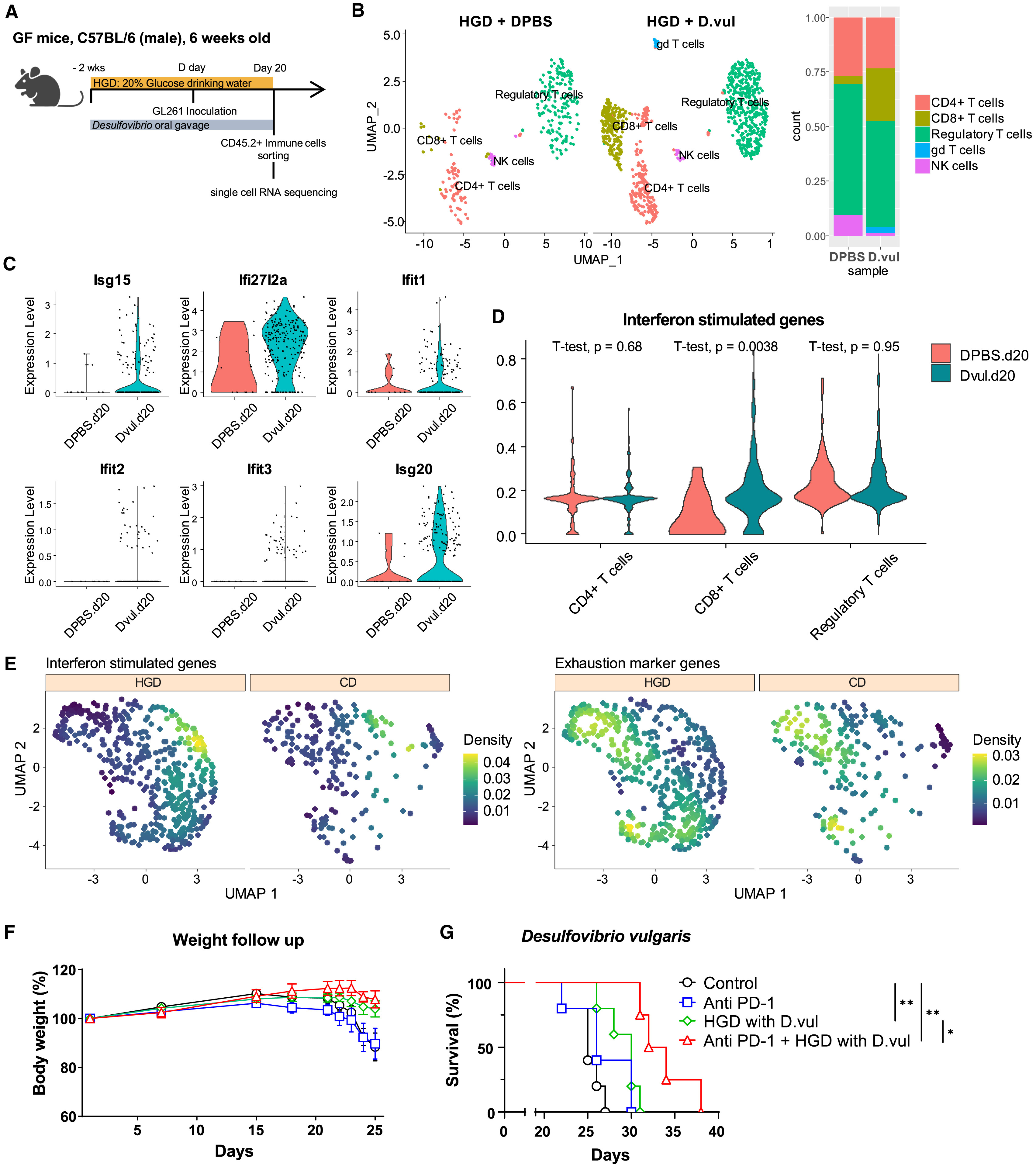
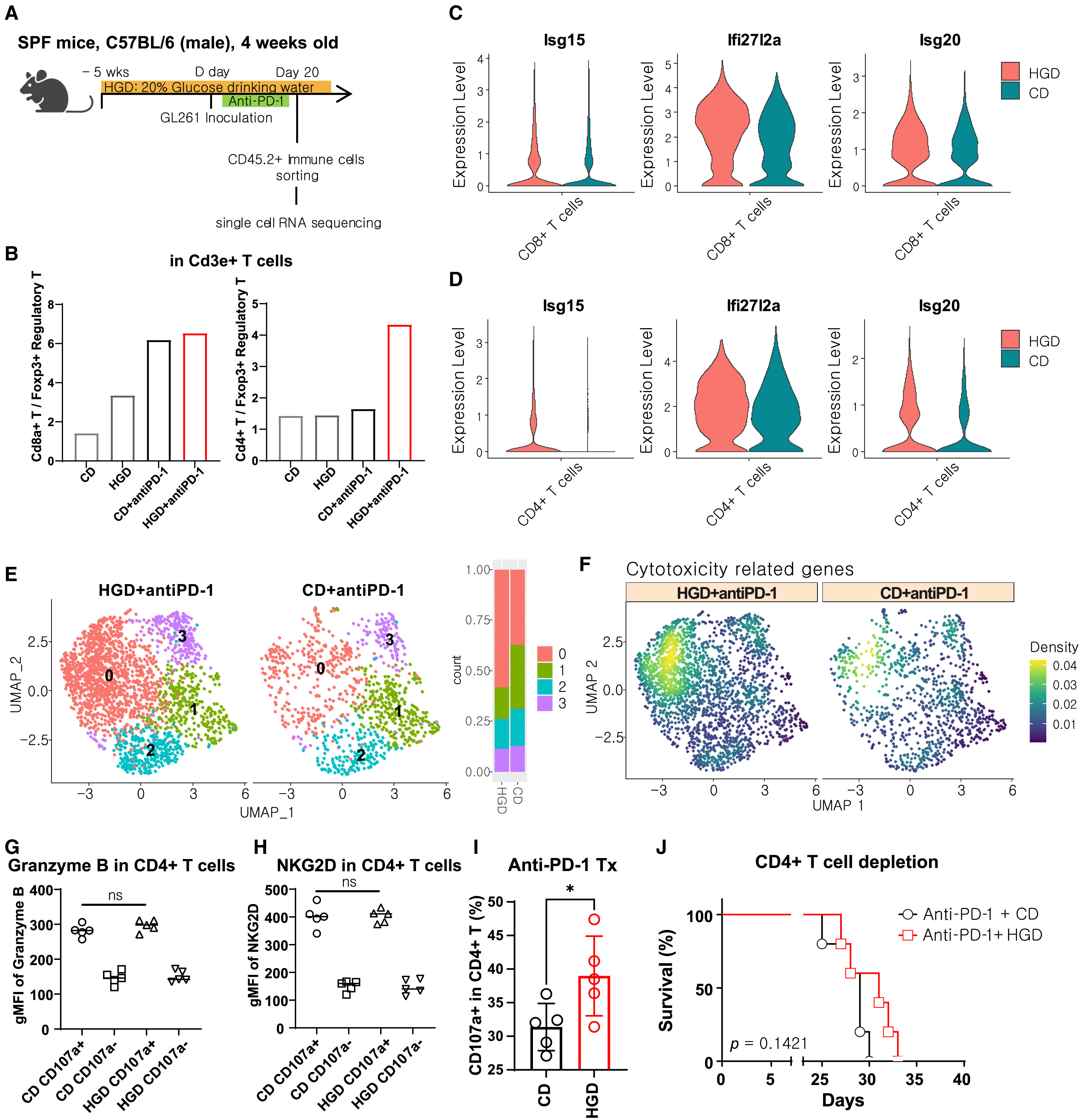
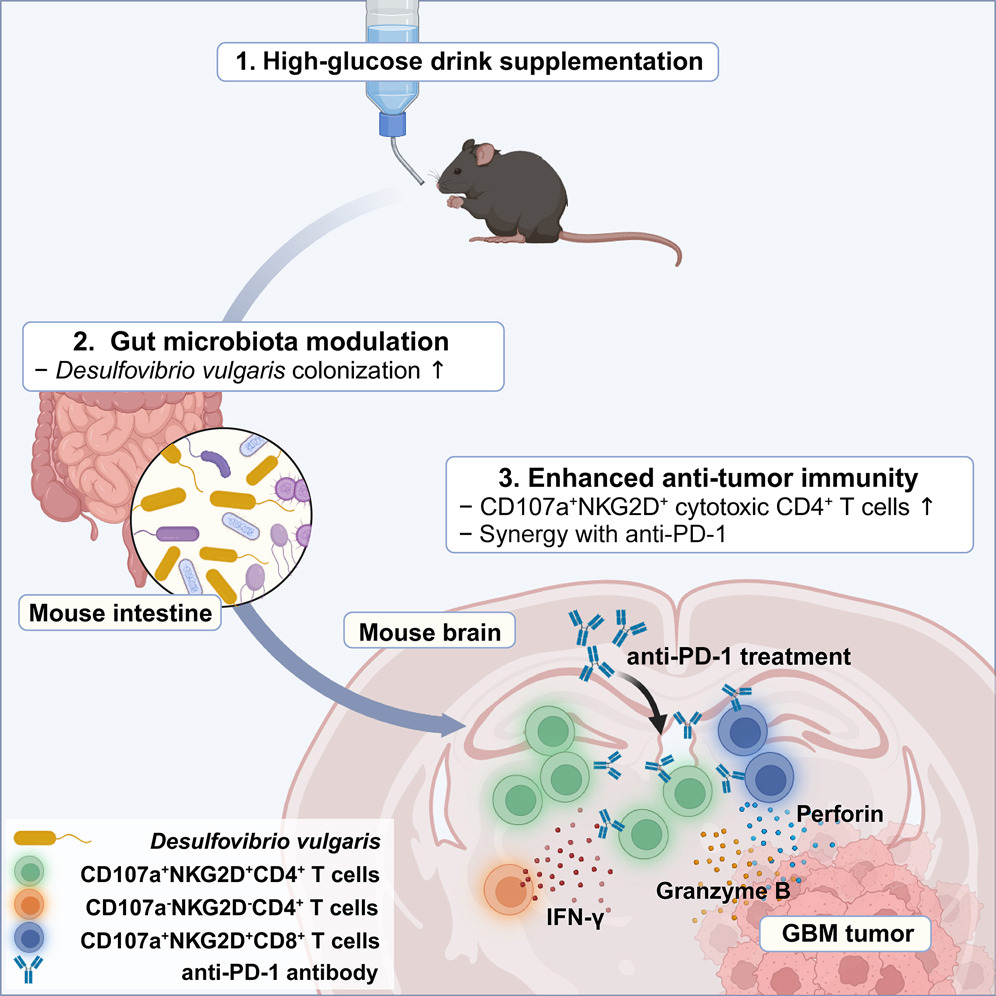
文章题目:Supplementation with a high-glucose drink stimulates anti-tumor immune responses to glioblastoma via gut microbiota modulation (Cell Reports, 2023) 影响因子:8.8 01、研究背景 流行病学研究表明高糖饮食与糖尿病、肥胖相关代谢综合征、非酒精性脂肪性肝病和心血管疾病有关,并会增加恶性肿瘤的风险。前期研究认为长期高糖饮食通过能量代谢变化促进肿瘤细胞增殖,进而促进肿瘤的发展。然而糖摄入量的突然减少也会造成血糖升高、免疫力下降等负面效应。因此,有必要进一步评估从癌症患者的饮食中消除糖分是否是有利的。 胶质母细胞瘤(GBM)是一种恶性脑肿瘤,其特征是广泛的浸润性生长、高血管化和对多种治疗方法的耐药性。肠道菌群-肠-脑轴研究证明肠道微生物可以通过产生神经递质等代谢物影响大脑发育和功能。而饮食行为通过调节肠道菌群对健康和疾病的影响正越来越受到关注。在不同的肿瘤模型中发现肠道菌群可以增强免疫检查点抑制剂的疗效。虽然调节肠道菌群的饮食也可能影响抗肿瘤免疫反应,但目前还没有关于肠道菌群的变化是否能增强GBM抗肿瘤免疫反应的研究。 02、材料与方法 实验材料:无病原体小鼠 C57BL/6J、无菌小鼠、小鼠胶质瘤细胞系 组学方法:16S rRNA测序、单细胞RNA-seq 03、技术路线 04、研究结果 高糖饮食通过调节肠道菌群提高GMB小鼠的生存 作者在GMB小鼠模型中通过饲喂20%的葡萄糖评估高糖饮食对GBM的影响,发现5周的高糖饮食干预能显著提高小鼠存活时间(图1B),当天或2周的高糖饮食干预对小鼠存活时间没有影响(图1CD)。作者还检测了高糖饮食干预对进食量、饮水量、体重、随机血糖和空腹血糖水平的影响(图1EFG),结果表明5周的高糖饮食并没有引起糖尿病或体重增加。作者对无菌GMB小鼠模型进行同样实验,高糖饮食干预没有提高小鼠存活时间(图1H),表明高糖饮食通过肠道菌群提高GMB小鼠生存时间。对不同时期高糖饮食干预的小鼠粪便菌群多样性组成谱分析,5周的高糖饮食干预对肠道菌群组成产生显著影响。对健康和GMB小鼠的粪便菌群多样性分析表明高糖饮食干预和GMB均能影响肠道菌群多样性、丰富度和物种组成(图1IJK)。 图1 高糖饮食干预增强了小鼠的抗肿瘤免疫反应 为了验证高糖饮食干预是否依赖于抗肿瘤免疫反应,作者在免疫缺陷小鼠中重复了上述实验,结果显示高糖饮食干预对小鼠体重和存活时间均无显著影响(图2ABC),说明高糖饮食的肿瘤抑制作用是通过调节抗肿瘤免疫反应实现的。 为了分析高糖饮食对肿瘤微环境免疫细胞成分的影响,作者利用单细胞RNA-seq分析了小鼠脑组织CD45.2+肿瘤浸润免疫细胞(图2D)。结果显示,高糖饮食组中T细胞的频率略有增加,单核细胞和巨噬细胞比例下降(图2F)。差异表达基因分析进一步显示高糖饮食组差异表达基因富集在T细胞(图2G),CD8+T细胞频率略增加,Foxp3+调节T细胞频率降低(图2H),CD8+/ Foxp3+比例增加(图2IJ)。作者对癌组织也进行了单细胞RNA-seq分析,结果表明高糖饮食对癌细胞没有直接作用。 图2 CD8+T细胞中干扰素相关基因在抗肿瘤免疫反应中发挥关键作用 单细胞RNA-seq显示CD8+T细胞簇分成了两个亚簇,且两个亚簇的比例在高糖饮食组和对照组显著差异(图3A)。基因集富集分析显示在CD8+T细胞亚簇0中干扰素相关途径显著富集(图3B),干扰素激活相关基因表达增加(图3C)。根据癌症基因组图谱,高表达基因与GBM患者的高存活率具有关联性(图3D)。 为了验证CD8+T细胞是高糖饮食提高BGM小鼠存活的关键因素,作者在CD8+T细胞耗竭的小鼠模型中测试了高糖饮食的作用,结果表明高糖饮食无法显著提高BGM小鼠存活(图3D)。作者进一步测试了高糖饮食干预对免疫检查点抑制剂抗PD-1疗效的影响,结果显示高糖饮食组显著好于对照组(图3FG)。以上结果表明高糖饮食可以通过改变毒性CD8+T细胞水平提高抗肿瘤免疫反应,而且能诱导免疫检查点抑制剂的活性。 图3 肠道微生物脱硫弧菌科的定植抑制GBM肿瘤生长 通过对健康和GBM小鼠粪便菌群物种差异和标志物种分析,筛选到脱硫弧菌科细菌(Desulfovibrionaceae)在高糖饮食组中显著富集(图4ABC)。作者进一步通过对小鼠进行了脱硫弧菌饲喂实验并检测脱硫弧菌在肠道中的丰度,验证了高糖饮食能促进脱硫弧菌在肠道中的定植。 为了进一步研究脱硫弧菌是否能增强高糖饮食小鼠对BGM的抗肿瘤免疫反应,作者进一步构建了抗生素处理的肠道菌群耗竭小鼠模型(图4D)。结果显示,在此小鼠模型中高糖饮食不能提高存活率;同时喂食脱硫弧菌和高糖饮食能提高小鼠存活率(图4EF),喂食其它细菌则没有这种作用效果。通过给癌细胞偶联绿色荧光蛋白,作者通过流式细胞术和共聚焦成像发现喂食脱硫弧菌和高糖饮食能显著减少肿瘤细胞数量以及脑组织中央坏死,表明抑制了肿瘤生长(图4GHIJ)。以上数据说明高糖饮食能抑制肿瘤的发展而且脱硫弧菌在抗肿瘤免疫反应中发挥关键作用。 图4 口服脱硫弧菌能诱导无菌小鼠CD8+T细胞基因差异表达 为了验证脱硫弧菌抗肿瘤免疫反应与高糖饮食的关联性,作者在无菌BGM小鼠模型中饲喂脱硫弧菌和高糖饮食干预(图5A)。通过单细胞RNA-seq分析结果显示脱硫弧菌干预与高糖饮食干预呈现相似的免疫细胞组成,即CD8+T细胞频率的增加以及CD8+T细胞中干扰素相关基因的差异表达(图5BCD)。另外,结果显示喂食脱硫弧菌不仅增强抗PD-1的疗效,还能减缓体重变化,延长小鼠存活时间(图5FG)。以上结果充分说明脱硫弧菌在T细胞介导的抗肿瘤免疫反应中发挥关键作用,且能与抗PD-1协同发挥抗肿瘤作用。 图5 高糖饮食和抗PD-1联合治疗能创造更有效的抗肿瘤特征 为了研究整合使用高糖饮食和抗PD-1对肿瘤微环境的影响,作者进一步利用单细胞RNA-seq分析了肿瘤微环境免疫细胞类型和差异表达基因(图6A)。结果显示在整合组CD4+T细胞/Foxp3+ Tregs细胞比例显著增高(图6B),CD8+ T细胞中干扰素相关基因差异表达(图6C),与生存率相关的干扰素基因在CD4+T细胞中表达量增加(图6D)。CD4+T亚簇细胞分析显示细胞毒性基因在整合组中表达量显著增加(图6EF)。这些结果表明,CD8+ T细胞和CD4+ T细胞在高糖饮食与抗PD-1联合治疗对小鼠存活率的协同作用中发挥重要作用。 图6 05、研究结论 高糖饮食能提高胶质母细胞瘤小鼠模型的存活率; 高糖饮食通过调节肠道菌群提高对胶质母细胞瘤的抗肿瘤免疫反应; 高糖饮食能诱导脱硫弧菌在胶质母细胞瘤小鼠肠道中定植; 脱硫弧菌在抗肿瘤免疫反应中发挥关键作用; 高糖饮食和抗PD-1联合治疗可使T细胞在胶质母细胞瘤中发挥更有效的抗肿瘤特性。 图7本研究图文摘要



派森诺生物合作客户在微生物-肿瘤领域发表的部分文章 参考文献 Kim J, Kim Y, La J, et al. Supplementation with a high-glucose drink stimulates anti-tumor immune responses to glioblastoma via gut microbiota modulation. Cell Rep. 2023 Oct 31;42(10):113220. 