2024-03-27
在医学的广阔领域中,肝癌一直是我们面临的一大挑战。在多组学分析的助力下,人们逐渐揭开了其神秘面纱,开启了全新的研究视角。
全基因组测序让我们窥见了肝癌基因的变异图谱,转录组和蛋白质组学则揭示了癌细胞内复杂的分子交互网络,以及微生物与肝癌之间存在着的微妙关系。通过这些多组学数据的整合分析,不仅描绘出肝癌的全方位画像,更为我们提供了精准治疗的新思路。今天,我们将带您走进这个充满奥秘的世界,一起探索多组学分析如何助力肝癌的研究,为未来的精准治疗提供有力支持!
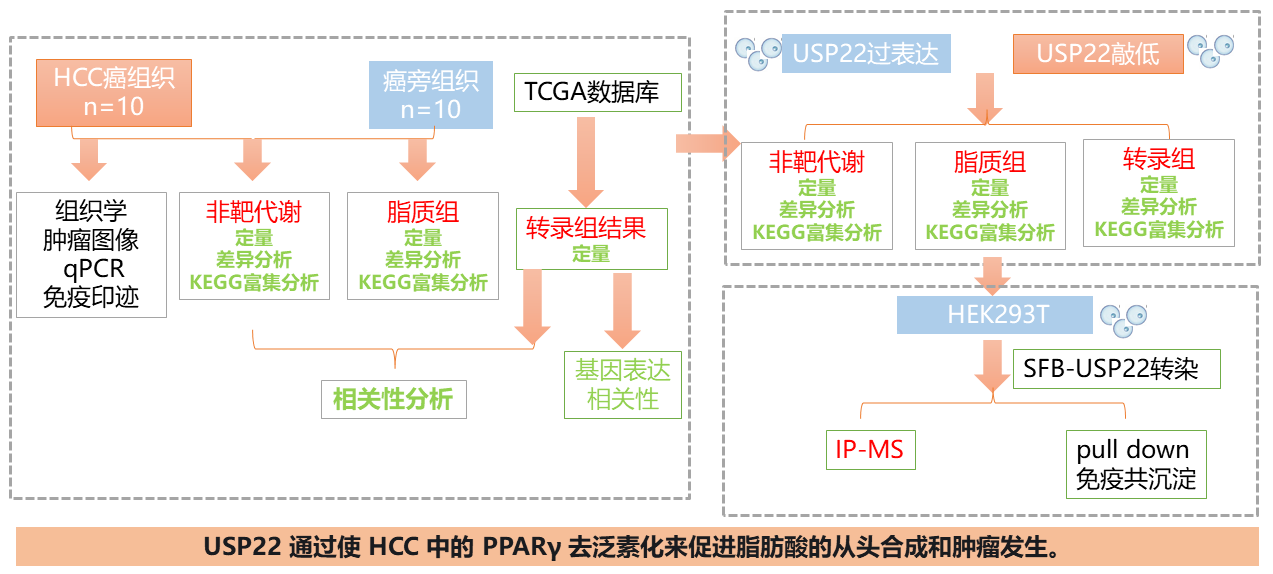
一、通路揭秘 题目:USP22 regulates lipidome accumulation by stabilizing PPARγ in hepatocellular carcinoma USP22通过稳定肝细胞癌中的PPARγ调节脂质组积累 期刊:Nature Communications 影响因子:16.6 背景 肝脏是糖、脂质和蛋白质代谢的关键器官。包括肝细胞癌(HCC)在内的各种肝脏疾病都与代谢异常有关。全球肝癌发病率正在迅速增加,部分原因是肥胖症的流行以及随后代谢相关脂肪肝(MAFLD)的发展。目前科学家们清楚地定义了HCC中基因改变的格局。然而,这一系列疾病过程的分子机制尚不清楚。 组学技术 转录组、代谢组学、脂质组学、IP-MS 其他技术 免疫组织化学、异种移植肿瘤模型、免疫沉淀、pull down、去泛素化试验、荧光素酶检测、组织学、免疫荧光、chip 技术路线 结果 结论 我们发现USP22是新生脂肪酸合成的关键调节因子。它直接与去泛素化相互作用,并通过K48连接的去泛素化稳定PPARγ,进而这种稳定增加了ACC和ACLY的表达。此外,我们发现USP22能够促进新生脂肪酸合成和HCC的肿瘤发生。然而在体内肿瘤发生实验中,通过抑制PPARγ、ACLY或ACC的表达,可以抑制这种致癌性。在HCC中,USP22的高表达与PPARγ、ACLY或ACC的表达呈正相关,并与不良预后相关。综上所述,我们确定了USP22调控的脂肪生成机制,该机制涉及HCC发生中的PPARγ-ACLY/ACC轴,并为通过抑制USP22靶向脂肪生成的治疗提供了理论依据。


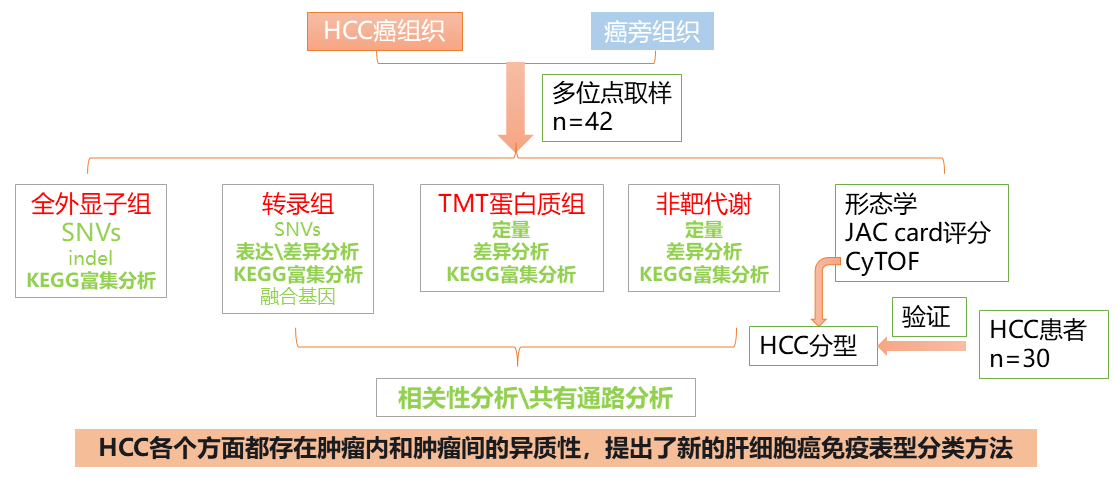
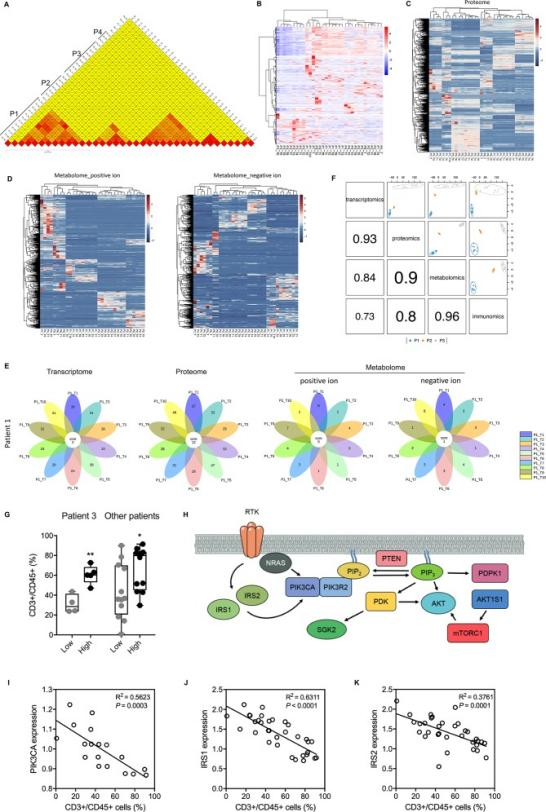
二、精准治疗 题目:Integrated multiomic analysis reveals comprehensive tumour heterogeneity and novel immunophenotypic classification in hepatocellular carcinomas 综合多组学分析揭示了肝细胞癌的综合肿瘤异质性和新的免疫表型分类 期刊:HEPATOLOGY 影响因子:13.5 背景 肝细胞癌(HCC)具有异质性,尤其是多灶性肿瘤,这降低了临床治疗的疗效。了解肿瘤的异质性是制定新的治疗策略的关键。然而,缺乏对HCC中肿瘤异质性的全面调查,并且关于肿瘤异质性的现有证据并未导致临床实践的改善。 组学技术 全外显子组测序、转录组、蛋白质组学、非靶向代谢组学 其他技术 形态学、JAC card评分、CyTOF 技术路线 结果 结论 使用全外显子组测序、RNA测序、蛋白质组学和代谢组学以及质谱细胞计量技术,我们证明了肿瘤细胞在所有维度上的显著异质性。发现局部免疫是HCC治疗的合适靶点,并确定了三种HCC亚型,它们在免疫状态、趋化因子/细胞因子和细胞代谢方面具有独特的肿瘤微环境。肿瘤细胞的PI3K-Akt信号和酮体代谢与HCC微环境中的CD8+ T细胞浸润相关。新的免疫表型分类可以简单地使用免疫组织化学通过测试具有明确截止值的两种标志物(CD45和Foxp3)来概括,显示出预后预测和治疗选择决策指导的价值。

派森诺生物合作客户在微生物-肿瘤领域发表的部分文章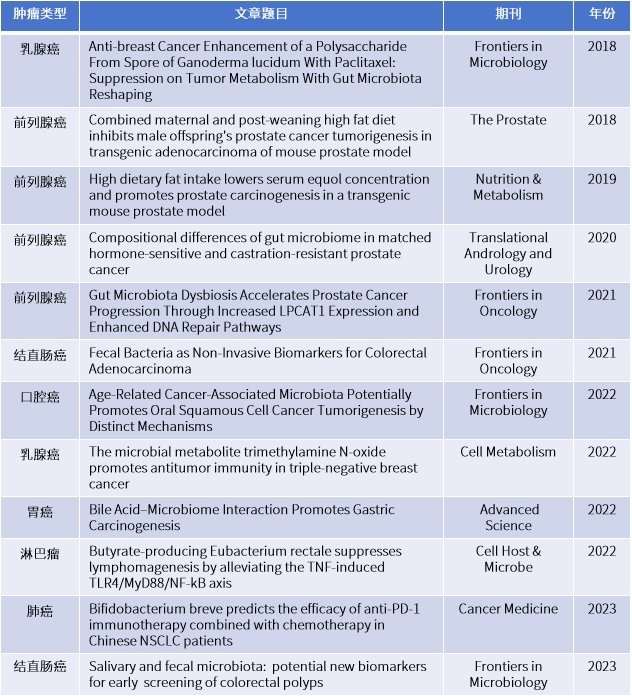
喜迎开学季,医口多组学联合分析免费送 派森诺生物作为国内早期涉足微生物多样性测序的高通量测序公司,在微生物-器官轴领域积累了丰富的项目经验。通过整合宏基因组学、微生物多样性组成谱测序、代谢组学、转录组学等多组学方法,我们建立了全面的实验平台和数据分析体系,提供从样本准备到文章发表的全方位服务。我们的多组学联合分析手段,如关联热图、网络图分析、Mantel检验和Procrustes分析等,能够深入挖掘微生物与器官轴之间的功能机制,为研究微生物-器官轴研究提供坚实的支持。


