
2024-03-29
发表杂志:Cell Host & Microbe 影响因子:30.3 发表时间:2023.9 通讯作者:The Sainsbury Laboratory | Wenbo Ma (tsl.ac.uk)
研究背景
植物病害对全球粮食安全和可持续性构成严重威胁,为制定有效的抗病策略,全面了解疾病发生背后的分子机制是十分重要的。截至到目前,植物不同组织、不同细胞类型对于病原菌的反应仍然不清楚。宿主不同细胞类型对病原菌产生异质性的反应取决于病原菌的分布位点和病原菌所处的不同发育状态。在真菌造成半活体侵染状态中,植物组织表面的病原菌发生孢子萌发,随后形成附着胞,该结构促进真菌通过角质层进入表皮细胞。一旦病原菌进入到细胞,会形成侵入性菌丝,在被侵染的细胞内部进行活体营养生长。在侵染后期,病原菌从活体营养转为死体营养,以凋亡组织为食,此时,真菌菌丝从起始侵染细胞渗入到临近细胞,开始新一轮的生长。 为了抵抗病原菌,植物进化出复杂且强大的免疫系统,核心成分是负责感知病原菌并激活免疫信号的免疫受体。细胞表面定位的类受体蛋白激酶(Receptor-like kinases, RLKs)或受体样蛋白(receptor-like proteins, RLPs)识别胞外非自身分子,激活下游分子事件(包括活性氧的爆发、钙离子内流、MAPK激活、转录重编程等)。另一类免疫受体是胞内核苷酸结合结构域富亮氨酸重复序列受体(nucleotide-binding domain leucine-rich repeat-containing receptors, NLRs),负责感知细胞内效应因子(由病原菌分泌),激活ETI免疫反应(effector-triggered immunity,ETI)。拟南芥中的NLRs蛋白根据N端结构域不同分为CC-NLR(coiled-coil-NLR or CNL)、TIR-NLR(Toll/interleukin-1 receptor/resistance protein NLR, TIR-NLR or TNL),RNL(RPW8-like helper NLR, RNL)。截至到目前为止,这些受体蛋白编码基因在病原菌侵染过程的不同细胞类型中的表达和功能尚未被清晰的描述。
研究结果
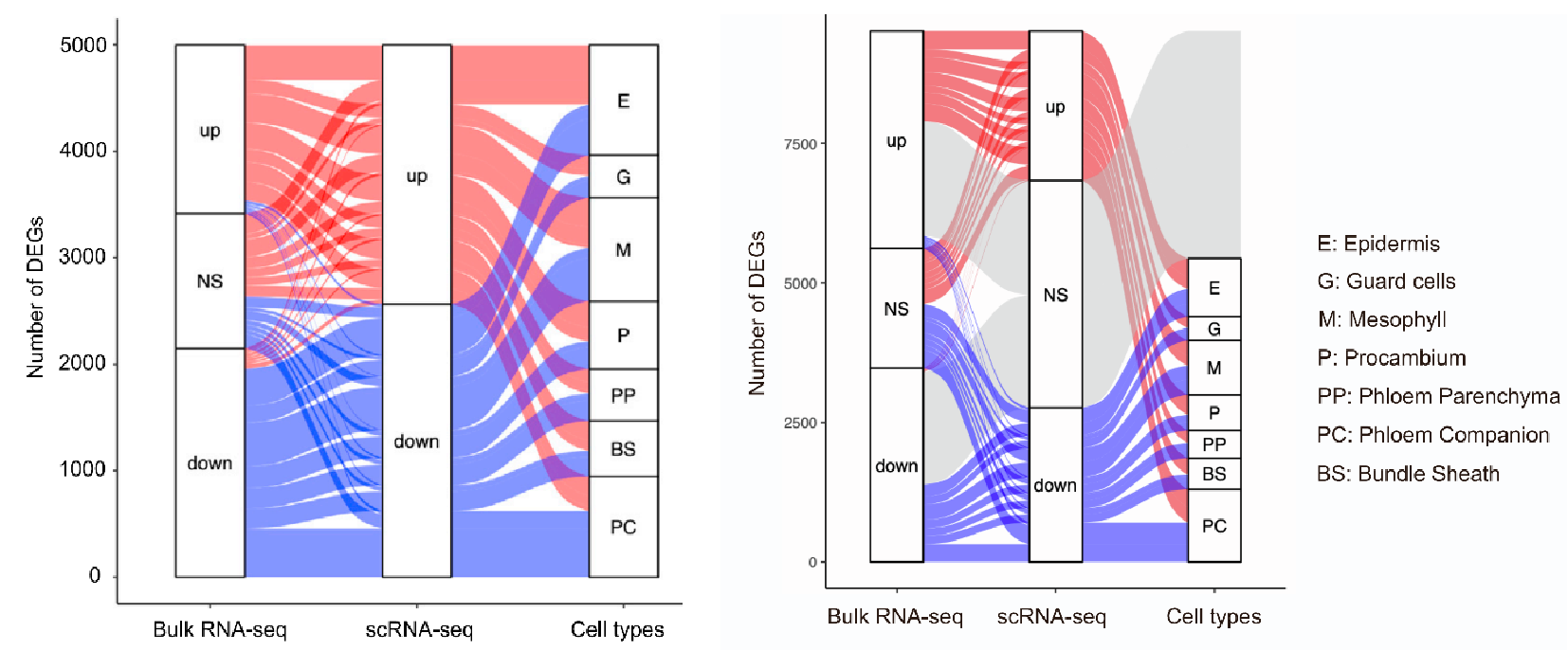
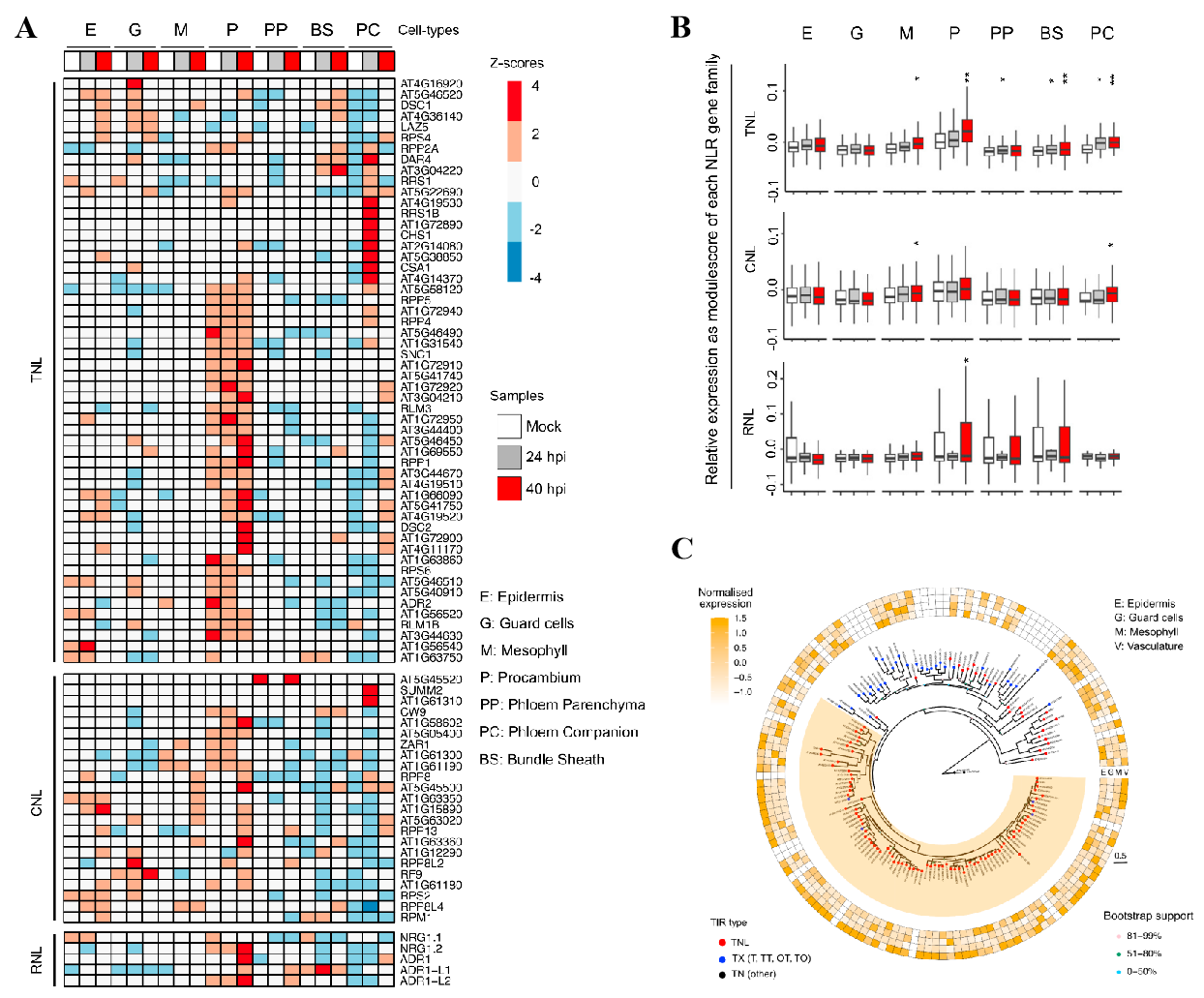
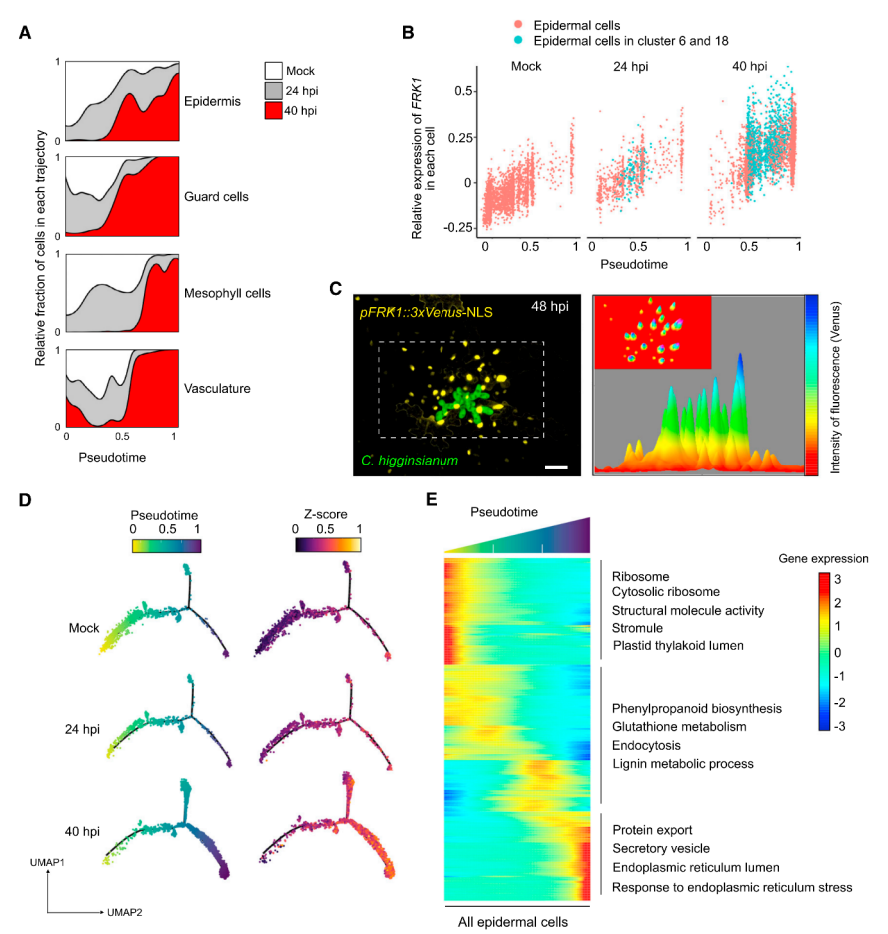
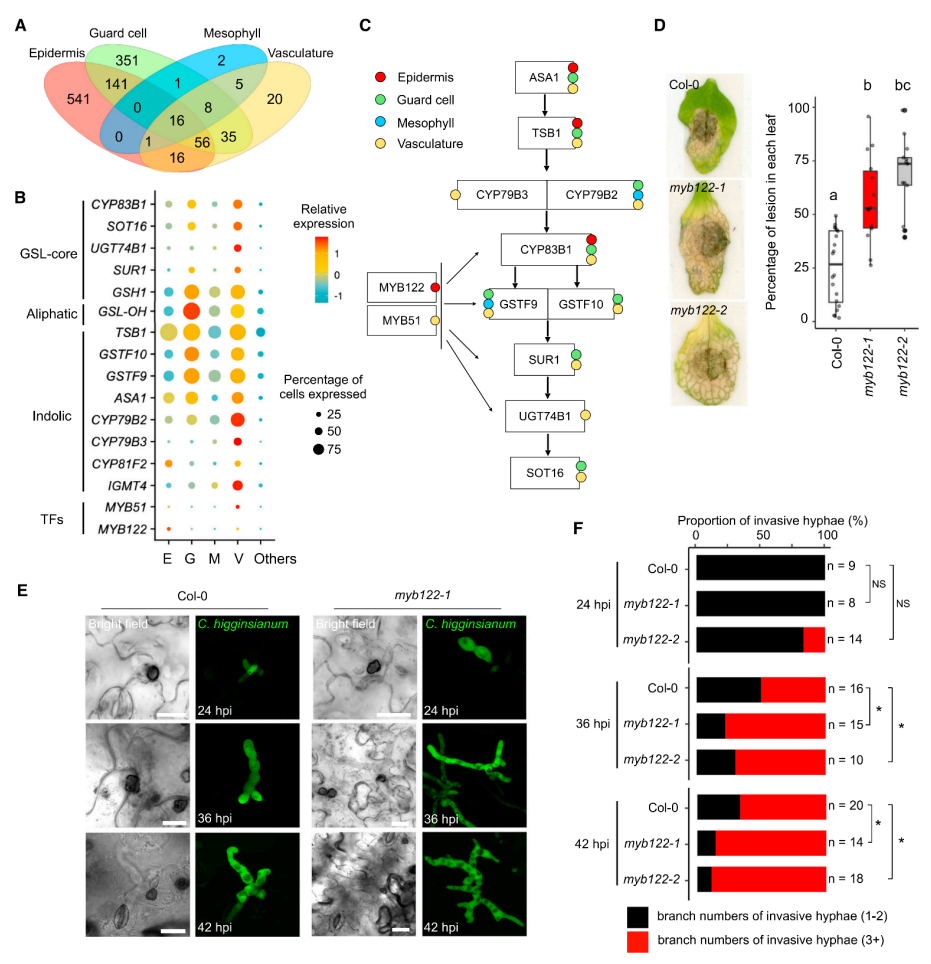
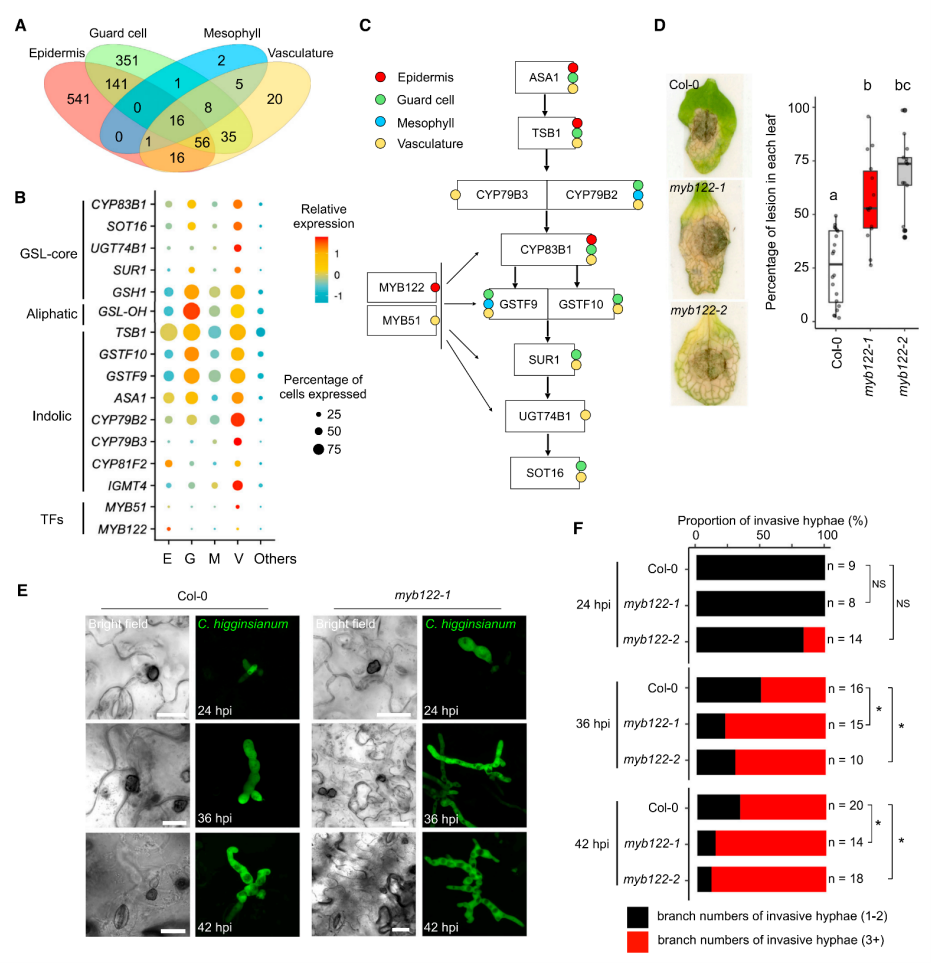
1.构建拟南芥炭疽病菌侵染期叶片细胞转录图谱 取生长15天的拟南芥幼苗,接种炭疽病菌孢子,利用活细胞成像监测病原菌侵染过程,发现只有很少细胞与病原菌直接接触(图1A),最终选择接种24小时和40小时的拟南芥叶片组织—分别代表早期侵染和后期侵染阶段,以未接种病原菌的拟南芥叶片为对照(图1B),酶解获得原生质体,利用10x单细胞测序平台进行单细胞转录组测序,经过质量控制、批次效应校正,共获得95,040个细胞,检测到23,809个基因,平均每个细胞检测到1583个基因。通过细胞聚类分析产生一个包含25个细胞簇的叶片转录图谱,根据每个细胞簇特异高表达的基因和已经报道的细胞标记基因将25个细胞簇注释为4个细胞大类(叶肉细胞、脉管细胞、表皮细胞、保卫细胞)和2个未知细胞群(cluster 6和18)(图1C)。统计每个细胞类群的样本来源,发现cluster 6, 13, 18, 23, 25主要来源于40-hpi样本组,而cluster 14, 21, 24主要来自对照组(图1D)。 图1 拟南芥炭疽病侵染实验及叶片细胞图谱 为了探究解离原生质体制备过程带来的转录偏差,研究者利用bulk转录组测序(对叶片组织直接提取RNA和对叶片酶解获得的原生质体提取RNA)评估了原生质体分离造成的转录改变,共获得1514个受原生质体制备诱导表达的基因,在每个cluster中统计表达这些基因的细胞占比,发现低于5%(图2A),并且这个比例在所有cluster中相对恒定,表明原生质体制备过程带来的转录组改变不会影响细胞分群。进一步通过检测线粒体和叶绿体基因比例评估原生质体制备对细胞造成的损伤,结果显示,每个细胞簇中只有1%的reads来自线粒体和叶绿体基因(图2B-C)。这些结果表明,特定的转录特征和细胞群的聚类主要由细胞类型和对真菌感染的反应决定。 图2 评估原生质体制备过程引入的转录变化 2.单细胞转录组与bulk转录组差异基因的比较分析 分析每个细胞类型在对照组和侵染组的差异基因(上调表达或下调表达),将这些基因与bulk转录组(对照组 vs 侵染组)获得的差异基因进行比较,发现一些bulk转录组水平没有差异的基因在单细胞转录组有差异,而在单细胞转录组中没有差异的基因在bulk转录组中有差异,表明bulk转录组和单细胞转录组对于鉴定差异基因都是必不可少的手段。 图3.不同转录组技术获得的差异基因比较 3.单细胞水平探究免疫受体编码基因的表达模式 拟南芥中有214个编码NLRs的基因,在本文的单细胞转录组中检测到了169个,其中71个基因表达量较低(<500 normalized reas counts),会带来分析上的误差,这些基因不纳入分析,重点关注余下的98个基因,分析它们在对照组和侵染组不同细胞类型的表达。结果显示:很多TNL基因(RPP1,RPP5,SNC1,RPS6)主要表达在原形成层细胞,并且很多原形成层细胞表达的NLRs基因在侵染组表达量升高(例如AT1G72910, AT3G04210, AT5G46450等)。一些TNLs基因,例如RPS1B, CSA1, CHS1,在病原菌侵染24小时的韧皮部伴胞中高表达,而在侵染40h阶段没有高表达,这种被病原菌瞬时诱导表达的基因可能与病原菌抑制宿主免疫有关(图4A)。 同一家族的RNLs基因在不同细胞类型中有不同表达模式:ADR1有3个同源基因—ADR1在原形成层中高表达,并在侵染40h后表达升高;ADR1-L1在维管束鞘细胞中相对高表达,但在原形成层和韧皮部薄壁细胞中受到病原菌诱导表达;ADR1-L2在原形成层细胞相对高表达,在原形成层、韧皮部薄壁、韧皮部伴胞中受到病原菌诱导表达。NRG1有2个同源基因—NRG1.1表达在表皮和原形成层细胞,NRG1.2主要表达在原形成层细胞,但有趣的是,两个同源基因在病原菌侵染之后发生相反模式的表达变化,NRG1.1在病原菌侵染之后表达下调,而NRG1.2表达上调,暗示在一些细胞类型中,植物防御基因受到病原菌的抑制。与RNLs和TNLs不同,CNLs没有呈现出维管系统富集表达的趋势。RF9在保卫细胞高表达,在病原菌侵染之后表达升高;SUMM2特异性的在韧皮部伴胞中受到病原菌的瞬时诱导表达(只在侵染24h阶段表达升高)(图4A)。除了单独察看每个NLRs编码基因的表达模式,单细胞可以分析同一个家族所有基因的整体表达,发现TNLs编码基因在四类维管相关的细胞类型(P, PP, BS, PC)和叶肉细胞(M)中受到病原菌的诱导表达,CNLs在叶肉细胞(M)和韧皮部伴胞(PC)中被诱导表达,RNLs在原形成层(P)中被诱导表达(图4B)。 由于TNLs蛋白包含TIR结构域,但TIR结构域也存在于其它蛋白中,为了检测TNLs细胞类型特异表达的模式是NLRs特异的,而不是因为TIR结构域的存在。研究者对拟南芥中所有包含TIR结构域的蛋白构建进化树,并分析它们在不同细胞类型中的表达模式。结果显示,包含TIR结构域的蛋白在进化树上被分为多组,其中一组主要由TNLs构成,只有这组的基因呈现出维管组织富集的表达,很多非TNLs组蛋白的编码基因在当前单细胞转录组中没有检测到,表明它们的表达量较低(图4C)。这些结果表明NLRs具有细胞类型特异的表达模式。进一步分析216个类受体蛋白激酶编码基因的表达模式,发现它们的表达模式与TNLs具有相关性,表明不同类别的免疫受体存在协同作用。 图4. 植物免疫受体基因表达模式图 4.基因表达的空间异质性与真菌的分布有关 真菌侵染是一个时空动态过程,只有一部分植物细胞与病原体直接接触。研究者通过单细胞拟时序算法对4大细胞类型(Epidermis, Guard cells, Mesophyll cells, Vasculars)分别进行轨迹分析,以捕获在病菌侵染过程中基因的动态变化:每一个细胞都会被赋予一个伪时间值表征它们在连续过程中的特定状态。结果显示,被病菌感染的细胞群体(来自侵染24-hpi、48-hpi样本)逐渐向伪时间值“1”偏移:24-hpi样本细胞位于拟时轨迹的中间位置,48-hpi样本细胞位于伪时间值“0.5”-“1”之间(图5A)。FRK1基因是植物免疫响应的标记基因,在粉霉病菌侵染位点被诱导表达。在本单细胞转录组数据集中,FRK1表达随着伪时间值的增加逐渐升高(图5B)。进一步通过构建pFRK1::3Venus-NLS拟南芥转基因株系,接种带有绿色荧光标记的炭疽病菌,利用活细胞成像监测FRK1的表达变化,发现黄色荧光信号(表征FRK1的表达)特异出现在距离真菌菌丝较近的细胞中,最强的荧光信号出现在被真菌定殖的细胞,随着与菌丝距离的增加,荧光信号逐渐降低,表明拟时序分析的伪时间值能够反映细胞距离侵染菌的位置(图5C)。在已报道的粉霉病菌侵染研究中,鉴定到44个在侵染位点受到强烈诱导表达(log2IFCI)>20)的基因,在本拟时序分析中察看这44个基因的表达,发现它们在伪时间值接近“1”的细胞中高表达(图5D)。综上,轨迹曲线所代表的细胞动态反应主要反映了真菌病原体在感染组织中的不均匀分布。 通过拟时序算法可以获得表达量具有伪时间依赖变化的基因集,表皮细胞拟时序分析共获得3个不同的基因集,包含767个基因,其中296个基因在伪时间值为“0”的细胞中高表达,这些基因没有报道过与植物抗病相关,因此,这些细胞可能距离真菌菌丝较远,它们的转录组没有受到病菌侵染的显著影响。有329个基因在伪时间值为“0.5”的细胞中高表达,其中包含一些植物抗病的调控因子,表明这些细胞中的免疫反应被激活。余下142个基因特异高表达在伪时间值为“1”的细胞中,包含经典的免疫响应基因FRK1和PEP2。这些结果揭示了距离侵染点不同位置的细胞抗病反应(图5E)。 图5.单细胞拟时序分析揭示细胞对真菌响应的时空异质性 5.保卫细胞特异性反应导致感染部位的气孔关闭 保卫细胞拟时序分析获得3个表达量具有伪时间依赖变化的基因集,在伪时间值为“1”的细胞中高表达的基因富集到丙酸代谢,氮代谢和硫代谢过程,这些过程特异在侵染点的保卫细胞中被激活(图6A-B)。已有研究报道硫代谢参与ABA响应,后者可以调控气孔关闭。拟南芥中有106个ABA相关基因,其中51个具有正调控作用,55个具有负调控作用,在单细胞转录组保卫细胞中察看这106个基因的表达,并映射回拟时轨迹,发现正调控因子在保卫细胞中的表达量随着伪时间值增加逐渐升高,负调控因子的表达量随着伪时间值增加逐渐降低,在其它细胞类型中则没有观察到类似的现象,表明ABA信号特异的在保卫细胞中被激活以应对病原菌的侵染(图6C)。 ABA调控气孔关闭,在阻止病原菌进入叶片质外体中发挥关键的作用。为了确定炭疽病菌感染叶片过程中气孔开度是否发生变化,研究者利用野生型拟南芥叶片,实施炭疽病侵染实验,在侵染40h阶段分别观察对照组叶片和侵染组(区分距离病菌入侵点较远和较近的区域)叶片气孔开度,发现气孔入侵点远端的开度大于入侵点附近,但都小于对照组,这些结果表明,面对病原菌的入侵,ABA信号在保卫细胞中特异性的被激活以关闭气孔,抑制病原菌的的进一步入侵。(图6D)。 图6.单细胞拟时序分析揭示病菌侵染过程中保卫细胞ABA信号的激活 6.GSL合成通路在侵染位点具有细胞类型特异性的激活模式 分析每个细胞类型中受到病菌侵染诱导表达的基因,表皮细胞、保卫细胞、叶肉细胞、维管细胞分别检测到541,351,2,20个基因(图7A),表明表皮细胞和保卫细胞中转录组受到病菌侵染的影响最剧烈,对这4组基因分别进行GO富集分析发现吲哚相关的生物过程被诱导。芥子甙(Glucosinolate,GSL))相关的代谢在抗病中发挥重要功能,在单细胞转录组数据集中察看该代谢过程相关的基因表达模式,发现很多GSL相关基因具有细胞类型特异的表达模式,例如ASA1和TSB1在表皮细胞、保卫细胞、维管细胞中被诱导表达,而在叶肉细胞则没有;SUR1和 SOT16在保卫细胞和维管细胞中诱导表达,而在表皮细胞和叶肉细胞则没有。这些结果表明不同细胞类型中激活不同的GSL代谢过程,产生不同的抗病化合物以应对病菌侵染(图7B-C)。 在调控GSL合成的转录因子中,MYB51和MYB122被检测到分别特异性的在维管细胞中、表皮细胞中受到病菌侵染的诱导表达,其中MYB122没有被报道过与抗病过程相关。研究者获得了MYB122的T-DNA插入突变体,接种炭疽病菌,与对照组相比,突变体叶片产生了增大的病斑(图7D)。活细胞成像观测到突变体中加速的真菌侵染,并且突变体中菌丝形成更多的分支,表明MYB122可能具有限制炭疽菌活体营养生长的潜在功能(图7E-F)。综上所述,MYB122可能通过调控表皮细胞中GSL相关抗病代谢物的合成调控植物抗病。 图7. MYB122在真菌入侵点的表皮细胞中被特异诱导表达产生抗病效应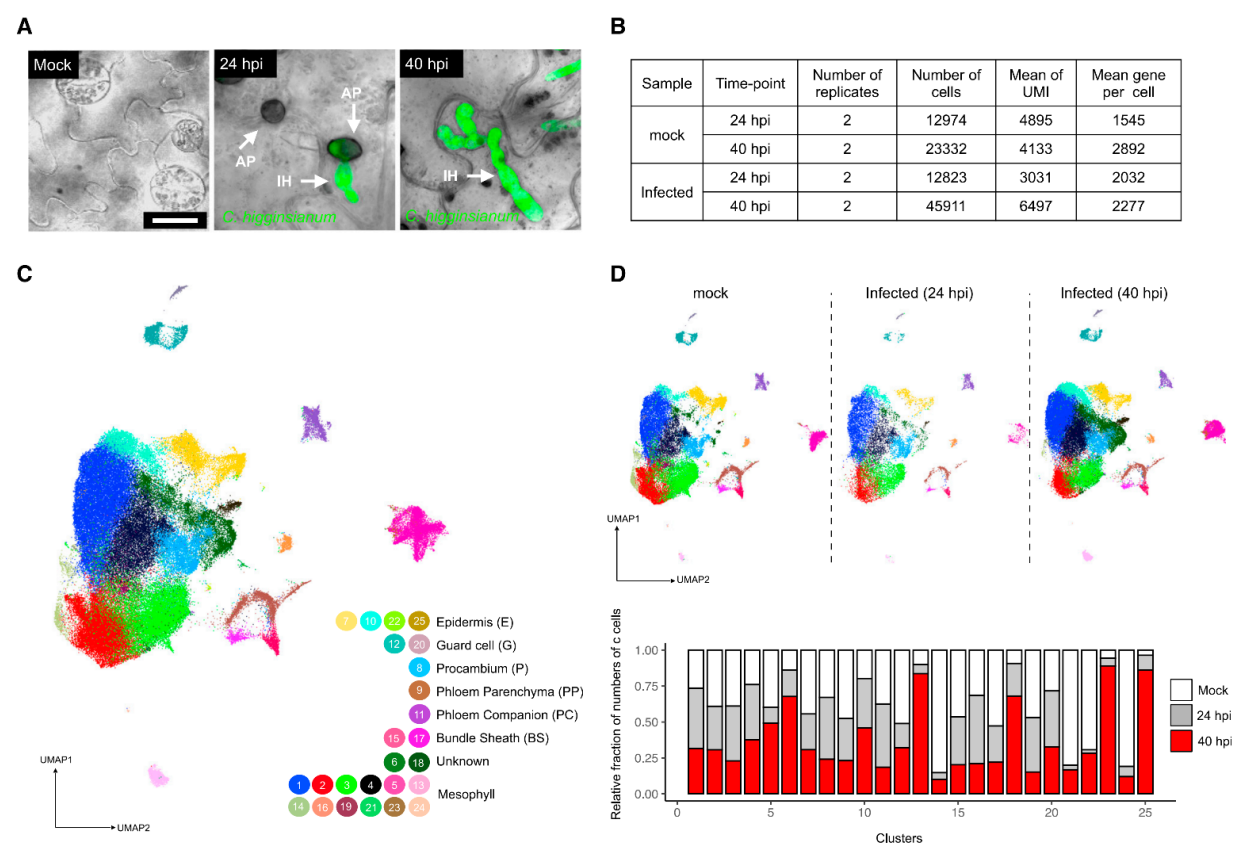

总 结
文章绘制了炭疽菌侵染的拟南芥叶片转录图谱,涵盖了叶片所有细胞类型,为研究者提供鉴定细胞类型特异的抗病反应提供了宝贵的数据集。作为察看基因表达模式的工具,研究者“批量”探究了免疫受体编码基因的表达模式,发现很多NLRs在维管相关细胞中高表达。单细胞轨迹分析揭示了不同空间位置的细胞抗病反应,尤其是病菌入侵点气孔保卫细胞通过激活ABA信号调控气孔关闭以抵抗病原菌的进一步入侵。对照组和病菌侵染组的差异基因揭示新的抗病调控基因—MYB122,为育种提供了思路。
原文链接: https://www.cell.com/cell-host-microbe/fulltext/S1931-3128(23)00344-X
派森诺单细胞项目经验 派森诺生物具有丰富的单细胞项目经验,涵盖人、鼠、猴、鸡、猪、羊、斑马鱼、团头鲂、鲫鱼、鳜鱼、蛙、蝌蚪、水稻、杨树、小麦、玉米、苜蓿、大豆、棉花、番茄、烟草、南瓜、小青菜、胡萝卜、川穹、檀香、芦苇、油桃、石斛、人参、牛至、金钱松、金银花、桑葚、丹参、工业大麻等模式及非模式物种,涉及肿瘤、肝脏、肺、角膜、视网膜、皮肤、胃黏膜、血管、血液、心脏、回肠、胫骨、睾丸、肌腱、胚胎、植物根、茎、叶、芽、花序、花药、果实、种子等多种组织类型,积累了丰富的细胞解离和分析经验,助力更深、更广的科研探索。