
2024-04-07
Part 01、微生物与癌症的关系
微生物组与癌症之间存在密切关系,这种关系正在成为医学研究领域的一个新兴焦点。微生物组与癌症的关系可以从三方面去认识: (1)某些已知的微生物病原体能直接导致癌症的发生,这些微生物也被称为致癌物,比如HPV病毒与宫颈癌、幽门螺杆菌与胃癌、EBV病毒与鼻咽癌等; (2)人体共生微生物与癌症发生的协同关系,研究表明肠道菌群或口腔菌群的失调能通过微生物-器官轴影响远端器官肿瘤的发生发展; (3)肿瘤内生微生物与癌症的关系,肿瘤组织内微生物通过调节肿瘤微环境促进或抑制肿瘤的发展。 微生物组与癌症存在复杂的互作关系,既有正面的抗癌作用,也有反面的致癌作用。深入研究这种关系,有助于我们更好地理解癌症的发生机制,开发新的预防和治疗方法,为癌症患者带来更多的希望和可能。 微生物组与肿瘤的互作关系1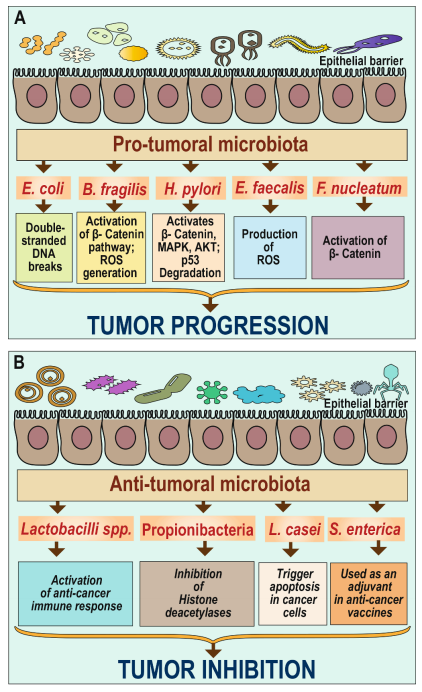
Part 02、微生物组-头颈癌研究方向
头颈癌是一类以解剖学分类命名的恶性肿瘤,主要发生在头部和颈部的器官、皮肤、软组织、肌肉和神经等部位。这类癌症的范围广泛,包括颈部肿瘤、耳鼻喉科肿瘤和口腔颌面肿瘤三大部分。头颈癌的发病率位于全部肿瘤发病率第六位,在全世界范围内,头颈癌每年的发病人数约为50-60万,头颈癌的五年生存率低于50%。引发头颈癌的风险因素包括遗传因素、长期吸烟或暴露于污染环境、HPV和EBV病毒感染,近几年的研究显示人体微生物组的失调也与头颈癌的发生存在一定的关联。 微生物组与头颈癌的互作研究主要有以下几方面: (1)鉴定与头颈癌发生密切相关的特定微生物种类:通过高通量测序分析头颈癌患者与健康人群的口腔微生物组差异,从而筛选出与头颈癌风险增加或降低相关的微生物标记物。这些标记物不仅有助于头颈癌的早期诊断,还可能为预防头颈癌提供新的干预靶点。 (2)微生物组影响头颈癌的发展的机制研究:某些微生物可能通过产生致癌物质、诱发慢性炎症或干扰宿主免疫系统等途径,促进头颈癌细胞的增殖、侵袭和转移。同时,微生物组也可能与头颈癌患者的预后相关,通过影响肿瘤微环境、免疫应答等机制,对治疗效果和生存期产生影响。 (3)个体差异对微生物组与头颈癌关系的影响:通过深入研究不同人群、不同基因背景下微生物组的差异,有望为头颈癌的个性化治疗提供更为精准的指导。 (4)微生物组在头颈癌治疗中应用:探索如何利用益生菌、抗菌药物等手段调节口腔微生物组,以增强头颈癌治疗的疗效并减轻副作用。同时,针对微生物组开发的新型免疫疗法和靶向疗法也为头颈癌的治疗提供了新的可能。
Part 03、微生物组-头颈癌研究思路介绍
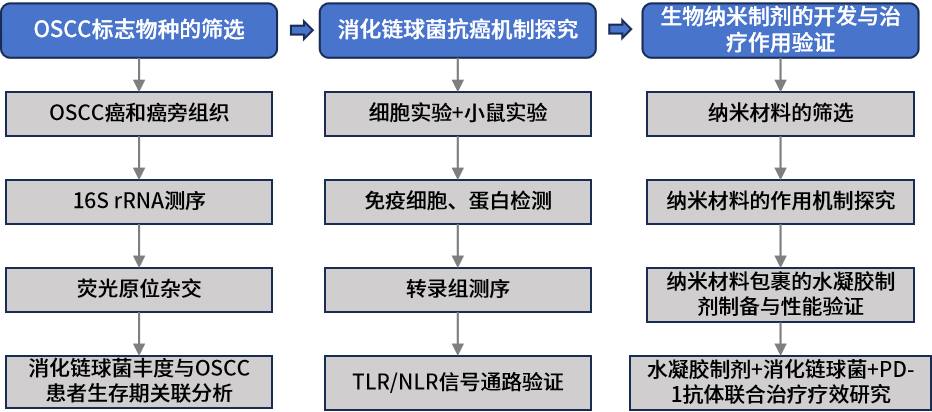
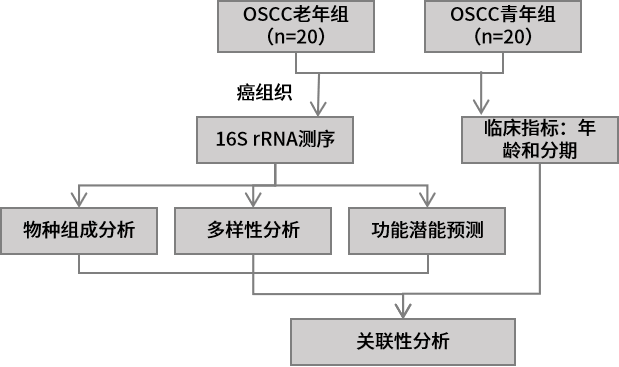
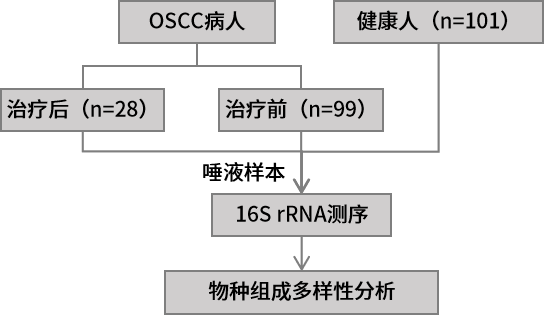
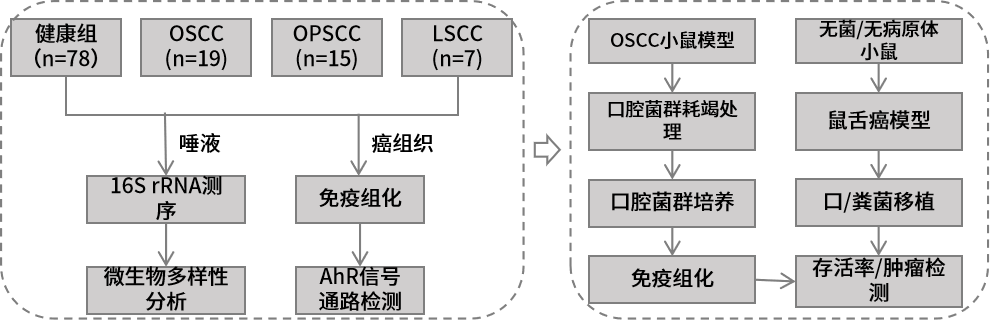
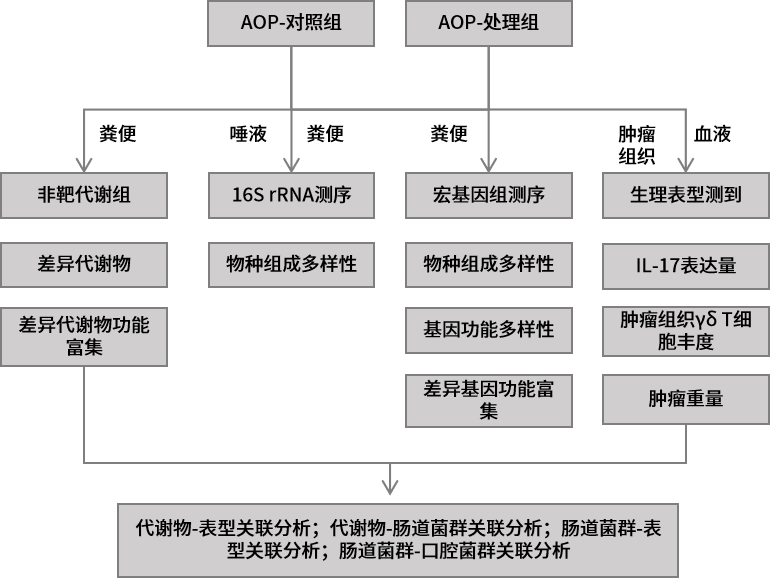
1.生物材料介导的口腔菌群调节能增强免疫检查点抑制剂的治疗作用 实验材料:口腔鳞状细胞癌(OSCC)病人的癌和癌旁组织,OSCC小鼠模型,免疫缺陷小鼠等。 组学方法:16S rRNA测序、真核转录组测序。 研究结论:由于宿主的免疫系统受到宿主-微生物群相互作用的影响,因此可以利用调节微生物群的手段来增强癌症治疗的有效性。本研究中,作者发现肿瘤组织内具有高丰度消化链球菌(Peptostreptococcus)的OSCC患者生存期更长。随后作者对消化链球菌的抗肿瘤作用机制进行了探究,发现消化链球菌能诱导宿主的免疫反应。为了进一步探索消化链球菌在OSCC肿瘤临床治疗上的应用,作者创新性开发了银纳米材料(抑制消化链球菌的竞争菌)与肿瘤递送消化链球菌联合治疗方法,在小鼠实验中实现增强抗肿瘤的效果。最后,作者在患有皮下或原位小鼠OSCC肿瘤的小鼠中,使用两种成分(银纳米颗粒水凝胶和外源性外源性消化链球菌)与检查点抑制PD-1抗体联合治疗能协同增强PD-1抗体的免疫治疗效果。本研究结果表明,生物材料可以被设计成调节人类微生物群以增强抗肿瘤免疫反应。 2.不同年龄段口腔癌患者具备独特的肿瘤内生菌特征 实验材料:口腔鳞状细胞癌组织(20例60岁以上病人+20例50岁以下病人) 组学方法:16S rRNA V4V5区测序。 研究结论:近些年的流行病学研究显示口腔鳞状细胞癌(OSCC)在年轻人中的发病率呈现增长趋势。口腔菌群的失衡是肿瘤发生的风险因素,作者推测年轻OSCC患者肿瘤组织内特异性的细菌组成可能促进了OSCC的发生。基于此,作者比较了老年患病组(大于60岁)和年轻患病组(小于50岁)的OSCC组织内生菌的物种多样性。结果发现Ralstonia属、Prevotella属、Ochrobactrum属细菌在年轻患病组丰度显著升高,而Pedobacter属细菌在老年患病组得到富集,梭杆菌属(Fusobacterium)在两组中均呈现高丰度。功能潜能预测分析显示年轻患病组和老年患病组的肿瘤内生菌在代谢和信号通路均呈现显著差异。最后,作者推测老年患病组和年轻患病组肿瘤内微生物组成和功能的差异性一定程度上能解释细菌在不同年龄阶段OSCC发生过程中发挥不同的作用。 3.口腔癌治疗前后口腔菌群组成的变化规律 实验材料:99例口腔鳞状细胞癌病人(治疗前)+28例随访48个月的病人(治疗后)+101例健康人的唾液样本。 组学方法:16S rRNA V4区测序。 研究结论:作者分析了口腔鳞状细胞癌(OSCC)病人治疗前后,以及病人组和健康组的唾液样本中微生物组成多样性。结果显示相比于健康组,OSCC病人唾液中含有更高丰度的潜在致病菌,如Streptococcus anginosus、Abiotrophia defectiva、Fusobacterium nucleatum等。治疗后的病人唾液微生物群的α-多样性降低,微生物组成谱也发生显著变化。作者推测OSCC患者可以通过服用益生菌、合理饮食、菌群移植等方法调节口腔菌群,进而从中受益。 4.口腔菌群的失调能促进头颈癌的发展 实验材料:临床唾液样本(78例健康+19例口腔鳞状细胞癌+15例口咽部鳞状细胞癌(OPSCC)+7例喉部鳞状细胞癌(LSCC)),无菌小鼠、无病原体小鼠、OSCC小鼠模型等。 组学方法:16S rRNA V1V2区测序 主要结论:前期研究显示头颈部鳞状细胞癌(HNSCC)的口腔菌群发生失衡以及存在肿瘤内生菌,本研究旨在鉴定和验证HNSCC患者与健康人的口腔菌群特征。该研究证实了前期的发现,即HNSCC患者口腔菌群中乳杆菌(Lactobacillus)丰度升高,奈瑟氏菌(Neisseria)丰度下降。作者在小鼠模型中通过抗生素耗竭口腔菌群以及口/粪菌移植的方法进一步验证了口腔菌群的失调能促进HNSCC的发展。作者通过分离培养的方法在HNSCC小鼠中也发现了乳杆菌的富集,并进一步验证了乳杆菌的富集能激活芳烃受体(AhR)信号通路,促进肿瘤的发展。 5.代谢组和宏基因组分析揭示口腔癌免疫治疗对肠道菌群和代谢的影响 实验材料:牙周炎OSCC小鼠(AOP对照组,n=6),牙周炎OSCC小鼠+TCR γδ单抗(AOP处理组,n=5) 组学方法:16S rRNA V4V5区测序、非靶代谢组、宏基因组测序。 主要结论:前期研究显示牙周炎是OSCC的风险因素,而牙周炎相关的人体微生物菌群能通过激活γδ-T细胞促进OSCC的发展。靶向γδ-T细胞的免疫治疗对于缓解多种癌症具有显著的疗效,但是其中的作用机制还没有得到完全阐述。本研究构建了牙周炎OSCC小鼠模型,并对其进行γδ-T细胞靶向治疗,通过非靶代谢组、16S rRNA测序、宏基因组测序对小鼠粪便样本进行了分析。结果显示靶向γδ-T细胞治疗能影响肠道中癌症相关代谢物的合成,并显著改变了小鼠肠道菌群beta-多样性。关联分析表明靶向γδ-T细胞治疗能显著提高鼠乳杆菌(Lactobacillus murinus)的丰度,且该物种与γδ-T细胞丰度、腺嘌呤呈显著相关性。本研究为γδ-T细胞在OSCC癌症发展过程中的作用机制提供了新的视角,为未来的研究和临床监测方案的开发确定相关的生物标志物。




参考文献 1.Singh D, Khan MA, Siddique HR. Therapeutic implications of probiotics in microbiota dysbiosis: A special reference to the liver and oral cancers. Life Sci. 2021 Nov 15;285:120008. 2.Zheng DW, Deng WW, Song WF, et al. Biomaterial-mediated modulation of oral microbiota synergizes with PD-1 blockade in mice with oral squamous cell carcinoma. Nat Biomed Eng. 2022 Jan;6(1):32-43. 3.Zhang Z, Feng Q, Li M, et al. Age-Related Cancer-Associated Microbiota Potentially Promotes Oral Squamous Cell Cancer Tumorigenesis by Distinct Mechanisms. Front Microbiol. 2022 Apr 15;13:852566. 4.Mäkinen AI, Pappalardo VY, Buijs MJ, et al. Salivary microbiome profiles of oral cancer patients analyzed before and after treatment. Microbiome. 2023 Aug 5;11(1):171. 5.Frank DN, Qiu Y, Cao Y, Z, et al. A dysbiotic microbiome promotes head and neck squamous cell carcinoma. Oncogene. 2022 Feb;41(9):1269-1280. 6.Wei W, Li J, Tang B, et al. Metabolomics and metagenomics reveal the impact of γδ T inhibition on gut microbiota and metabolism in periodontitis-promoting OSCC. mSystems. 2024 Feb 20;9(2):e0077723.
喜迎开学季,医口多组学联合分析免费送 派森诺生物作为国内早期涉足微生物多样性测序的高通量测序公司,在微生物-器官轴领域积累了丰富的项目经验。通过整合宏基因组学、微生物多样性组成谱测序、代谢组学、转录组学等多组学方法,我们建立了全面的实验平台和数据分析体系,提供从样本准备到文章发表的全方位服务。我们的多组学联合分析手段,如关联热图、网络图分析、Mantel检验和Procrustes分析等,能够深入挖掘微生物与器官轴之间的功能机制,为研究微生物-器官轴研究提供坚实的支持。