2024-05-25

胞外小囊泡(sEV)是由细胞分泌的微小囊泡,携带蛋白质、脂质和RNA等多种内容物,广泛存在于组织微环境中,充当细胞间信息交流的“信使”角色,在免疫反应、病毒致病性和癌症进展中发挥重要作用。许多研究表明,受到来源细胞复杂和组织生理状态变化等因素影响,细胞释放的sEV数量和组成会有很大的差异。传统的基于批量RNA测序的方法往往将这些复杂的信号结合在一起,因此无法代表sEV群体的真正复杂性。目前尝试进行sEV异质性分析方法的主要局限性在于需要分离和纯化sEV,会导致丢失有关原始组织微环境的信息。因此,迫切需要开发一种能够同时捕获细胞和sEV异质性的方法,在基于液滴的scRNA-seq数据集中分辨sEV,弥合sEV生物学和单细胞转录组学之间的差距。 在国家自然科学基金项目资助下,中国科学院北京生命科学研究院赵方庆团队建立了胞外小囊泡异质性追踪算法SEVtras(sEV-containing droplet identification in scRNA-seq data),用于在液滴分辨率下描绘sEV信号并评估不同细胞类型的sEV分泌活性。
SEVtras-鉴定含有sEV液滴的可行性评估
研究人员为了探究该方法的可行性,首先使用NTA分析观察到3种小鼠组织经过标准scRNA-seq预处理步骤后上清液中存在大量sEV。使用NanoLuc标记的sEV(其在引入特定物质时发光)掺入样品中,并进行标准scRNA-seq预处理步骤,观察到大量的sEV保留。然后分离了胞外小囊泡、大囊泡和细胞碎片,进行了单独的转录组测序。结果显示,胞外小囊泡的转录谱与其他几类存在显著差异,并且能够通过胞外小囊泡基因集的富集来识别。基于这些发现,研究人员设计了一种利用期望最大化算法的胞外小囊泡算法,并提出衡量胞外小囊泡分泌活性的度量指标。 图1 SEVtras的可行性评估与分析流程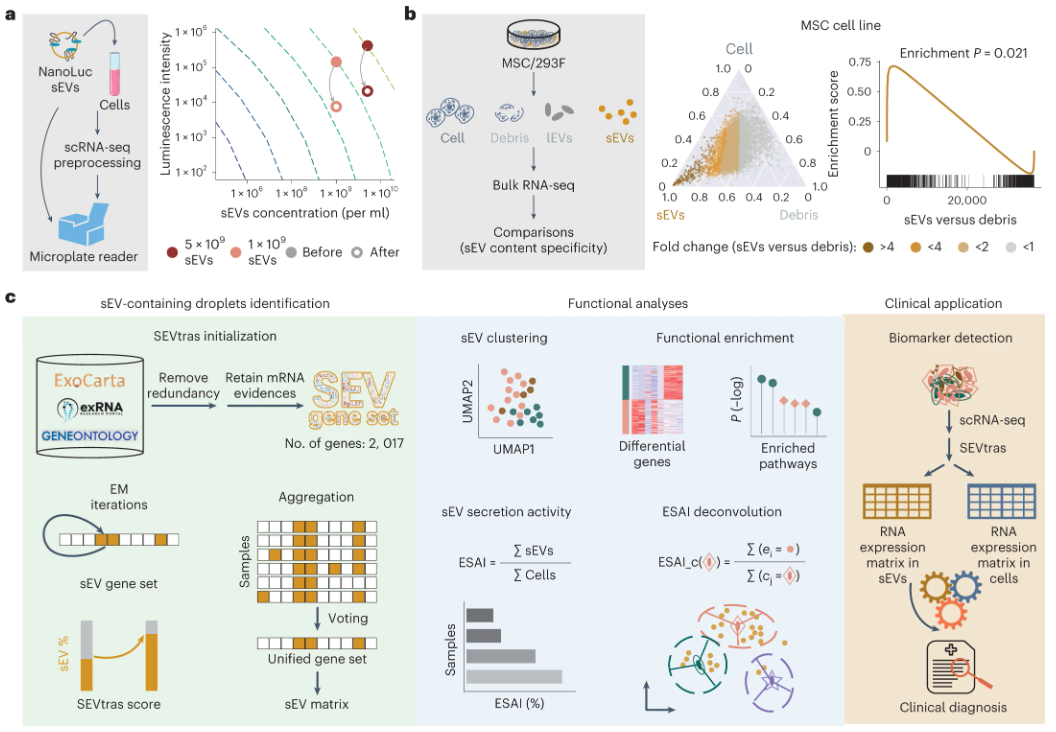
SEVtras-性能评估
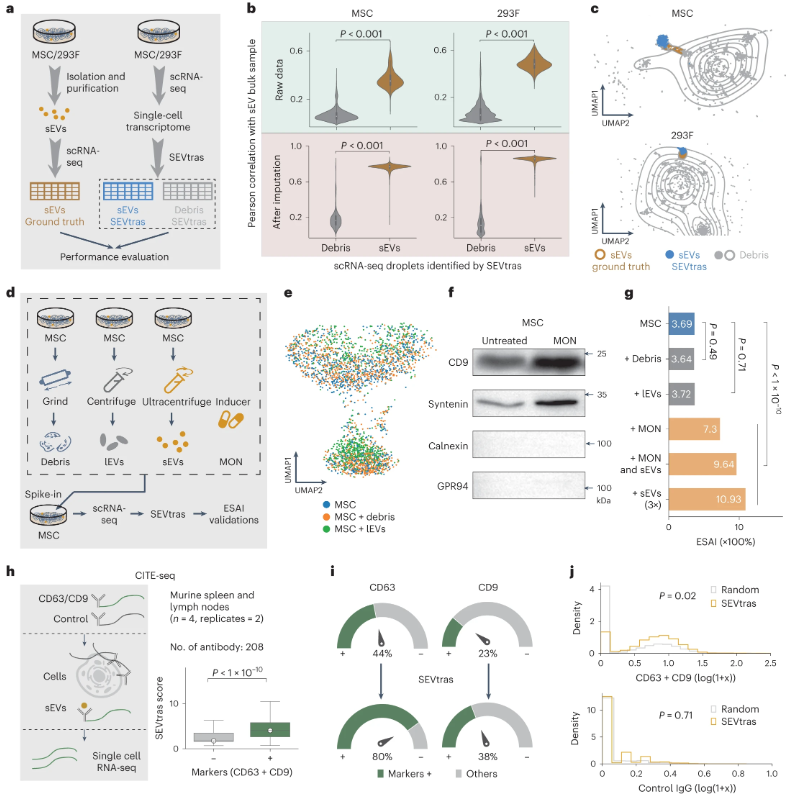
为了评估算法的性能,设计了三种类型的单细胞测序实验:(1)模拟数据评估:基于肥大细胞及其sEV通过模拟含有细胞碎片或sEV的无细胞液滴生成数据集,SEVtras表现出稳健的性能(AUC > 0.85),表明它可以耐受每个液滴的sEV分数和UMI计数的影响。(2)与真实sEV scRNA-seq数据的相似性评估:用MSC和293F细胞系来源sEV进行了scRNA-seq。发现与SEVtras鉴定出的含有碎片的液滴相比,鉴定含有sEV的液滴与实况数据集之间的表达相关性更高。UMAP分析表明,含有sEV的液滴分布与实验分离的sEV的分布紧密重叠,而碎片的分布则不同。证明了SEVtras可以可靠地检测scRNA-seq数据集中的sEV信号。(3)评估SEVtras在复杂背景下的稳健性:进行了涉及细胞碎片和大EV(IEV)的加标实验,将两种类型的刺突分别加入MSC单细胞悬液中进行scRNA-seq和SEVtras鉴定。细胞的转录表达谱高度重叠,表明刺突不影响细胞状态。引入一种新的指标sEV分泌活性指数(ESAI),来量化细胞的sEV分泌活动,即给定样品中含有sEV的液滴数量与细胞数量的比值。 除此之外,在培养的MSC细胞中加入莫能菌素钠盐(MON)来刺激MSC的分泌活性以及加入3X分离的sEV以进一步评估鉴定特异性。基于以上验证,证明SEVtras可以特异性识别scRNA-seq样品中的sEV信号。 图2 SEVtras的性能验证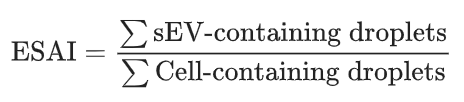
SEVtras-鉴定不同细胞类型的sEV分泌活性
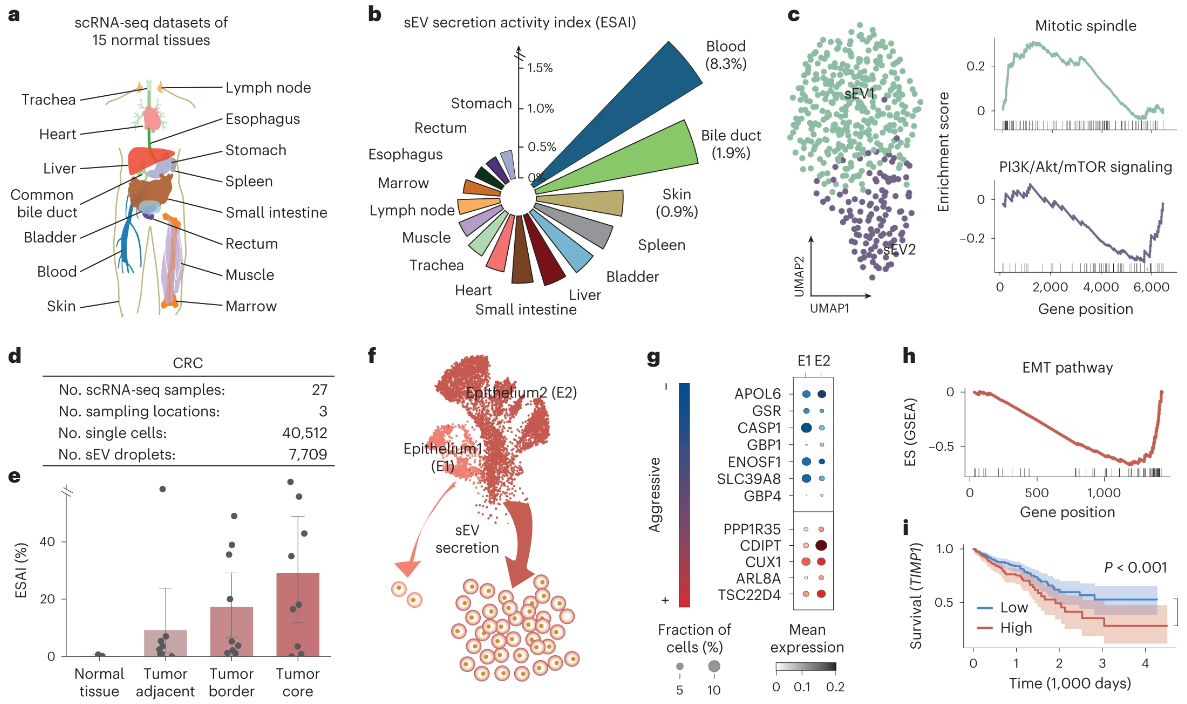
为了将SEVtras初步应用于研究不同细胞类型的sEV异质性,对MSC和293F细胞系的scRNA-seq数据进行UMAP分析,以比较MSC和293F细胞系sEV的转录表达谱,来源于2种细胞系的sEV之间明显分离,但与其各自的原始细胞重叠。表明来源于不同细胞类型的sEV具有不同的特征,从而为在复杂的组织微环境中准确地反卷积不同细胞类型sEV分泌活性奠定了基础。为了进一步验证SEVtras鉴定不同细胞类型的sEV分泌活性,将该算法应用于15种正常人体组织的scRNA-seq数据集,以证明SEVtras应用于单细胞转录组学分析的潜力。在条形码验证和UMI过滤后,共获得657407个液滴,分析每种组织的ESAI,发现组织的sEV分泌能力各不相同(ESAI= 1.1±2%)。基于ESAI,血液样品排名第一,与以前的研究一致,皮肤也显示出比其他组织更高的ESAI,这与真皮内的白色脂肪细胞具有高sEV分泌能力的观察结果一致。这些结果表明ESAI可以有效地代表不同组织的sEV分泌活性,并且SEVtras可以捕获sEV分泌中的组织异质性。 图3 MSC和293F细胞的sEV分泌活性 图4 SEVtras深化的15种人体组织的单细胞转录组分析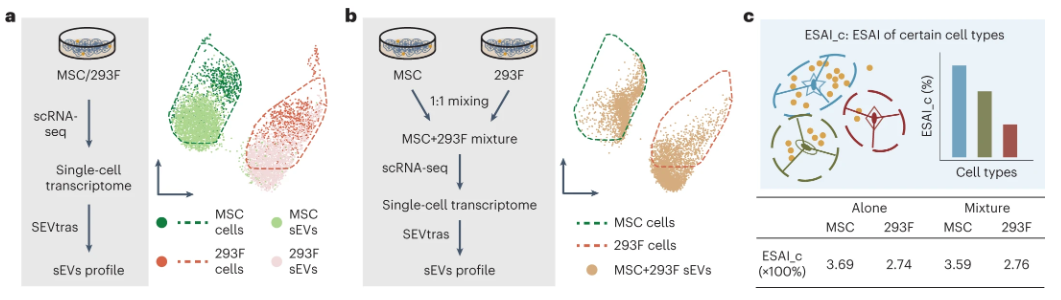
SEVtras-复杂疾病背景下的广泛适用性
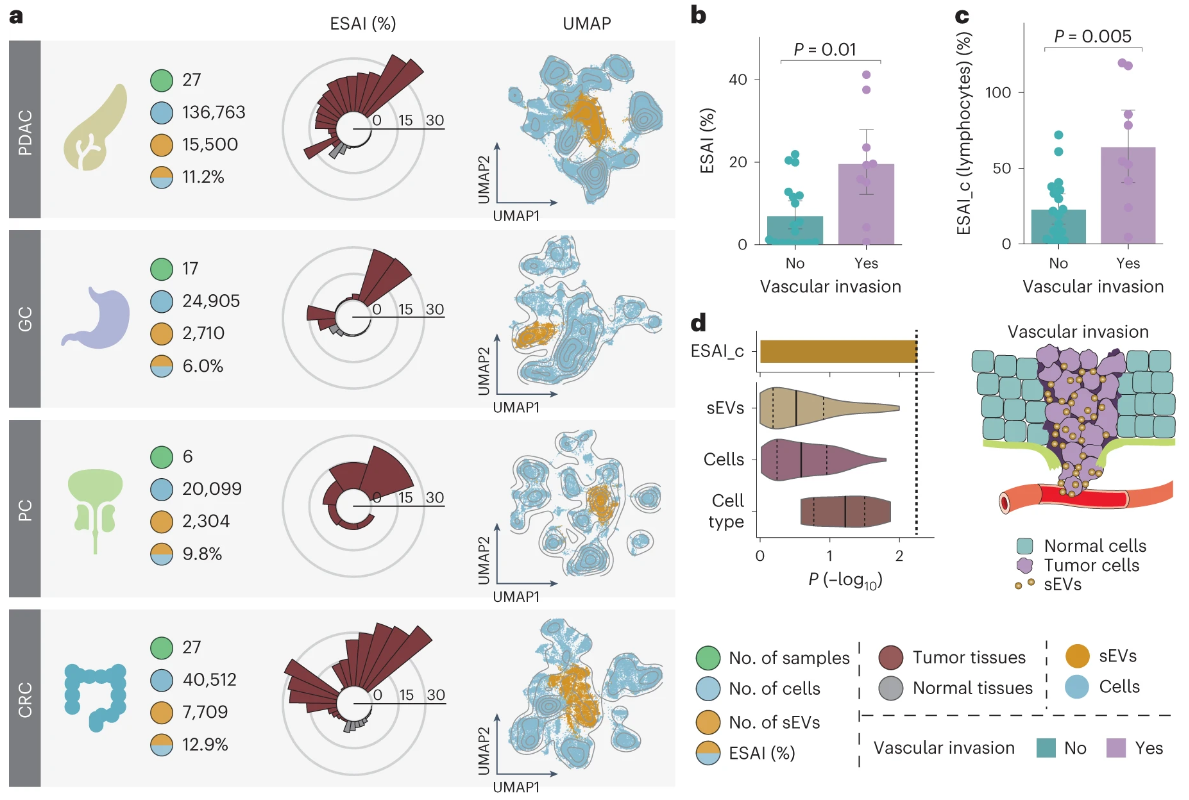
为了进一步探索SEVtras在复杂疾病背景下的广泛适用性,收集了4种不同癌症的scRNA-seq数据集,包括胰腺导管腺癌、胃癌、前列腺癌和大肠癌,总计77个样本,超过220000个细胞。线性回归模型消除批次效应,计算这些样品的ESAI,并观察到平均ESAI为10.6±12.3%,证实了与正常组织相比,肿瘤sEV分泌活性升高。但不知这种变异性的影响的因素是样品是否来源于肿瘤。然后将临床信息与scRNA-seq数据集相匹配以探索sEV分泌活性在肿瘤进展中的作用。在PDAC数据集中,血管侵袭与ESAI高度正相关。表明ESAI可能指示早期的肿瘤进展。同时追踪了sEV的来源细胞类型以确定血管侵袭组中sEV分泌活性升高的诱因,分析表明血管侵袭组淋巴细胞的ESAI明显高于无血管侵袭组,而淋巴细胞数量在2组中没有观察到显著差异。表明ESAI在区分肿瘤血管侵袭方面具有潜力。 图5 ESAI与早期肿瘤的血管侵袭密切相关 综上所述,SEVtras能够在分析sEV时达到极高分辨率-单液滴水平,从而更全面地探索源自不同组织的sEV的固有异质性,同时它能够建立sEV与其来源细胞类型之间的联系,能够从胞外的视角挖掘出数据中隐藏的生物学信息,有助于更深入地理解组织生理病理活动背后的机制。SEVtras能够特异的识别单细胞测序数据中的胞外小囊泡,并且揭示了不同类型细胞的胞外小囊泡分泌活性,为目前单细胞转录组分析提供了独特的“胞外视角”。