
2024-07-04

胰腺导管腺癌(PDAC)是致死率最高的实体恶性肿瘤之一,预计将在2030年前成为第二大肿瘤致死原因。对于可进行手术切除的胰腺癌患者,术前是否先进行化疗(即新辅助化疗),是摆在医生面前的两难抉择。若不开展新辅助化疗直接手术,患者很大比例术后会出现胰腺癌的复发、转移。若术前化疗,对于部分可以直接手术的患者对化疗不敏感,肿瘤越长越大,反而耽误了手术的最佳时机。医生该怎么选?这一决策不仅考验着医生的专业判断力,也凸显了个性化医疗策略在胰腺癌治疗中的重要性。 针对以上困境,上海交通大学医学院附属瑞金医院联合复旦大学附属肿瘤医院研究团队展开了前瞻性研究,2024年1月29日在Nature Medicine(IF 58.7)上发表了题为 “Prospective observational study on biomarkers of response in pancreatic ductal adenocarcinoma”的研究论文,直面胰腺导管腺癌(PDAC)治疗决策难题。该研究纳入了1171例接受根治性切除术的胰腺癌患者,并随机挑选了其中191例患者的组织样本进行DIA蛋白质组学分析,揭示了PDAC的功能蛋白模块并构建了预后模型(亮点①)。同时,通过数据融合分析,发现NDUFB8和CEMIP2作为生物标志物可以精准预测PDAC患者对辅助化疗的敏感性(亮点②),经PRM蛋白质组学和IHC验证,标志物的预测价值及预后模型的有效性得以确证,为化疗方案的个性化开辟新径,标志着PDAC精准医疗领域的重大进步。
队列设计 发现队列:RJ-cohort1(n=191)从RJ-cohort中随机挑选191名患者; 内部验证队列:RJ-cohort2(n=50)和RJ-cohort3(n=386); 外部验证队列:上海SH-cohort(n=466)和法国FR-cohort(n=230);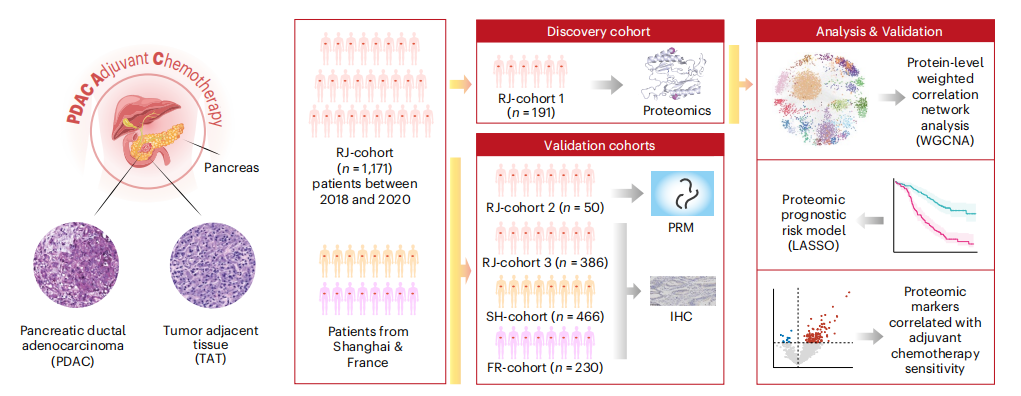
研究思路
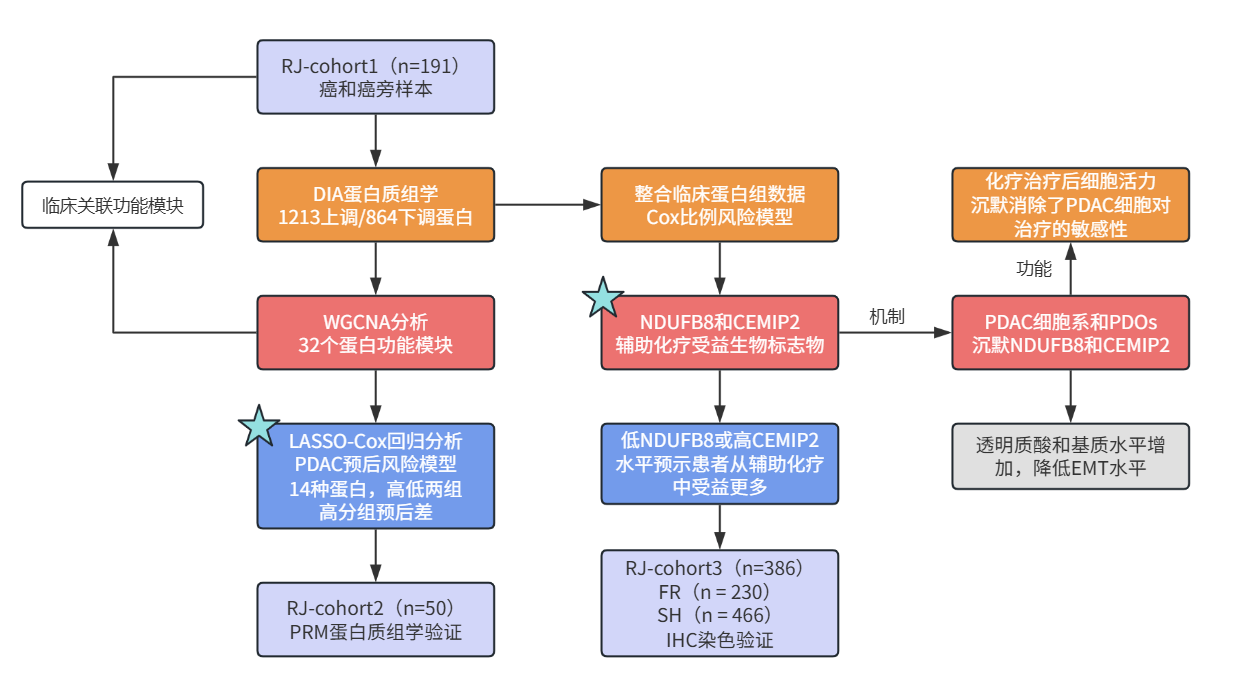
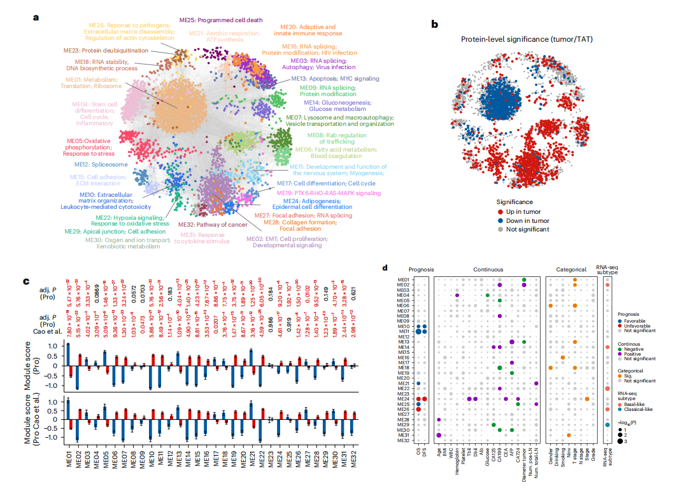
研究结果 一、PDAC蛋白质组学 研究团队为了找到胰腺导管腺癌(PDAC)患者的最佳治疗分层策略,对2018年到2020年期间1171名接受胰腺切除术的中国患者进行了前瞻性观察研究,收集了患者的详细人口统计学和临床病理信息。研究发现,接受含吉西他滨的辅助治疗的患者相比未接受辅助治疗的患者有更长的总生存期(OS)。为了探究OS差异的分子机制,研究者对191例未经治疗的肿瘤样本和90个配对的肿瘤邻近组织进行了蛋白质组学分析,发现肿瘤中有1213个蛋白质显著上调,864个蛋白质下调。肿瘤中的信号通路、补体和凝血级联活跃,而代谢途径、氧化磷酸化和核糖体则显著下调。这些发现有助于揭示PDAC患者生存期差异的分子机制。 PDAC蛋白质组学分析图 二、WGCNA临床关联分析 对肿瘤蛋白质组学数据进行了加权相关网络分析(WGCNA)分析,共确定了32个功能模块。通过将差异蛋白质的丰度叠加到WGCNA网络中,观察到在肿瘤中显著上调的16个模块,而在肿瘤中下调的九个模块,其模块得分在他人研究中得到验证。随后通过关联分析探索了这些模块的临床相关性,下调的模块(ME01/13)与肿瘤大小呈负相关,包括核糖体功能、RNA剪接、代谢和氧化磷酸化等细胞必备的功能。在肿瘤中上调的模块中,ME02、ME08、ME14和ME22与血清中的糖类抗原(CA19-9)水平呈正相关,CA19-9是PDAC患者转移和复发的独立风险因素。ME02包含参与上皮细胞-间充质转化(EMT)和ECM重构的蛋白,ME14富集了糖代谢,ME22则富集了糖酵解和缺氧。这些发现支持了功能蛋白模块的临床意义,缺氧和ECM组织可能是肿瘤细胞转移扩散的潜在原因。此外,部分肿瘤上调模块与总体生存期(OS)密切相关,其中ME24和ME26与较差的OS相关,而ME10和ME11与较好的OS和无疾病生存期(DFS)相关。 功能蛋白模块的临床相关性图 三、PDAC预后风险模型 基于从上述32个功能模块中鉴定出的3906个蛋白质,作者通过LASSO-Cox回归分析建立了PDAC的预后风险模型。该模型包含14个蛋白质,根据患者的LASSO评分将他们分为“高评分”和“低评分”两组。高评分患者的预后较差,LASSO评分在总生存期(OS)和无病生存期(DFS)上显示出独立的预测能力,基因集富集分析(GSEA)显示,高分组患者的细胞外基质(ECM)受体相互作用通路上调,而趋化因子相关通路下调。为了验证这一模型的性能,使用了CPTAC19报告的Cao等人队列验证了模型中14种蛋白质的预后能力,还纳入了RJ-cohort 2(n=50),使用并行反应监测(PRM)方法对每位患者的14个蛋白质进行定量,这50例患者根据他们的LASSO评分(中位数)成功地分为两组,生存分析进一步证实了该模型在预测OS和DFS方面的预后预测能力。 PDAC预后风险模型 四、PDAC蛋白质组学生物标志物 研究团队为了识别与PDAC辅助治疗反应相关的蛋白质生物标志物,整合了临床和蛋白质组数据集,使用Cox比例风险模型分析了化疗与生物标志物的交互作用,确定了两个最重要的生物标志物:NDUFB8和CEMIP2与化疗显著相关。NDUFB8是一种与氧化能量代谢至关重要的线粒体呼吸链复合体I蛋白,在PDAC中表达下调;而CEMIP2是一种编码细胞表面透明质酸酶的蛋白,负责将高分子量的透明质酸分解成低分子量的透明质酸,在肿瘤中表达上调。研究发现,低NDUFB8或高CEMIP2水平预示患者从辅助化疗中受益更多。辅助化疗可以显著延长低NDUFB8患者的总体生存时间,而高NDUFB8患者从辅助化疗中的获益较小。CEMIP2则与之相反,辅助化疗可显著延长高CEMIP2患者的总体生存时间,不过不论CEMIP2水平高低,患者都能从辅助化疗中的获益。 为了研究NDUFB8和CEMIP2对辅助化疗的相互作用机制,研究人员进行了进一步实验,包括在PDAC细胞系和PDOs中沉默这两种生物标志物。实验结果表明,沉默NDUFB8或CEMIP2后,改变的通路与两个患者亚组的差异丰富蛋白富集的通路一致。CEMIP2沉默导致PDOs中透明质酸和基质水平增加,并且降低了EMT水平。 两种蛋白质组学生物标志物鉴定 五、生物标志物的外部和内部验证 研究者使用IHC染色评估了外部PDAC队列法国(n = 230)和上海(n = 466)以及内部PDAC队列RJ-cohort 3(n=386)中NDUFB8和CEMIP2的水平。结果显示,与癌旁(TATs)组织相比,肿瘤中NDUFB8的表达较低,而CEMIP2的表达较高。具有不同化疗敏感性的PDAC患者中,这两种生物标志物的表达水平存在差异,与高表达患者相比,NDUFB8低表达的患者对辅助化疗的反应更好,而在CEMIP2低表达的患者中,辅助化疗的影响没有高表达的易感性。 最后,通过功能实验评估了NDUFB8和CEMIP2对PDAC细胞系化疗敏感性的影响。沉默NDUFB8降低了两种PDAC细胞系(CFPAC和8988)和一种PDO在吉西他滨加紫杉醇、单药5-FU和基于氟尿嘧啶的化疗治疗后的细胞活力。相反,沉默CEMIP2消除了PDAC细胞对这些治疗的敏感性。 IHC染色对生物标志物验证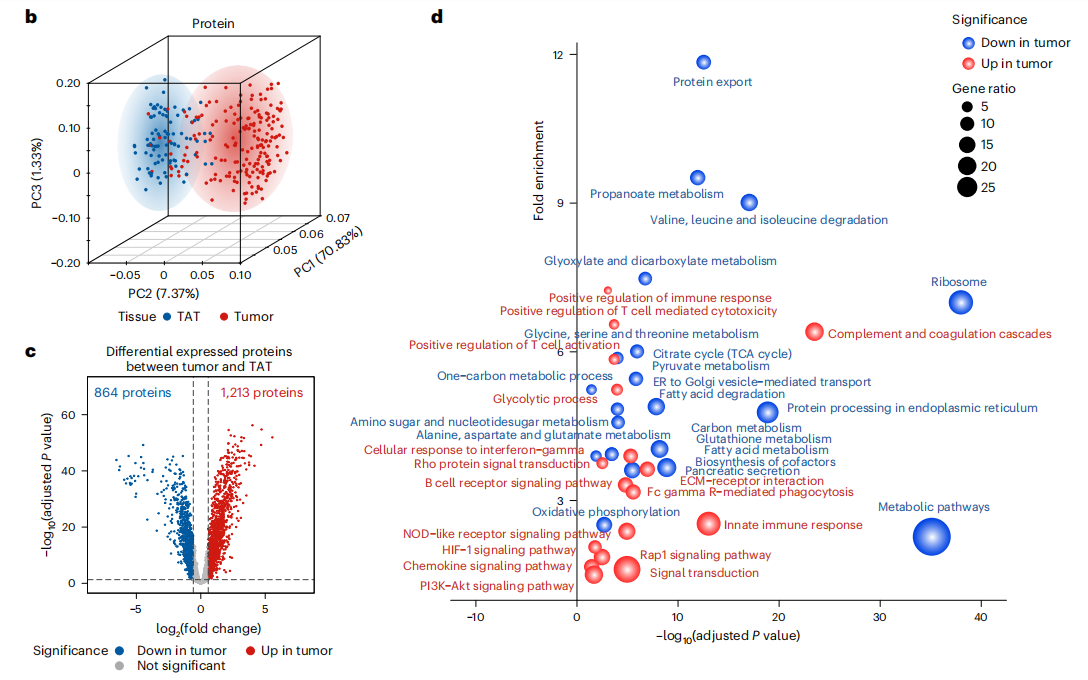




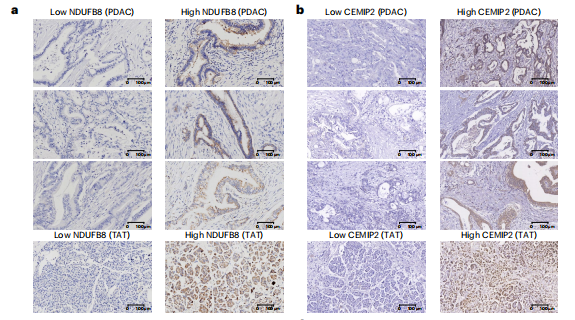
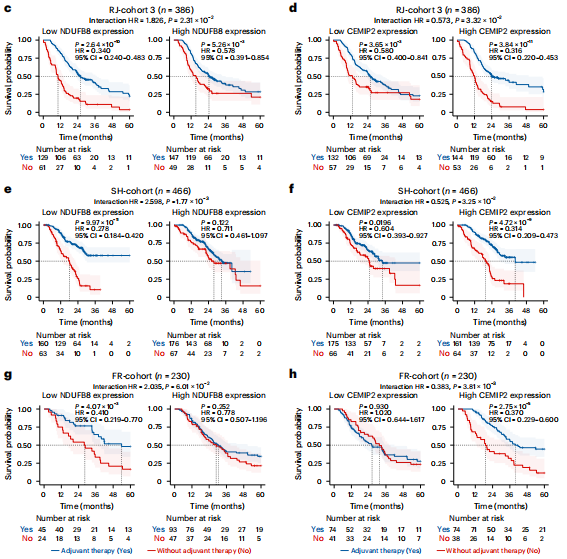
总 结 这项前瞻性观察研究揭示了临床相关的功能蛋白模块,建立了PDAC患者的预后风险模型,并发现了两种预测PDAC辅助化疗生物标志物(NDUFB8和CEMIP2),通过使用外部和独立的内部队列进行了严格的交叉验证,低NDUFB8或高CEMIP2水平表明,患者可从辅助化疗中受益更多。
参考文献:Jiang L, Qin J, Dai Y, et al. Prospective observational study on biomarkers of response in pancreatic ductal adenocarcinoma. Nat Med. 2024;30(3):749-761. doi:10.1038/s41591-023-02790-x