2024-07-12

单细胞测序技术自2009年问世,2013年被Nature Methods评为年度技术以来,越来越多地被应用在科研领域。2015年以来,10X Genomics、Drop-seq、Micro-well、Split-seq等技术的出现,彻底降低了单细胞测序的成本门槛。自此,单细胞测序技术被广泛应用于基础科研和临床研究,单细胞在许多领域都占有一席之地,对于癌症早期的诊断、追踪以及个体化治疗具有重要意义。近些年来,随着单细胞测序技术测序通量的提高以及测序成本的降低,单细胞测序技术在医药、农学、水产等各个领域均有着广泛的研究,下面通过4篇文献来助您打开单细胞测序在免疫学研究中的应用思路~
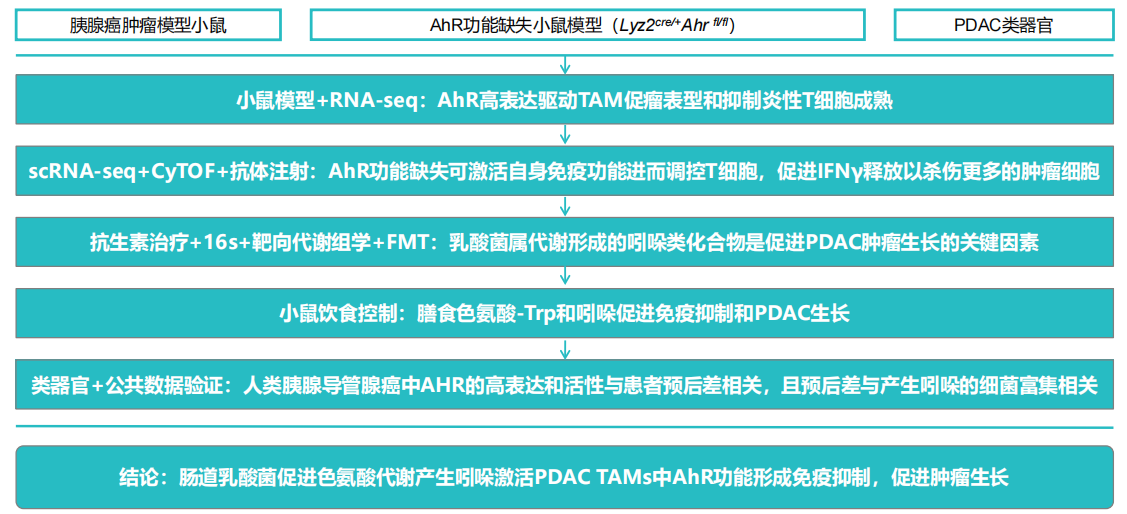
研究背景 由于胰腺导管腺癌(PDAC)对包括免疫检查点封锁在内的治疗方法表现出耐药性,因此患者的预后仍然很严峻。有趣的是,微生物群似乎会影响 PDAC 的结果。在长期的 PDAC 幸存者中,微生物组多样性的增加与肿瘤微环境(TME)的生存率和免疫学特征相关。此外,在小鼠模型中,来自长期存活者的粪便微生物群移植(FMT)减少了肿瘤大小,而来自短期存活者的 FMT(STS)导致肿瘤增大和 CD4+ FOXP3+ T 细胞的增加。以往研究表明,一种免疫学上重要的细菌代谢物—吲哚,可通过激活转录调节因子 AhR 来调控 T 细胞、树突状细胞和巨噬细胞的功能,从而抑制炎症。巨噬细胞是 PDAC 免疫浸润的主要组成部分。而且 AhR 在髓系细胞中的表达更高,这提示着或许髓系细胞具有对 AhR 配体更高的敏感性。 研究材料 本研究先对 PDAC 肿瘤内巨噬细胞、组织内巨噬细胞进行 bulk 转录组检测。然后对肿瘤移植 14 天后的 PDAC AhR 缺失小鼠和 PDAC 正常小鼠的肿瘤样本进行 scRNA-seq 测序(n=3)。同时还对肿瘤小鼠的肠道内容物进行 16S 测序,对灌胃处理的 C57BL/6J 小鼠胃肠道进行靶向代谢组检测。 研究思路 研究结果 作者通过 scRNA-seq 结合 16s 和靶向代谢组测序研究了 AhR 对 PDAC 中肿瘤相关巨噬细胞 (TAM) 功能的影响。TAMs 表现出高 AhR 活性,AhR 缺失的巨噬细胞表现出炎症表型。髓系细胞中 Ahr 的缺失或 Ahr 的药理学抑制降低了 PDAC 的生长,提高了免疫检查点阻断的效果,增加了 IFNγ+CD8+ T 细胞的肿瘤内频率(图 1)。研究者发现乳杆菌将膳食中的色氨酸代谢为吲哚并激活巨噬细胞 AhR 活性。去除膳食色氨酸可降低 TAM 的 AhR 活性,促进肿瘤内 TNFα+IFNγ+CD8+ T 细胞的聚集;在膳食中添加吲哚可以阻断这种作用。并且,在 PDAC 患者中,高 AHR表达与快速疾病进展和死亡率以及免疫抑制 TAM 表型相关,这表明该调节轴在人类疾病中具有保守性。 图 1:scRNA-seq 揭示巨噬细胞 AhR 重塑 PDAC 中的转录过程 原文索引 Deng G, Zhou L, Wang B, et al. Targeting cathepsin B by cycloastragenol enhances antitumor immunity of CD8 T cells via inhibiting MHC-I degradation. J Immunother Cancer. 2022;10(10):e004874. doi:10.1136/jitc-2022-004874
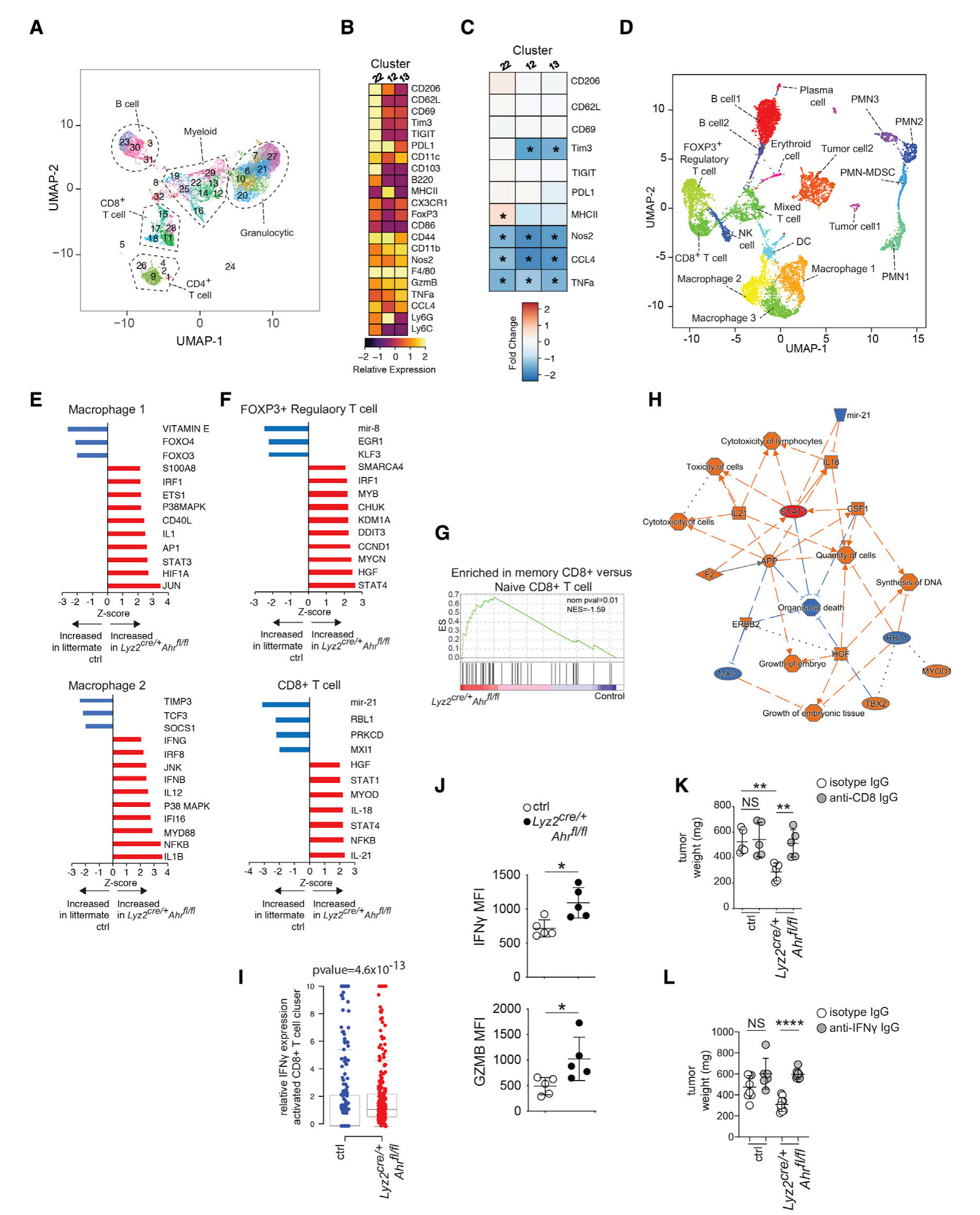
研究背景 近年来,癌症免疫疗法蓬勃发展,其中,嵌合抗原受体( chimeric antigen receptor,CAR)T 细胞疗法是突破性技术之一。该方法在白血病和淋巴瘤的治疗上卓有成效。但在实体肿瘤中,CAR-T 治疗还面临两个关键挑战:1)肿瘤本身存在抗原异质性,即不是所有的肿瘤细胞都表达 CAR 靶向的抗原;2)在治疗过程中发生的抗原丢失,即肿瘤细胞在受到 CAR T 细胞的攻击时,一些肿瘤细胞的反应是停止靶抗原的产生。本文作者之前发现,给小鼠注射 CAR-T 细胞后不久后,继续注射携带 CAR-T 细胞靶向的相同抗原的疫苗直接在原生淋巴结微环境中重新刺激 CAR - T 细胞可以有助于 CAR-T 细胞攻击肿瘤,而且还有助于产生针对其他肿瘤抗原的宿主 T 细胞,即发生抗原扩散效应(Antigen spreading,AS)。因此,本次研究作者主要想进一步探究 AS的作用机制。 研究材料 本研究对小鼠胶质母细胞瘤模型分别进行 CD45.1+CAR-T和CD45.1CAR-T+Vax(CAR-T+ 疫苗)治疗,在治疗后的第 7 天和第14天分别取肿瘤组织解离为单细胞悬液并分选CD45.2+ CD4 和 CD8 T 细胞进行单细胞转录组和免疫组库测序。 研究思路 研究结果 作者发现疫苗增强 CAR-T 细胞会触发内源性免疫系统的参与,以规避抗原阴性的肿瘤逃逸。因此,作者使用这种 CAR-T 治疗联合疫苗增强作为模型,结合单细胞转录组测序及其他验证手段,来了解 AS 效应在 CAR-T 清除具有抗原异质性实体瘤中的作用机制。结果发现,疫苗增强的 CAR-T 可以促进树突状细胞(DC)向肿瘤的募集,增加DC 对肿瘤抗原的摄取,并诱导内源性抗肿瘤 T 细胞的启动。这一过程伴随着 CAR-T 代谢向氧化磷酸化(OXPHOS)的转变,并严重依赖于 CAR-T 衍生的 IFN-γ(图 1)。疫苗增强的 CAR-T 诱导的抗原扩散效应(AS)可以有效应对实体瘤的抗原丢失现象,增强 CAR-T 表达 IFN-γ 的能力可以进一步增强异质性肿瘤的治疗效果。因此,CAR-T 细胞来源的 IFN-γ 在促进 AS 中起着关键作用,这一组合疗法有望成为治疗实体瘤的有效手段(图 2)。 原文索引 Ma L, Hostetler A, Morgan DM, et al. Vaccine-boosted CAR T crosstalk with host immunity to reject tumors with antigen heterogeneity. Cell. 2023;186(15):3148-3165.e20. doi:10.1016/j.cell.2023.06.002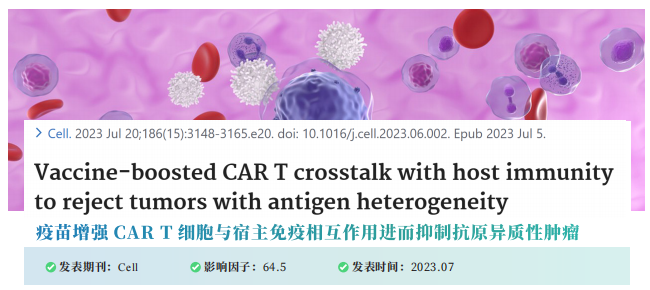

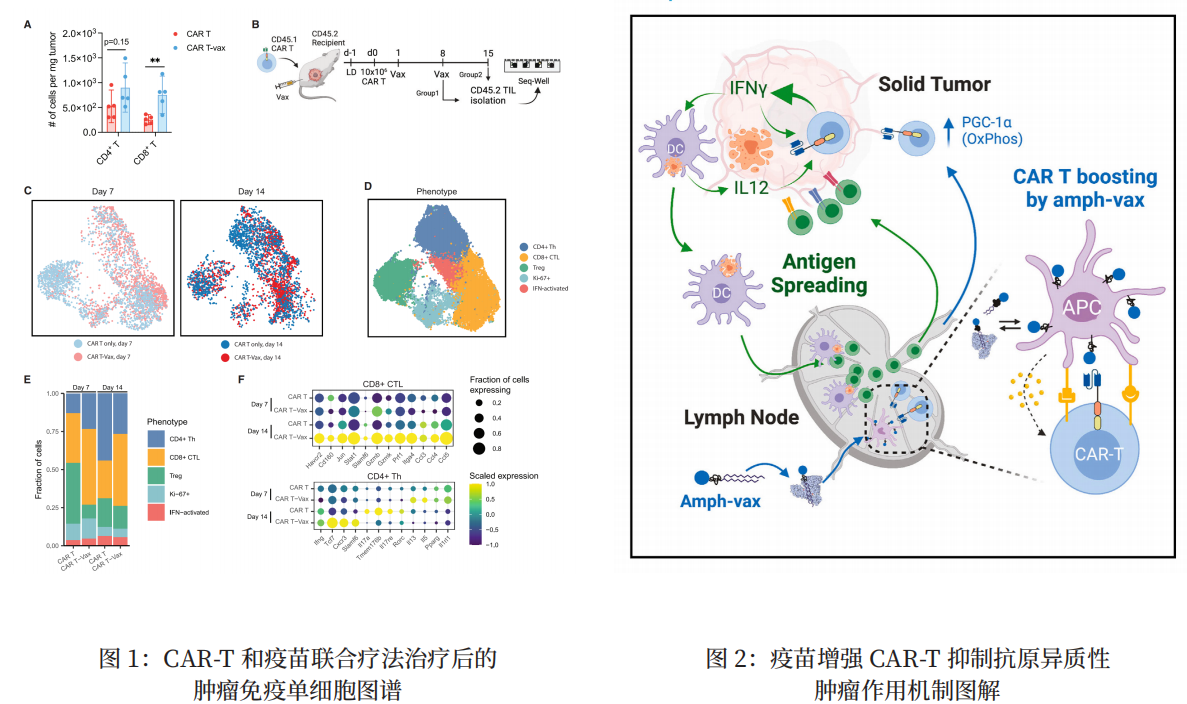
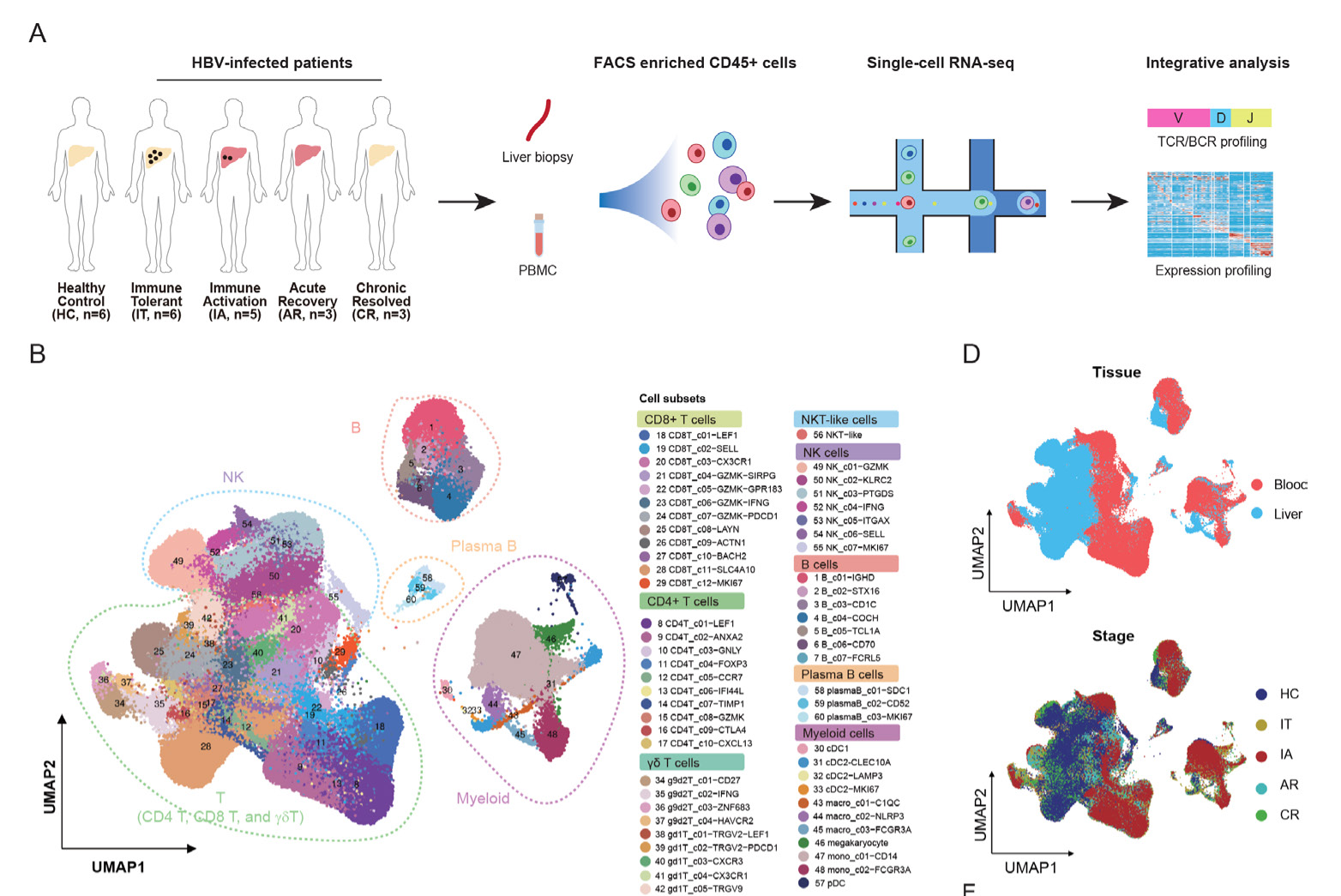
研究背景 超过 2.8 亿人患有慢性 HBV 感染(Chronic HBV, CHB),并且处于发展为肝硬化、肝功能衰竭或肝细胞癌 (HCC) 的高风险中,这导致每年超过 700000 人死亡。目前,临床上用于 CHB 治疗的药物主要包括干扰素和核苷(酸)类似物(NAs),抗病毒治疗能够有效抑制病毒复制,但仅极少数患者可以实现“功能性治愈”,大量 CHB 患者需长期乃至终身抗病毒治疗。受限于肝脏样本可及性及传统研究技术手段,既往 HBV 感染相关临床转化研究大多使用外周血样本,但仍然缺乏使用 scRNA-seq 对 HBV 感染的肝脏原位免疫反应的全面视图。 研究材料 乙肝感染不同阶段患者(包括免疫耐受期—IT,n=6;免疫活化期—IA,n=5;急性感染恢复期—AR,n=3;慢性感染治愈患者—CR,n=3)和健康肝移植供者(HC,n=6)作为对照,取外周血和肝脏穿刺组织的 CD45+ 免疫细胞做单细胞转录组和单细胞免疫组库测序。 研究思路 研究结果 作者通过单细胞转录组测序构建易感患者肝脏和外周免疫图谱(图 1),并发现:1)耗竭 CD8+ T 细胞(Tex)在 IT、IA 和 AR 组肝脏中增多,其中 IA 和 AR 的增加幅度更大且呈现更显著的耗竭相关转录特征。IA 和 AR 患者中耗尽的 CD8+T 细胞的来源不同,CD8+T 细胞在肝脏和血液之间的转移可能促进病毒清除,表明影响 CD8+T 细胞功能和分化的因素在 HBV 感染中的重要作用;2)发现 IT 和 IA 阶段,Treg(CD4T_C09-CTLA4) 和 Tex(CD8T_C08-LAYN) 之间存在显著的交互作用;3)FCGR3A+ 巨噬细胞可能通过 HLA-I_LILRB 信号传导在调节慢性感染期T 细胞应答中起着关键作用,Tex、Treg 和 FCGR3A+ 巨噬细胞亚群之间在 IT 和 IA 期表现出强烈的相互作用;4)IA 和 AR 患者的 T 细胞的功能紊乱与患者的肝组织损伤程度密切相关。 图 1:肝脏和血液中免疫细胞的单细胞转录组图谱 原文索引 Zhang C, Li J, Cheng Y, et al. Single-cell RNA sequencing reveals intrahepatic and peripheral immune characteristics related to disease phases in HBV-infected patients. Gut. 2023;72(1):153-167. doi:10.1136/gutjnl-2021-325915
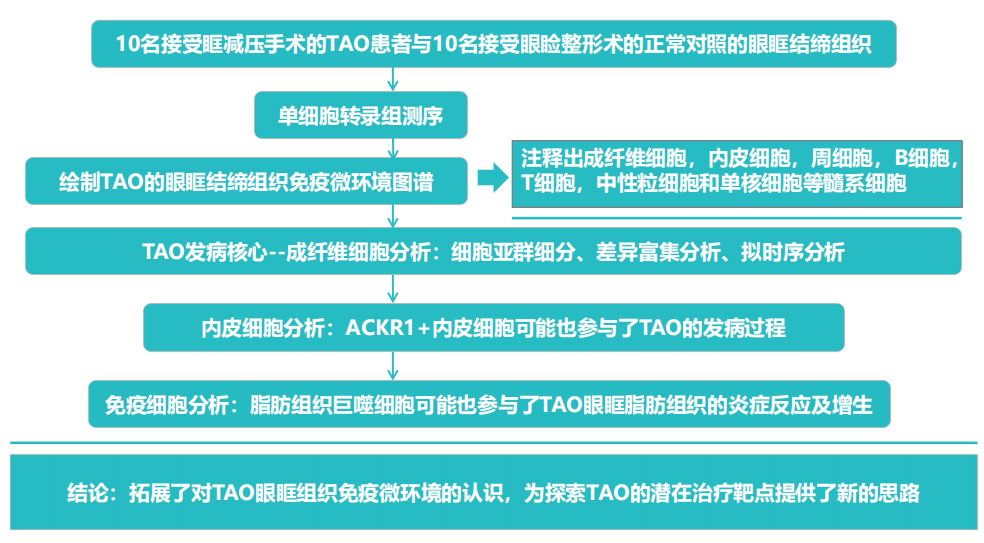
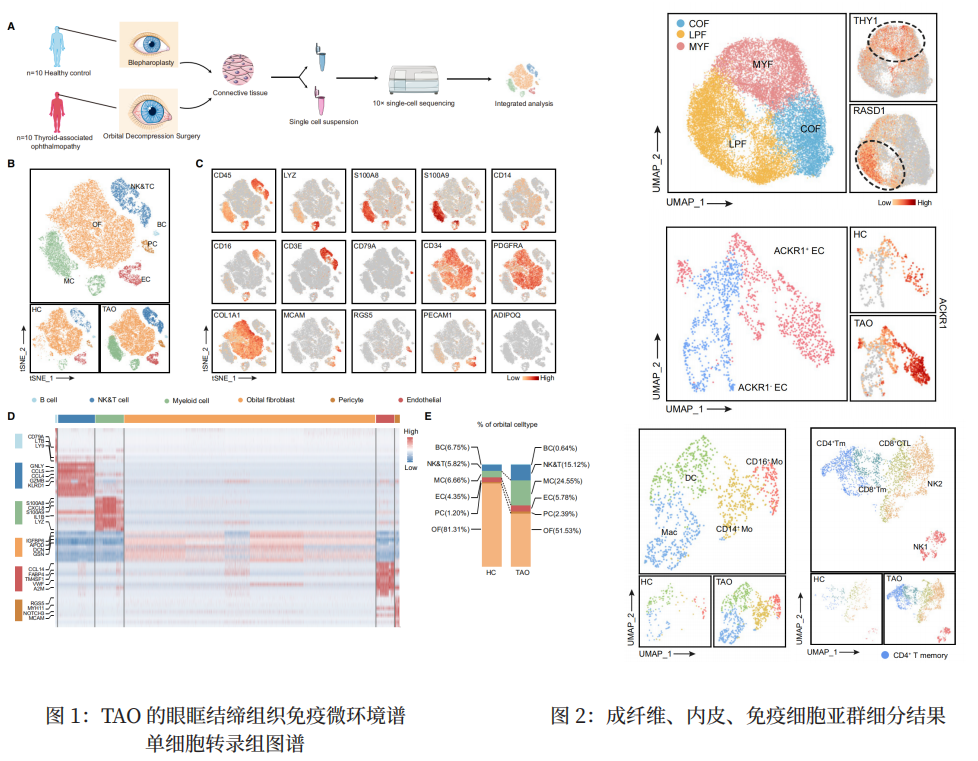
研究背景 甲状腺相关性眼病(TAO)是以眼球后及眶周组织的浸润性病变为特征的器官特异自身免疫性疾病,是甲状腺疾病最常见的甲状腺外表现之一。TAO常表现为突眼、眼睑退缩、复视等,严重者甚至会危及视力,导致失明。TAO涉及的主要过程是眶周组织中的炎症、糖胺聚糖积累、脂肪生成和肌纤维形成。由于目前于对其发病机制知之甚少,TAO的治疗仍然具有挑战性,因此,深入解析TAO眼眶结缔组织的免疫微环境,有望为进一步阐明TAO发病机制和找到潜在的治疗靶点提供分子依据。 研究材料 取10名接受眶减压手术的TAO患者与10名接受眼睑整形术的正常对照的眼眶结缔组织进行单细胞转录测序。 研究思路 研究结果 作者通过对甲状腺相关性眼病(TAO)患者和正常对照的眼眶结缔组织进行单细胞转录组测序,构建了 TAO 眼眶结缔组织的单细胞图谱(图 1),发现高表达 RASD1 的成脂分化成纤维细胞高度参与脂肪生成和炎症,ACKR1 + 内皮细胞有助于 TAO 中的炎症细胞浸润,脂肪组织巨噬细胞参与 TAO 中的脂质代谢和炎症反应,同时终末分化CD8+CTL 细胞也是眼眶组织干扰素的分泌来源之一(图 2)。该研究拓展了对 TAO 眼眶组织免疫微环境的认识,为探索 TAO 的潜在治疗靶点提供了新的思路。 原文索引 Li Z, Wang M, Tan J, et al. Single-cell RNA sequencing depicts the local cell landscape in thyroid-associated ophthalmopathy. Cell Rep Med. 2022;3(8):100699. doi:10.1016/j.xcrm.2022.100699