
2018-01-04
文献简介
灵芝是一种属于灵芝科的白腐真菌,是多孢菌属。灵芝作为中药的使用而闻名古今,在中国、韩国、日本都有广泛的种植。微生物直接暴露于各类环境中产生对环境的应激反应是不可避免的。尤其是热胁迫常被报道影响微生物的生理过程和生长。近年来,全球温室效应引起全球变暖现象对灵芝的生长和发育造成了负面影响。
据研究,一氧化氮增强真菌耐热性起着重要的作用。本文采用了RNA-seq技术来生成大范围的转录组数据,将灵芝的菌丝体暴露在外界不同温度下,做热胁迫实验。结果表明:热休克蛋白(HSPs)、应激诱导蛋白以及在氨基酸氧化酶活性和氧化还原酶活性中所含的非生物质,均可在灵芝菌丝中得到明显的调节。在增强灵芝对高温的耐受中,有明显的可调节HSP、单氧酶、酒精脱氢酶和结合域内包含的蛋白质的作用。这些结果证明了对灵芝转录组测序的意义,以及在基因表达水平上一氧化氮提高对真菌的耐热力的机制。
实验材料:G. oregonenseSLZ72由中美科研者在中国西南地区培育,本文做4组实验,对照组28℃,高温组32 ℃,高温组32 ℃和不同浓度SNP,高温组32 ℃和一氧化氮抑制剂。
平台:Illumina HiSeq™ 2000
委托单位:上海派森诺生物科技股份有限公司
研究结果
1、SNP对鲜菌丝生物量的影响
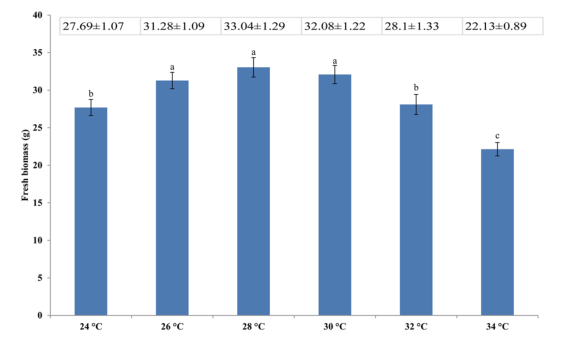
图1 不同度对灵芝的鲜菌丝生物量(g)的影响
由图1可知,在不同温度对灵芝的鲜菌丝生物量(g)的影响。温度在28℃时产量可达到33.04±1.29g,而温度在24℃和34℃都不是促进鲜菌丝生物量的最佳温度。
2、对灵芝的转录组测序并进行从头组装
从图2可知,在热胁迫反应中,不同浓度的SNP对灵芝鲜菌丝生物量的影响进行了研究。共做了7个实验组,第一组对照组为28℃时灵芝菌丝,第二组为32℃时灵芝菌丝的胁迫反应,第三组为32℃、SNP的浓度为50μM时灵芝菌丝的胁迫反应,第四组为32℃、SNP的浓度为100μM时灵芝菌丝的胁迫反应,第五组为32℃、SNP的浓度为200μM时灵芝菌丝的胁迫反应,第六组为32℃、SNP的浓度为300μM时灵芝菌丝的胁迫反应,第七组为32℃、SNP的浓度为150μM的Fe(CN)6不释放一氧化氮时灵芝菌丝的胁迫反应。当灵芝菌丝在32℃、SNP的浓度为100μM时鲜菌丝生物量最高达32.75±2.13g。
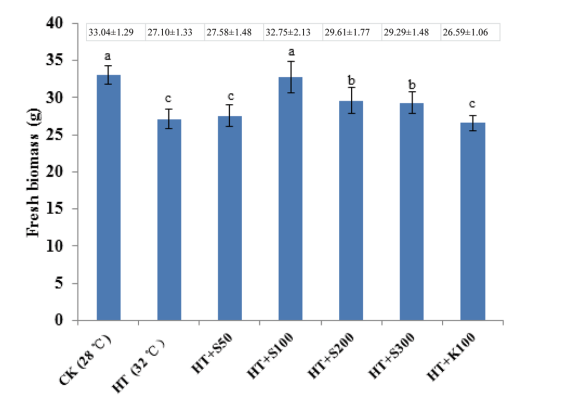
图2 SNP对灵芝鲜菌丝生物量热应激反应的影响
3、灵芝菌丝的功能分类及特征
由图3通过GO程序对基因进行功能分类可知,在生物功能中新陈代谢功能和细胞功能所占比例最高,非别是10.31%和10.22%。在细胞组成功能中,细胞及细胞组成部分所占比例最多,分别是8048%和8044%。在分子功能中,催化活性功能和结合功能所占比例最高,非别是10.96%和8.84%。
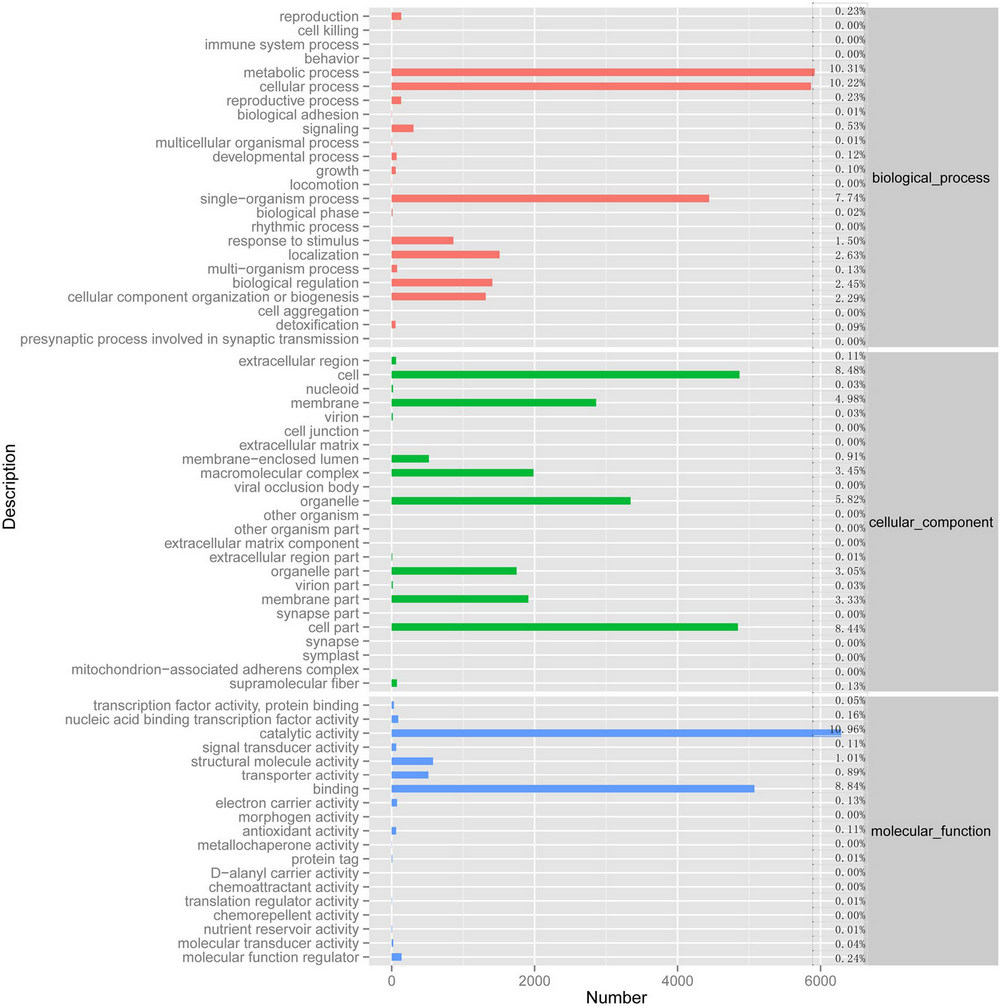
图3 灵芝转录组的GO分类图
为了进一步阐明灵芝菌丝的生物学功能和基因相互作用,所有58550个带注释的unigenes被映射到KEGG数据库中的生物通路中。由图4可知,KEGG分类的直方图。纵轴上的字母代表不同的KEGG类别,费别为新陈代谢、遗传信息处理、环境信息处理、细胞过程和组织系统。大约2870个带注释的unigenes在KEGG数据库中与31个KEGG通路有显著的匹配。1189个unigenes在新成代谢通路中,192个unigenes在碳水化合物代谢通路中,175个unigenes在氨基酸代谢通路中等。KEGG通路注释提供了一种价值的资源,可以用于研究灵芝菌丝在热应激反应中的特定过程、功能和途径。
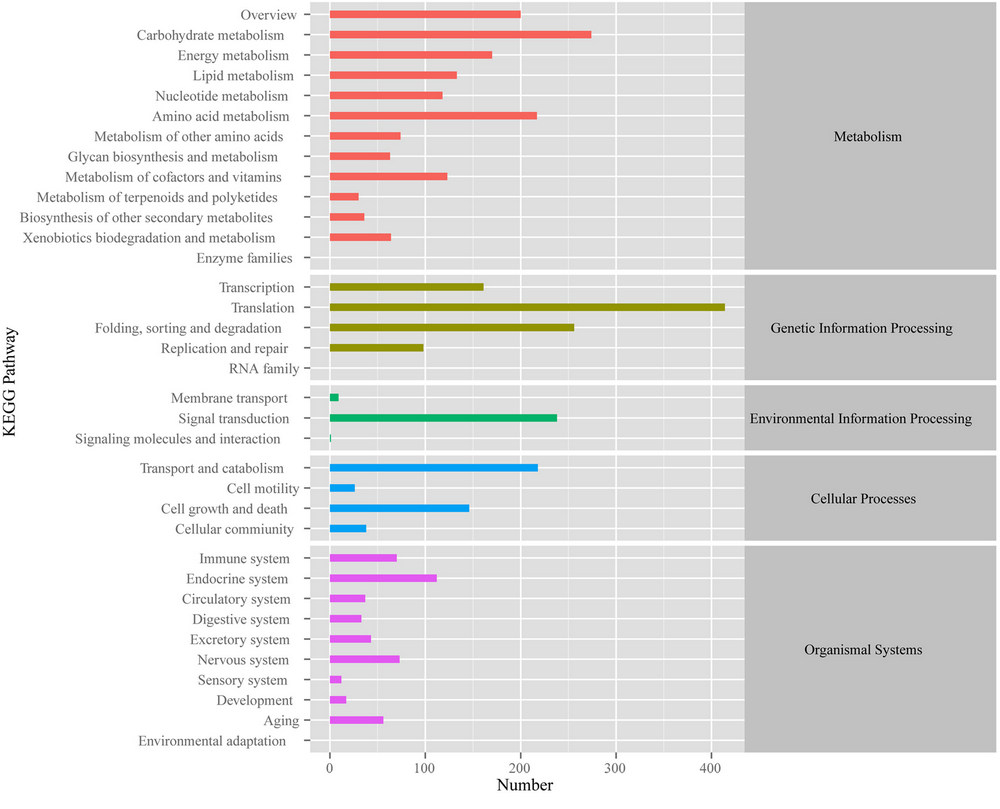
图4 KEGG直方图
4、热胁迫后差异基因的表达
该文研究了调控真菌耐受性的无诱导基因表达谱。由图5可知,利用系统图对不同样品进行热图和聚类分析。从绿色到红色,基因表达水平增加。每个unigene的表达水平均使用RPKM算法计算。在CK和HT中表达的56771个基因中,484个基因在CK和HT中有显著差异,其中197个基因在HT中上调。其中HT的上调基因中,HSP基因占比例最大。
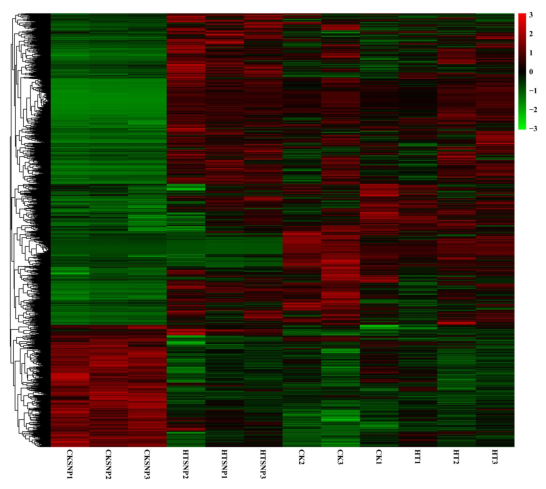
图5 用完整连锁法分析不同样品间的热图和聚类分析
综上所述,以上结果证明了灵芝菌丝在高温胁迫条件下不利于生物量产生。而当生长环境中含有一氧化氮时,鲜菌丝的生长量增加,这一研究证明了一氧化氮对灵芝鲜菌丝在热胁迫环境中有抗性。
参考文献:
1. Zhou, L. W. et al. Global diversity of the Ganodermalucidum complex (Ganodermataceae, Polyporales) inferred from morphologyAndmultilocusphylogeny. 2016-03-01 114, 7–15, https://doi.org/10.1016/j.phytochem.2014.09.023 (2015).
2. Chiu, H. F. et al. Triterpenoids and polysaccharide peptides-enriched Ganodermalucidum: a randomized, double-blind placebocontrolled
crossover study of its antioxidation and hepatoprotective efficacy in healthy volunteers. Pharmaceutical biology 55,1041–1046, https://doi.org/10.1080/13880209.2017.1288750 (2017).
3. Kohno, T. et al. Tubulin polymerization-stimulating activity of Ganoderma triterpenoids. Journal of natural medicines 71, 457–462,
https://doi.org/10.1007/s11418-017-1072-y (2017).
4. Pu, D. B. et al. Highly oxygenated lanostane-type triterpenoids and their bioactivity from the fruiting body of Ganodermagibbosum.
Fitoterapia119, 1–7, https://doi.org/10.1016/j.fitote.2017.03.007 (2017).
5. Smina, T. P., Nitha, B., Devasagayam, T. P. &Janardhanan, K. K. Ganodermalucidum total triterpenes induce apoptosis in MCF-7
cells and attenuate DMBA induced mammary and skin carcinomas in experimental animals. Mutation research 813, 45–51, https://doi.org/10.1016/j.mrgentox.2016.11.010 (2017).