2024-08-22

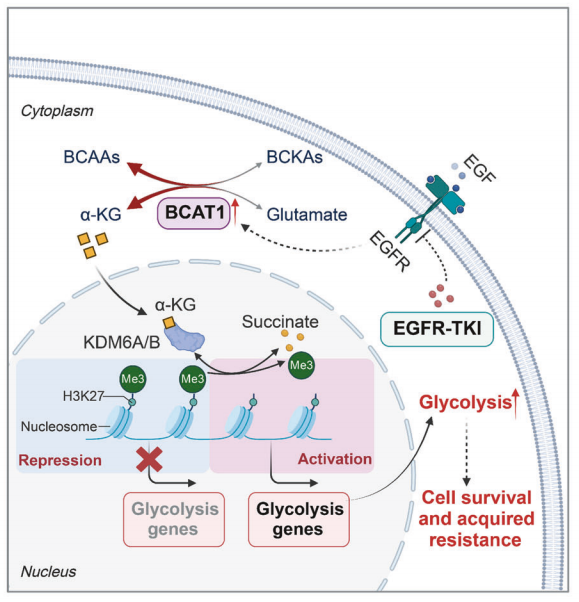
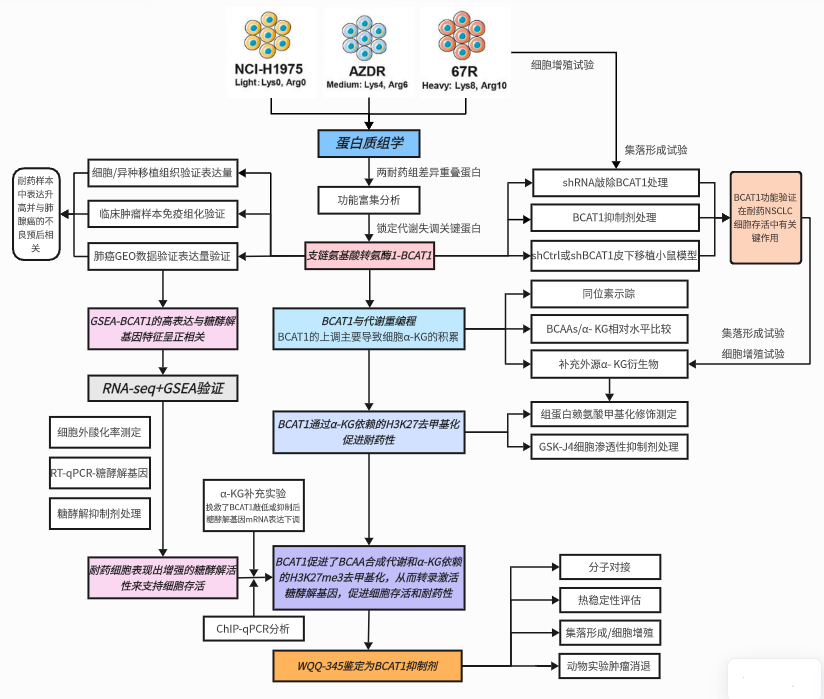
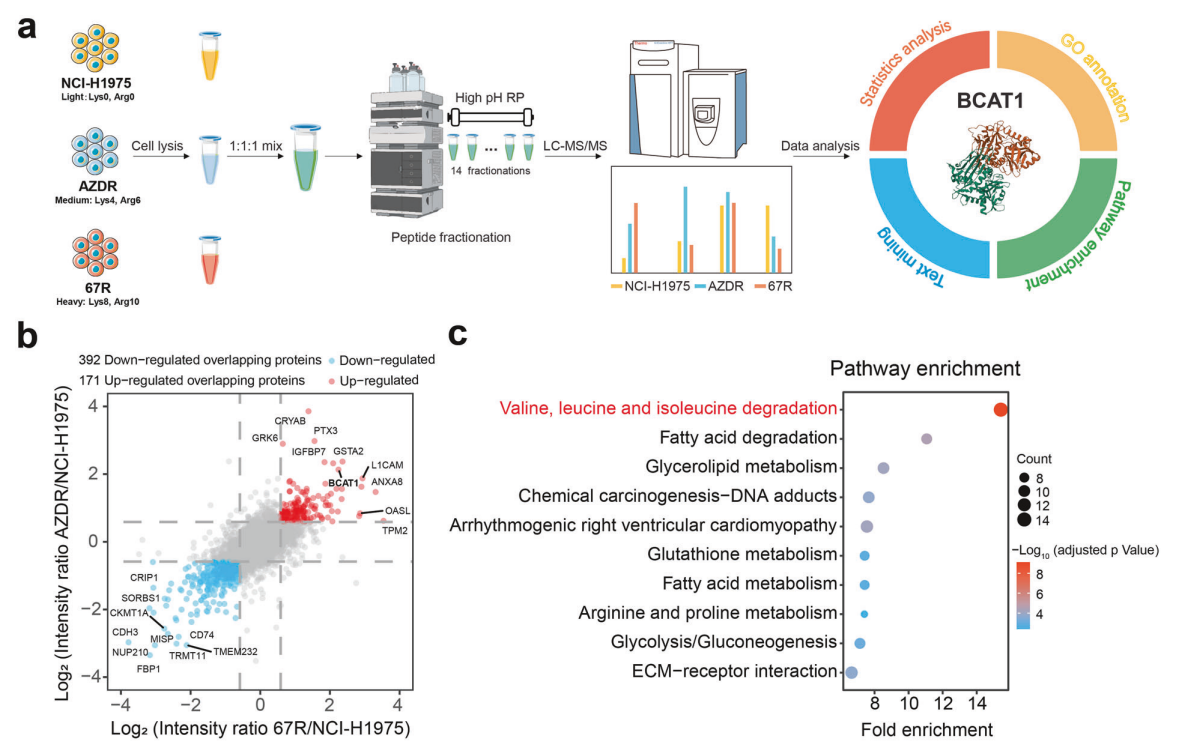
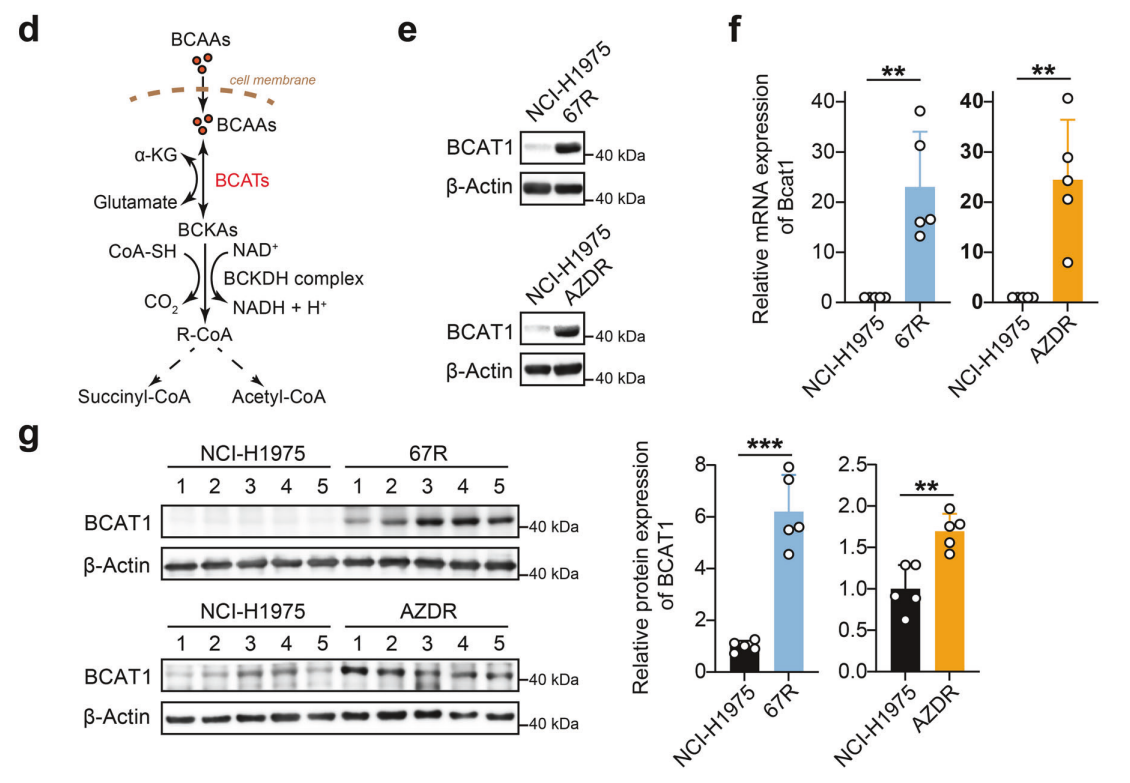
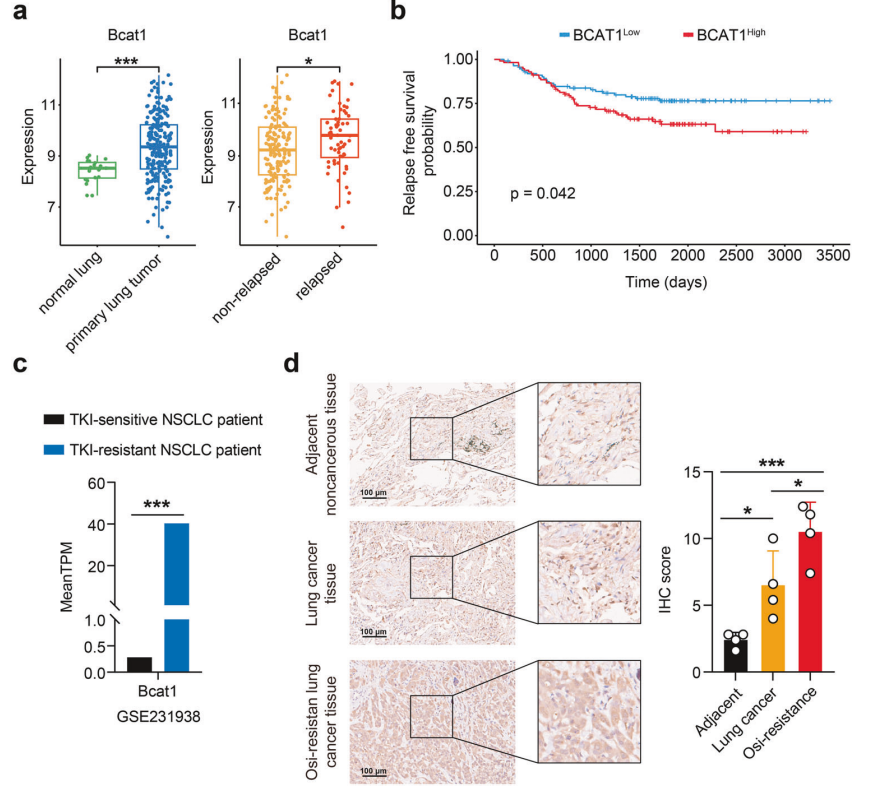
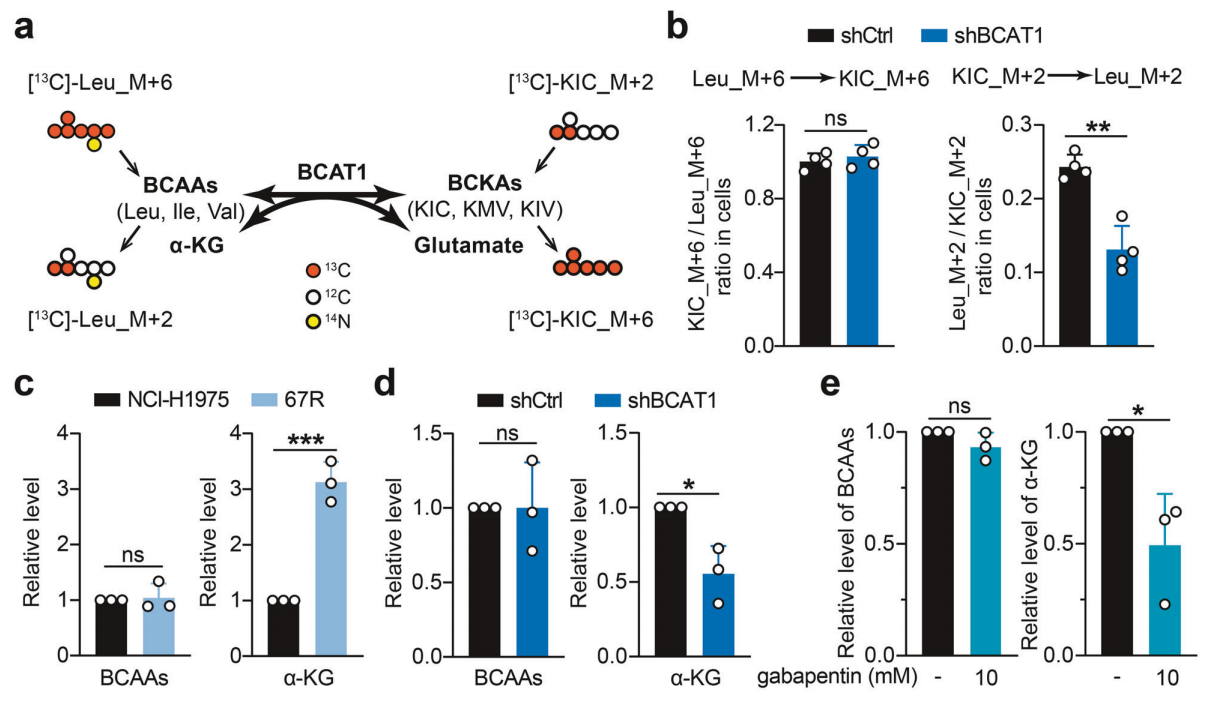
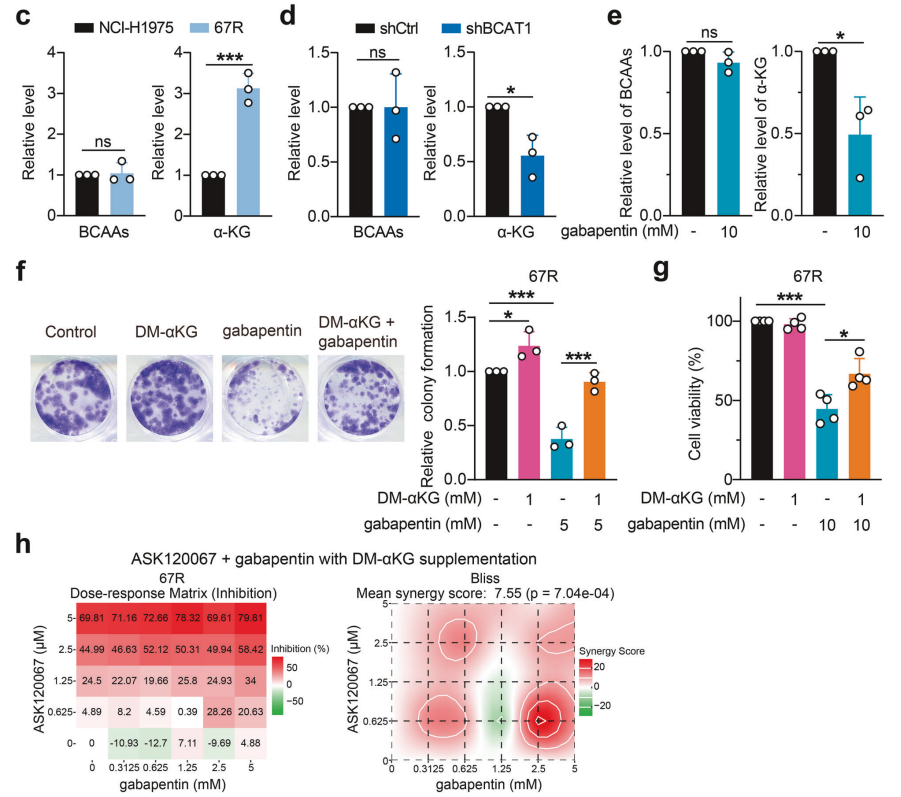
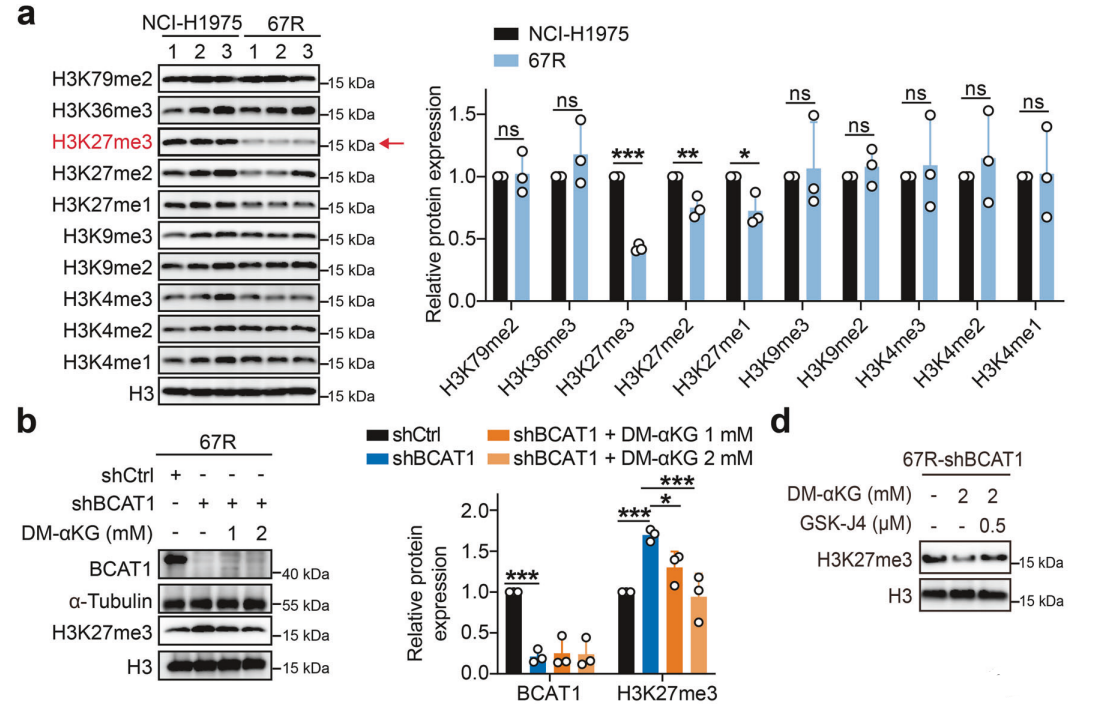
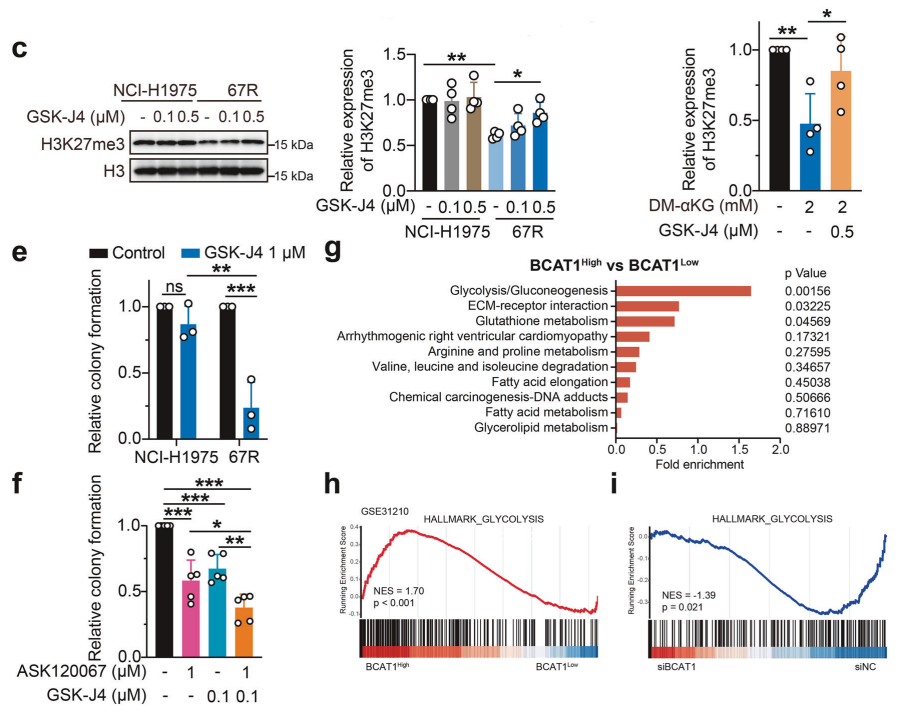
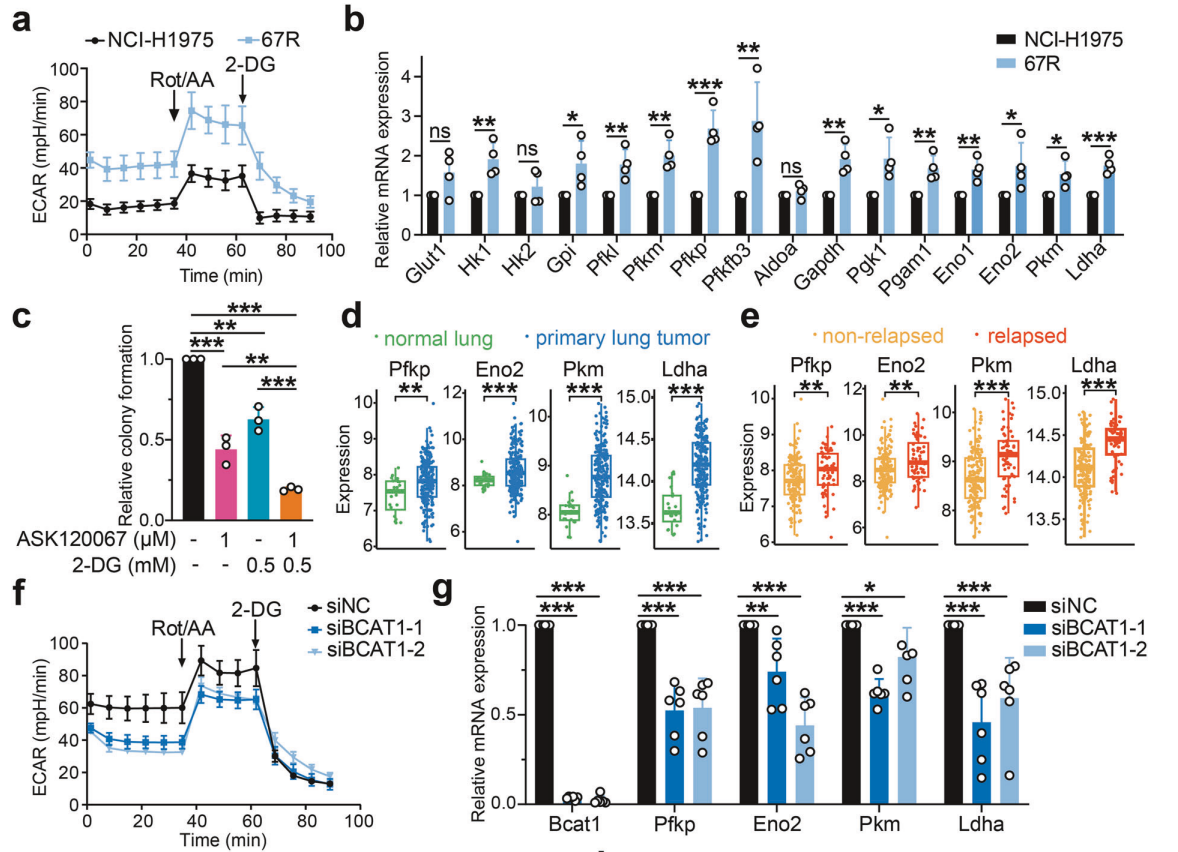
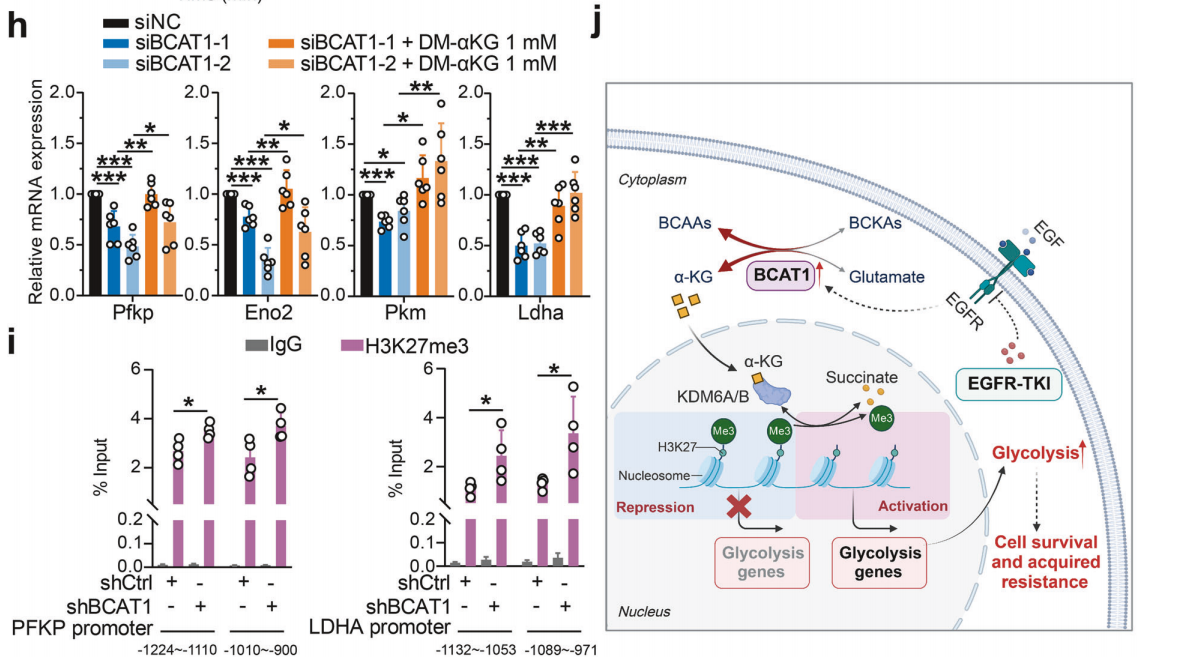
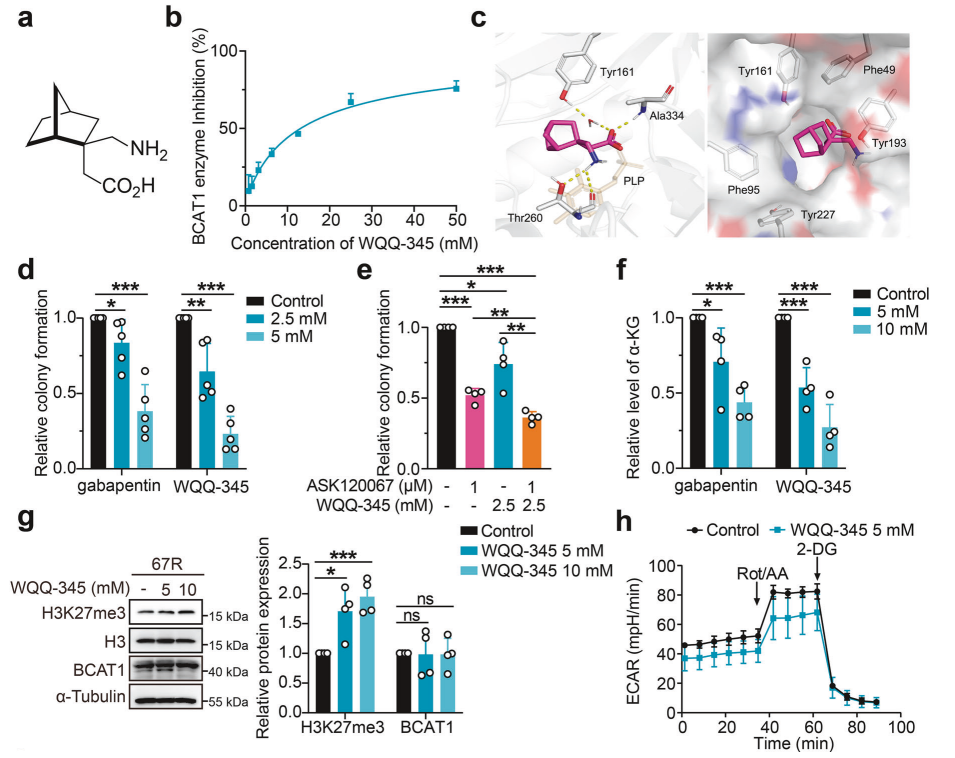
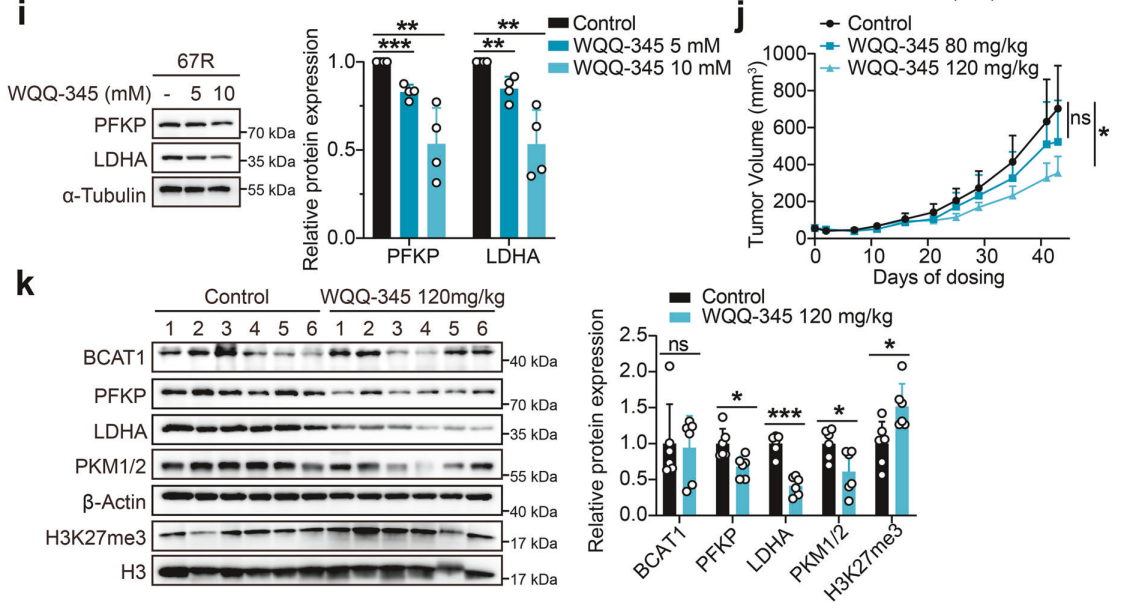
研究背景 EGFR突变是非小细胞肺癌(NSCLC)最常见的突变类型。对EGFR-TKIs(酪氨酸激酶抑制剂)治疗的耐药性一致被认为是EGFR突变型非小细胞肺癌(NSCLC)患者治疗失败和癌症复发的主要原因。2024年8月15日,中国科学院谢华、丁健、周虎及赵桂龙共同通讯在Signal Transduction and Targeted Therapy (IF40.8)发表题为“Branched-chain amino acid transaminase 1 confers EGFR-TKI resistance through epigenetic glycolytic activation”的研究论文,在本研究中作者采用高通量蛋白质组学分析来表征癌细胞获得抗性后蛋白质组的改变,旨在识别第三代EGFR TKIs的新抗性机制,并找到了治疗TKI耐药NSCLC的治疗靶点以及新型的靶向抑制剂。 研究思路 研究结果 一.BCAT1在EGFR TKI耐药肿瘤中表达上调,并与肺腺癌的不良预后相关 作者首先构建了肿瘤耐药细胞。将TKI敏感的NCI-H1975(EGFRL858R/T790M)NSCLC亲本细胞剂量递增暴露于ASK120067或奥西替尼中(分别用67R和AZDR表示第三代EGFR靶向药物),生成EGFR TKI耐药NSCLC细胞系,并使用集落形成和细胞增殖试验验证了耐药细胞对EGFR TKI的敏感性降低。其次为了找到与耐药性相关的调控蛋白,通过SILAC稳定同位素标记蛋白质组学,比较了三种细胞中蛋白变化(图1a),发现耐药细胞蛋白表达模式相似,两种耐药细胞存在563个重叠蛋白(图1b)。对重叠蛋白进行功能富集分析显示,代谢途径存在显著的失调,其中参与支链氨基酸(BCAA)降解的蛋白在耐药细胞中发生了最显著的改变,这表明BCAA代谢可能参与了EGFR TKI介导的耐药。在所有参与BCAAs降解的酶中(图1d),支链氨基酸转氨酶1(BCAT1)较为显著,随后作者在细胞和异种移植肿瘤组织中测定了BCAT1 mRNA和蛋白水平表达的升高(图1e,f)。 图1 TKI耐药肺癌中BCAT1表达增强的发现和验证 为了评估BCAT1在肺癌中的临床相关性,对GEO数据库中肺腺癌(LUAD)数据集进行分析,发现BCAT1在复发肿瘤中的表达高于非复发组(图2a),LUAD患者的BCAT1表达与无复发生存期(RFS)时间呈负相关(图2b)。与TKI敏感的患者相比,TKI耐药患者的样本中BCAT1表达升高(图2c)。作者对临床肿瘤样本采用免疫组化染色法检测BCAT1的表达(图2d),与癌旁非癌组织相比,肺癌肿瘤中BCAT1的表达水平明显升高。这些发现强调了BCAT1在肺癌中的临床相关性。 图2 BCAT1在肺癌中的表达的临床意义 二.BCAT1在体内和体外均具有EGFR TKI抗性 使用shRNA敲除支链氨基酸转氨酶1(BCAT1)发现显著抑制了67R和AZDR细胞的集落形成(图3a,b),使用BCAT1抑制剂gabapentin发现选择性减少了耐药细胞的形成(图3c,d),BCAT1抑制剂的药理抑制作用可使67R和AZDR细胞分别对ASK120067和奥西替尼致敏(图3f,g)。使用细胞增殖试验观察到类似的结果。与NCI-H1975细胞相比,gabapentin选择性抑制67R和AZDR细胞的增殖。这些结果表明,BCAT1是TKI耐药细胞的存活和耐药性所必需的。 为了进一步确定BCAT1在小鼠模型中的功能作用,作者使用稳定表达shCtrl或shBCAT1的67R细胞建立了皮下异种移植模型。发现下调BCAT1显著削弱了67R细胞形成肿瘤的能力,导致肿瘤形成率和肿瘤重量均显著下降(图3i、j和补充图4f)。这些发现证实了BCAT1在耐药NSCLC细胞存活中的关键作用,以及它介导了对第三代EGFR TKIs的耐药性。 图3 BCAT1 维持细胞存活并赋予对第三代 EGFR TKI 的耐药性 三.BCAT1促进α-酮戊二酸(α-KG)的生成,以支持抗性细胞的生长 支链氨基酸转氨酶1(BCAT1)是负责从支链氨基酸(BCAAs)和α-酮戊二酸(α-KG)可逆转化为支链酮酸(BCKAs)和谷氨酸的关键酶,接下来作者探索了升高的BCAT1如何在抗性细胞中重编程支链氨基酸(BCAAs)代谢。利用同位素示踪将稳定表达shCtrl或shBCAT1的67R细胞与[13C]- Leu_M + 6和[13C]-KIC_M + 2孵育,并分别分析它们的特定代谢产物[13C]-KIC_M + 6和[13C]-Leu_M+2(图4a)。发现,BCAT1显著降低了[13C]-Leu_M + 2/[13C]- KIC_M + 2的细胞比例,而不显著影响[13C]-KIC_M + 6/ [13C]-Leu_M + 6的比例。这表明,在抗性细胞中高表达的BCAT1可能比BCAA的降解更能加速BCAA的合成代谢(图4b)。 作者证实了耐药细胞中BCAA合成代谢物的变化,发现与亲本NCI-H1975细胞相比,67R细胞内α-KG显著积累,而总游离BCAA含量保持不变(图4c)。此外,BCAT1的遗传或药理抑制导致67R细胞内α-KG水平的显著降低,而BCAT1的下调或抑制没有观察到BCAA水平的显著降低(图4d,e)。这些结果表明,耐药细胞中BCAT1的上调主要导致细胞α-KG的积累,而不是BCAAs的积累。研究人员探讨了α-KG如何影响抗性细胞的生长。如图4f所示,外源性补充细胞渗透性α- KG衍生物(dimethyl-α-KG,DM-αKG)促进了细胞集落的形成,并显著挽救了gabapentin对67R细胞的抗肿瘤作用。此外,细胞增殖实验显示,补充α-KG不仅挽救了gabapentin引起的生长抑制作用(图4g),而且还损害了加巴喷丁和ASK120067组合在67R细胞中的协同抗生长作用(图3h和图4h)。在AZDR细胞中也观察到类似的结果。综上所述,我们的研究结果表明,BCAA合成代谢产物α- KG的增加有助于BCAT1介导的耐药细胞存活。 图4 α-KG产量的增加参与了BCAT1介导的细胞生长和抗性 四.BCAT1通过α-KG依赖的H3K27去甲基化促进耐药性 α-KG作为几种表观遗传修饰酶的辅助因子参与了细胞的代谢调控,包括Jumonji-C(JmjC)家族的赖氨酸去甲基化酶家族(KDMs)、TET甲基胞嘧啶双加氧酶。作者首先评估了已知的部分受α-KG依赖的去甲基化酶调控的组蛋白赖氨酸甲基化模式。与亲本NCI-H1975细胞相比,67R细胞中H3K27me3的表达显著下降(图5a)。后续实验证明BCAT1基因敲低显著增加了H3K27me3的整体表达,而补充α-KG则挽救了这一表达(图5b),这表明在67R细胞中高表达的BCAT1以α-KG依赖的方式负调控H3K27me3。进一步用GSK-J4(细胞渗透性抑制剂,抑制KDM6A和KDM6B)处理NCI-H1975和67R细胞,GSK-J4在67R耐药细胞中确实依赖性地上调了H3K27me3,而不影响NCI-H1975细胞中H3K27me3的水平(图5c)。此外,GSK-J4处理挽救了bcat1敲低的67R细胞中补充α-KG后H3K27me3水平的下降(图5d),表明KDM6A/6B在调节α-KG依赖的H3K27me3去甲基化中发挥了重要作用。此外,与NCI-H1975细胞相比,GSK-J4在67R细胞中表现出更强的生长抑制活性(图5e),而GSK-J4进一步使67R细胞对ASK120067抑制致敏(图5f)。 图5 BCAT1促进了抗性细胞中α-kg依赖的H3K27去甲基化 五.BCAT1对糖酵解相关基因的表观遗传调控有助于其耐药性 由于H3K27me3被报道为调节多种生物过程,推测α-KG介导的H3K27me3去甲基化导致靶基因的异常转录激活和随后的致癌信号,从而产生耐药性。通过分析临床数据集发现糖酵解/糖异生途径在BCAT1-高的肺腺癌样本中作为顶级差异途径被富集(图5g)。GSEA分析显示,BCAT1的高表达与糖酵解基因特征呈正相关(图5h)。接着进行RNA-seq和GSEA通路分析验证BCAT1表达和糖酵解之间的相关性,发现siRNA介导的BCAT1敲低导致糖酵解通路基因表达显著降低,提示在抗性细胞中,糖酵解相关基因受到BCAT1的正调控。为了探讨糖代谢增强是否与EGFR TKIs耐药性有关,评估了TKI耐药细胞和NCI-H1975细胞中的糖酵解活性,发现67R和AZDR均表现出更高的细胞外酸化率(ECAR)(图6a)。然后,采用RT-qPCR检测糖酵解相关基因,发现其在67R和AZDR细胞中整体上调(图6b和补充图7b)。重要的是,糖酵解抑制剂2-脱氧-d-葡萄糖显著使67R和AZDR细胞对相应的TKI处理致敏。这些结果表明,在EGFR TKI处理下,耐药细胞表现出增强的糖酵解活性来支持细胞存活。 为了确定BCAT1诱导的葡萄糖代谢重编程是否依赖于α-KG介导的表观遗传调控,用α-KG进行了另一项拯救实验。如图6h和补充图6f所示,补充α-KG显著挽救了BCAT1敲低或抑制后糖酵解基因mRNA表达下调的情况。此外,ChIP-qPCR分析显示,在67R细胞和AZDR细胞中,BCAT1敲低导致PFKP和LDHA启动子上的H3K27me3的富集显著增加(图6i)。综上所述,这些结果表明,BCAT1促进了BCAA合成代谢和α-KG依赖的H3K27me3去甲基化,从而转录激活糖酵解基因,促进细胞存活和耐药性(图6j)。 图6 BCAT1通过α-KG依赖的H3K27去甲基化转录激活糖酵解 六.WQQ-345被鉴定为一种具有临床前疗效的新型BCAT1抗肿瘤抑制剂 靶向BCAT1有可能作为一种克服EGFR TKI抗性的策略。然而,有效的BCAT1抑制剂的可用性有限,此研究筛选了一个具有独特结构的γ-氨基丁酸(GABA)衍生物的内部化合物库,从而发现了WQQ-345作为BCAT1抑制剂(图7a),WQQ-345确实可靠地抑制了纯化的重组BCAT1蛋白的活性(图7b),其半抑制浓度值为10.8 mM。为了了解BCAT1和WQQ-345之间的分子相互作用,进行了分子对接分析。WQQ-345通过羧酸段和氨基段与BCAT1活性位点残基(包括Ala334、Tyr161和Thr260)形成直接氢键和水介导的氢键(图7c),有助于解释WQQ-345对BCAT1的抑制能力。接下来采用细胞热位移实验来评估BCAT1在67R细胞中与药物结合时的热稳定性。同时,WQQ-345剂量依赖性地减少了67R耐药细胞的集落形成(图7d),通过细胞增殖实验进一步证实了其靶标抗生长作用。此外,WQQ-345和ASK120067或奥西替尼联合治疗比单一治疗表现出更强的细胞生长抑制(图7e)。在机制上,WQQ-345处理导致细胞α-KG水平降低,H3K27me3的表达上调,并导致糖酵解酶的表达降低(PFKP和LDHA),以及67R细胞的糖酵解活性受损(图7f-i)。 进一步进行动物实验以验证WQQ-345在TKI耐药肿瘤中的体内效力。如图7j和补充图8e所示,在67R中,口服120 mg/kg WQQ-345导致皮下异种移植模型中肿瘤显著消退。此外,WQQ-345处理与对照组相比,肿瘤中H3K27me3表达增加,PFKP、LDHA和PKM1/2表达水平降低(图7k)。综上所述,这些结果,证实了WQQ-345的抗肿瘤和抗糖酵解作用,这支持了药理抑制BCAT1作为TKI耐药NSCLC的潜在治疗方法的观点。 图7 WQQ-345被鉴定为一种具有抗肿瘤效力的新型BCAT1抑制剂 总结:本研究阐明了BCAT1介导的BCAA代谢重编程在提高NSCLC细胞存活和TKI耐药性中的意义。在机制上,BCAT1提高了α- KG的产生,通过促进KDM6A/6b介导的H3K27去甲基化,促进糖酵解基因的表达,从而增强糖酵解、细胞存活和药物耐受性,为直接靶向BCAT1作为肺癌治疗策略提供了广泛的证据。 参考文献 Zhang T, Pan Z, Gao J, et al. Branched-chain amino acid transaminase 1 confers EGFR-TKI resistance through epigenetic glycolytic activation. Signal Transduct Target Ther. 2024;9(1):216.