
2024-08-23

题目:Single-cell multi-omic and spatial profiling of human kidneys implicates the fibrotic microenvironment in kidney disease progression
中文题目:人类肾脏单细胞多组学和空间分析表明肾脏疾病进展中的纤维化微环境
期刊:nature genetics
影响因子:31.7
发表时间:2024年5月
技术手段:snRNA-seq、scRNA-seq、snATAC-seq 、Visium、CosMx
样本信息: 4个健康和11个患病的人类肾脏样本
引言
肾脏作为人体中复杂的三维结构器官,其健康与疾病的空间和分子原理尚未被完全理解。慢性肾脏疾病(CKD)是全球主要的健康问题之一,糖尿病和高血压是导致 CKD 的主要原因。尽管单细胞转录组测序等技术为研究肾脏细胞组成提供了深入见解,但空间信息的缺乏限制了对细胞类型的准确定位以及对局部基因表达变化和细胞间通信的探究。本篇文章旨在通过结合单细胞多组学数据和空间转录组学技术,生成全面的人类肾脏单细胞图谱,并深入解析肾脏纤维化微环境在肾脏疾病进展中的作用。
Part.1、 研究背景
肾脏是人体复杂的三维结构,但肾脏健康和疾病的空间和分子原理仍未得到充分的了解。纤维化的严重程度可以作为慢性肾病(CKD)和确定哪些患者将要发展为终末期肾功能衰竭需要移植或透析等临床问题的一个预测因素,但一直尚未受到重视。
虽然现有的一些技术如scRNA-seq、snRNA-seq、snATAC-seq等解析了肾脏的分子和细胞组成以及在发育和疾病过程中的变化,但空间信息的缺乏阻碍了对已知细胞类型的精确定位,限制了对局部基因表达变化和细胞间通信的解析,不利于探索其在疾病中的失调,维持机体健康。
Part.2、研究结果
结果1:人类肾脏的单细胞转录组图谱
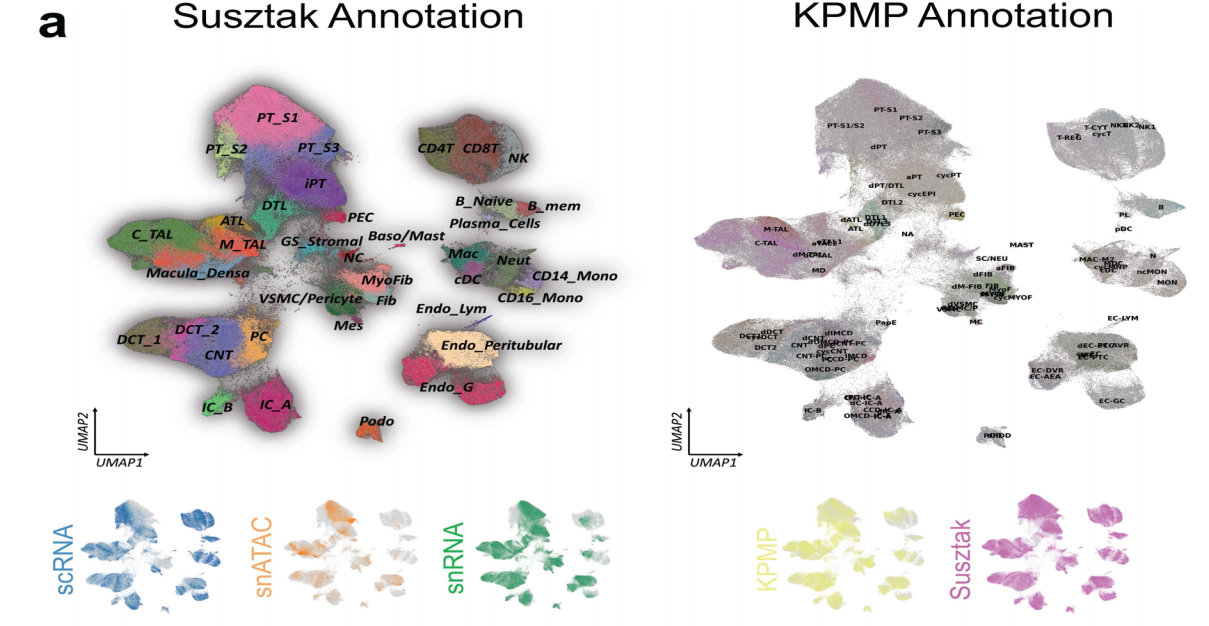
作者对来自58名参与者人类健康对照组(n=36)和CKD(n=45)的81例肾脏样本,通过使用SCVI工具对来自snRNA-seq、scRNA-seq和snATAC-seq数据集的338,565个细胞/细胞核的集合进行整合分析,鉴定出6大类细胞类型分别是内皮细胞、基质细胞、小管上皮细胞、免疫细胞类型、肾小球细胞和神经/雪旺细胞,在这些大类中确定了44种主要细胞类型和114个不同的细胞亚型(图1a)。
单细胞和单核人肾图谱捕获了肾脏所有解剖区域的健康和病变状态下的肾细胞类型,主要细胞类型主要为:足细胞、不同类型的近端小管(PT)1-3段(PT_S1、S2、S3和损伤)、Henle下降薄环、上升薄环、皮质和髓质厚上升环(C_TAL和M_TAL)、远端曲小管(DCT)、连接小管(CNT)、集合管主细胞(PC)、α型和β型夹层细胞(IC_A和IC_B)、间质细胞、内皮细胞等,也捕获了一些罕见的细胞类型,如11种不同类型的内皮细胞包括传入小动脉、传出小动脉(FBLN5+)细胞和直肠血管(MCTP1+)细胞(图1b、c,扩展数据图1),并鉴定了人类肾脏免疫细胞类群,淋巴细胞(T淋巴细胞CD4+(CD4T),T淋巴细胞CD8+(CD8T)、自然杀伤细胞(NKT)、双阴性T细胞、TH17、B_naive、B_intermediate 、B_memory和浆细胞)和髓系细胞(中性粒细胞、嗜碱性粒细胞/肥大细胞、CD14_单核细胞、CD16_单核细胞,巨噬细胞、经典和浆细胞样树突状细胞,提供了全面的层次聚类,包括关于性别、疾病状态、样本身份和分析方法的信息(图1d)。且为了进一步改进和验证细胞类型和状态的识别,作者将人肾图谱与人类肾脏精准医学项目(KPMP)数据集结合,共获得588425个细胞的集合,使用不同的分析方式验证了数据集之间细胞类型注释的一致性(图1c,扩展数据图2),构建了人类肾脏的单细胞转录组图谱。
小结:对 81 个人类肾脏组织样本进行单细胞分析,包括单细胞 RNA 测序(scRNA-seq)、单细胞核 RNA 测序(snRNA-seq)和单细胞核可及染色质测序(snATAC-seq),整合了这些数据,确定了细胞类型并绘制了它们在组织内的位置,识别了 6 个细胞超家族和 114 种不同的细胞类型或状态。
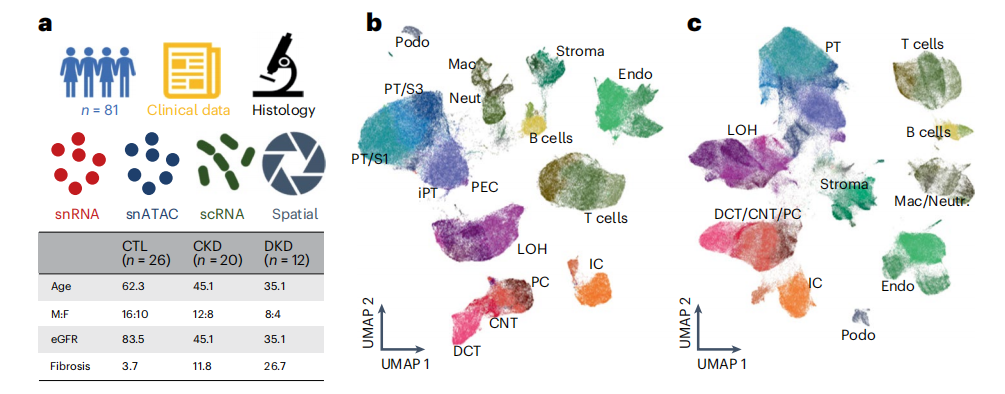
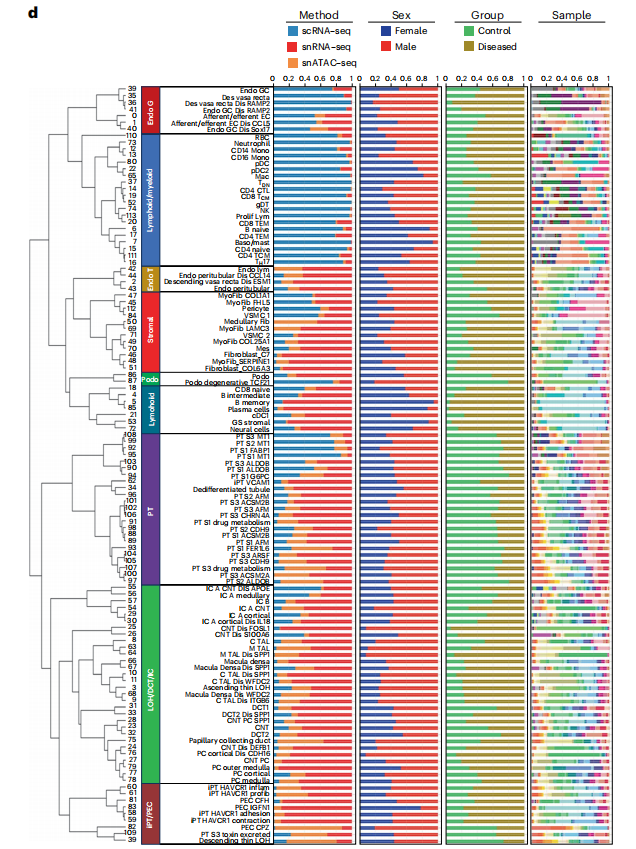
图1:综合整合的多模态人肾单细胞图谱。
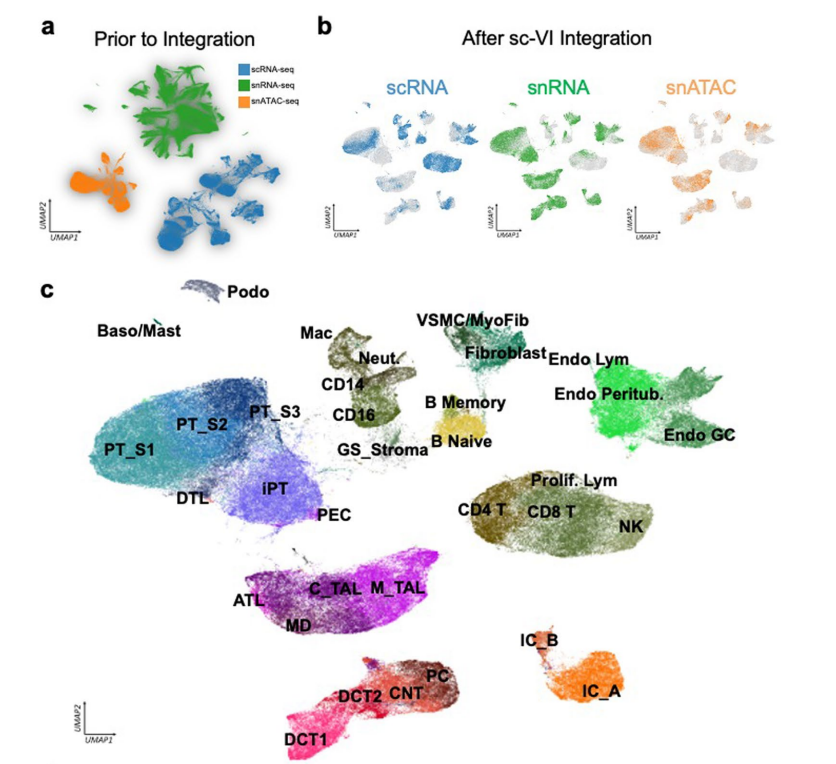
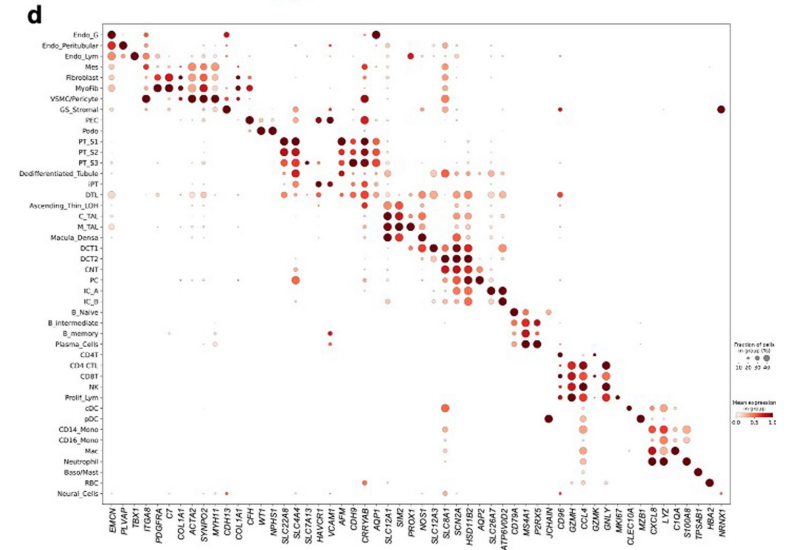
扩展数据图1:多模态单细胞图谱
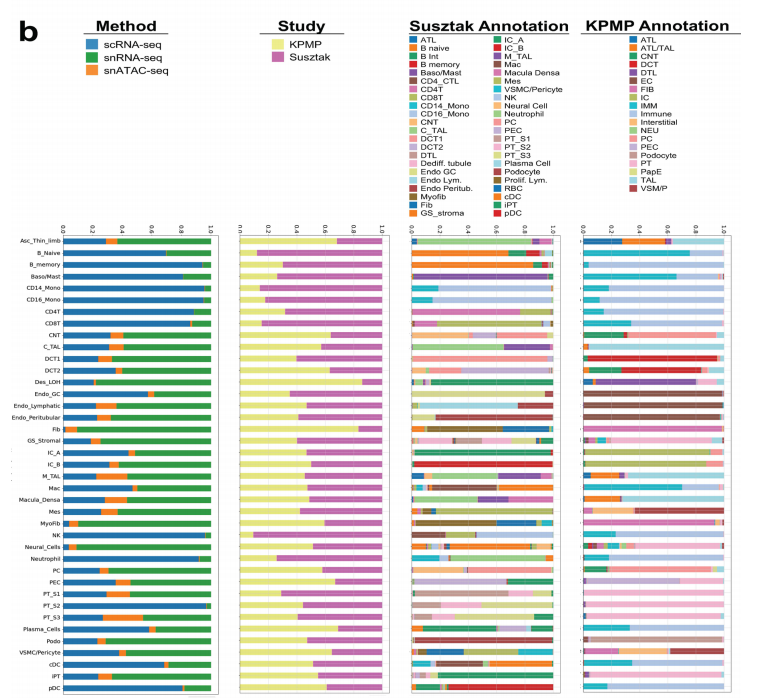
扩展数据图2:多个来源的snRNA-seq、scRNA-seq和snATAC-seq数据集集成。
结果2:高空间分辨率下的人类肾脏图谱
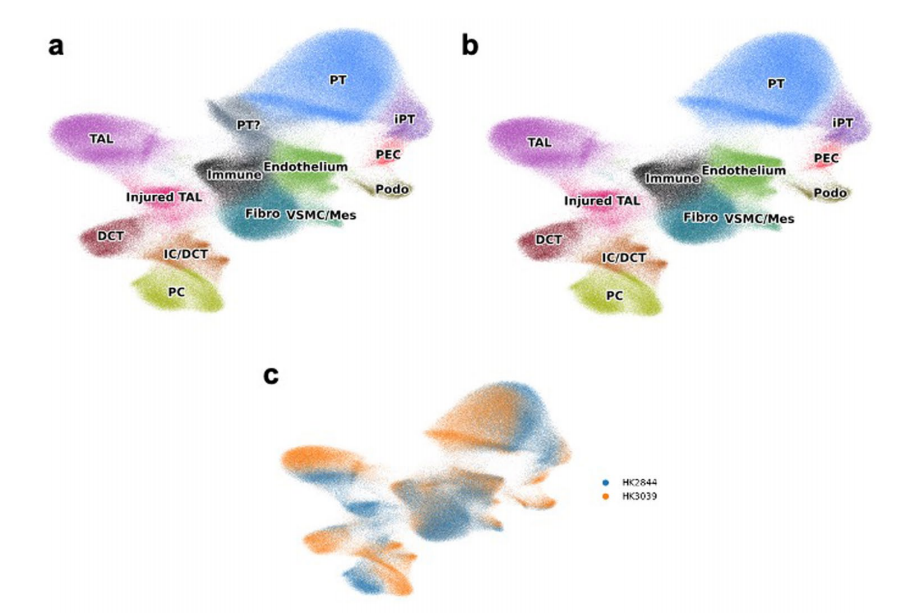
细胞类型识别的一个关键限制是缺乏高分辨率、空间分辨率的细胞转录组学信息。为了克服这个限制,作者利用Visium FFPE平台和CosMx平台对样本进行检测,产生了spRNA-seq数据集,并利用分离的单核/单细胞数据来识别空间数据集中的细胞类型。首先对Visium数据利用cell2估算每种细胞类型观察到的基因表达谱,然后使用CellTrek,使用分离的数据将细胞类型的空间位置计算到接近单细胞水平(计算后的149,717个数据点),高分辨率的数据可以将所有已识别的细胞类型从分离的数据集投影到它们的空间位置,确定了肾小球细胞类型,PT细胞类型,免疫和纤维化细胞类型,远端小管细胞类型和Henle细胞类型(图2a,b)。作者进一步利用CosMx(NanoString)平台在真正的单细胞分辨率下检测人类肾脏样本,分析了1000个基因的表达,生成了高质量的数据集和不同的统一流形近似和投影(UMAP)细胞簇,对应于特定肾细胞类型(扩展数据图3),与snRNA分离的细胞数据无缝集成,进一步证实了细胞类型的注释正确(扩展数据图4)。此外,使用CosMx检测验证了这些细胞类型的位置,基于基因表达的细胞类型预测与载玻片的解剖和组织学注释完全匹配(图2b)。
小结:使用 Visium FFPE 平台和 CosMx 平台生成了空间转录组学(SP)数据,包括 14 个 spRNA - seq 数据集(3 个健康样本和 11 个患病样本),并使用 Cell2location 和 CellTrek 方法确定了细胞类型的空间位置,还使用 CosMx 平台在单细胞分辨率下分析了人类肾脏样本的表达情况。
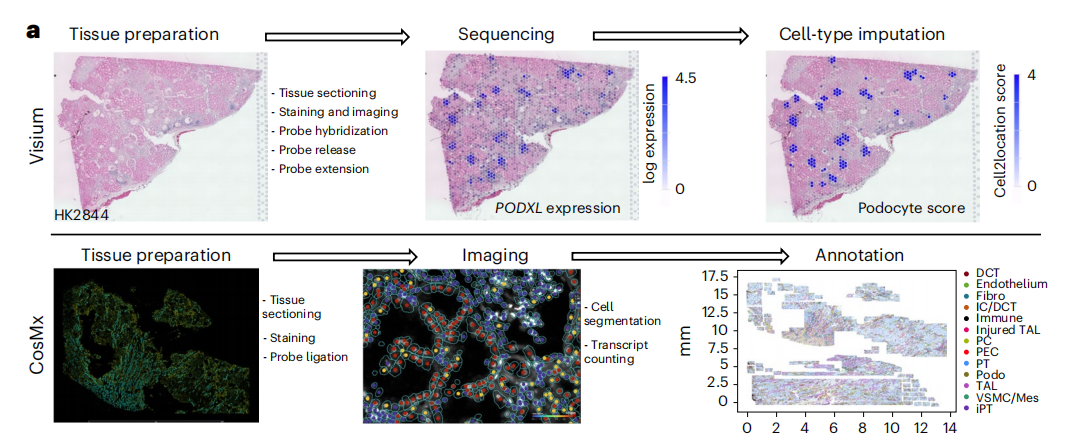

图2:空间分辨下的人类肾脏细胞映射
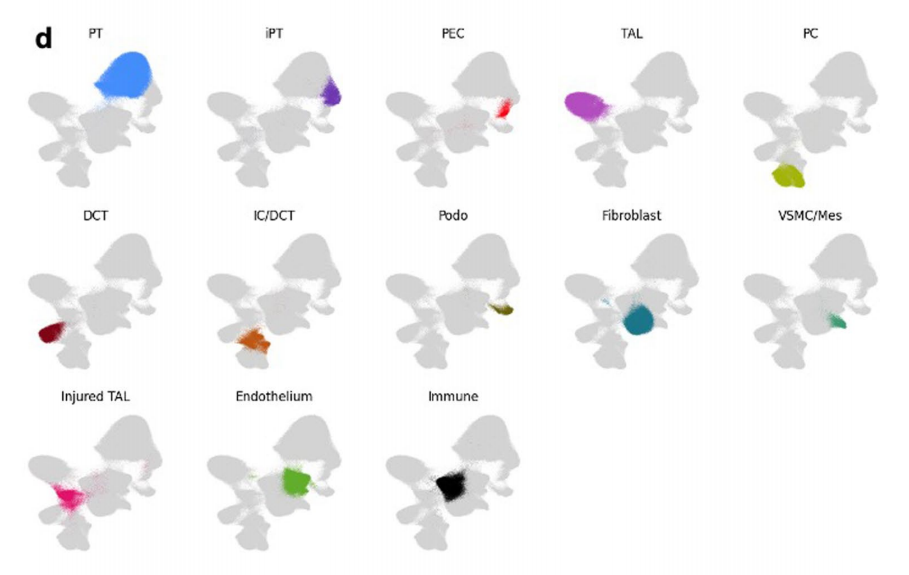

扩展数据图3:CosMx平台下细胞群的识别鉴定

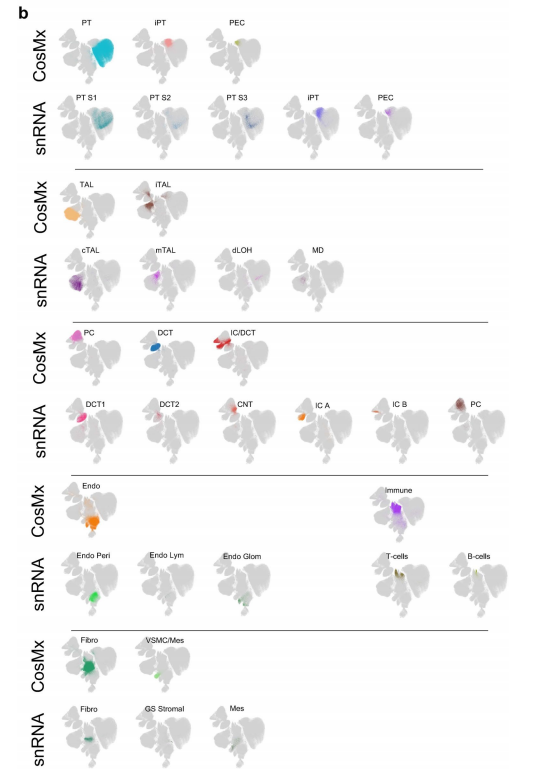
扩展数据图4:CosMx注释和snRNA-seq注释的比较
结果3:纤维化中基质细胞的异质性和基质的产生
作者在整合的snRNA-seq/scRNA-seq和snATAC-seq中分析了肾纤维化相关的变化,因为纤维化是所有进展性CKD的常见表现,通过结合胶原蛋白、糖蛋白和蛋白聚糖基因的表达情况计算ECM评分,结果显示肌成纤维细胞(myofibroblasts),其次是成纤维细胞(fibroblasts),最后是血管平滑肌细胞/周细胞(VSMC/pericytes)的ECM评分最高(图3a)。与健康样本相比,疾病样本的肌成纤维细胞占比显著增多(图3b),并且这些肌成纤维细胞位于高ECM评分区域内(图3c),组合的数据集能够识别基质细胞亚型,这与以前的研究和数据集一致(扩展数据图4和5)且细胞亚型具有正确的空间位置(扩展数据图6和7)。对整合数据集中的32,706个基质细胞进行亚聚类分群,如前所述,作者得到了基质细胞中PDGFRB的表达呈阳性,能够识别系膜细胞(ITGA8和POSTN)、VSMC/周细胞(MYH11、NOTCH3和NTRK3)、成纤维细胞(KCNK2和FAP)和肌成纤维细胞(COL1A1和SYNPO2)的标记物(图3d、e),并使用MetaNowobibor工具验证了基质细胞亚型的一致性和它们的空间位置(图3f)。作者进一步对基质细胞群进行KEGG功能富集分析,结果突出了不同基质细胞之间的重要差异,如肌成纤维细胞显示了病灶黏附和TGFβ信号通路基因的富集(图3g)。
小结:通过分析与胶原蛋白、糖蛋白和蛋白聚糖表达相关的细胞外基质(ECM)评分,发现肌成纤维细胞、成纤维细胞和血管平滑肌细胞 / 周细胞的 ECM 评分较高,且疾病样本中肌成纤维细胞的频率更高。同时,确定了与纤维化相关的细胞类型和标志物,并验证了其与其他研究的一致性。
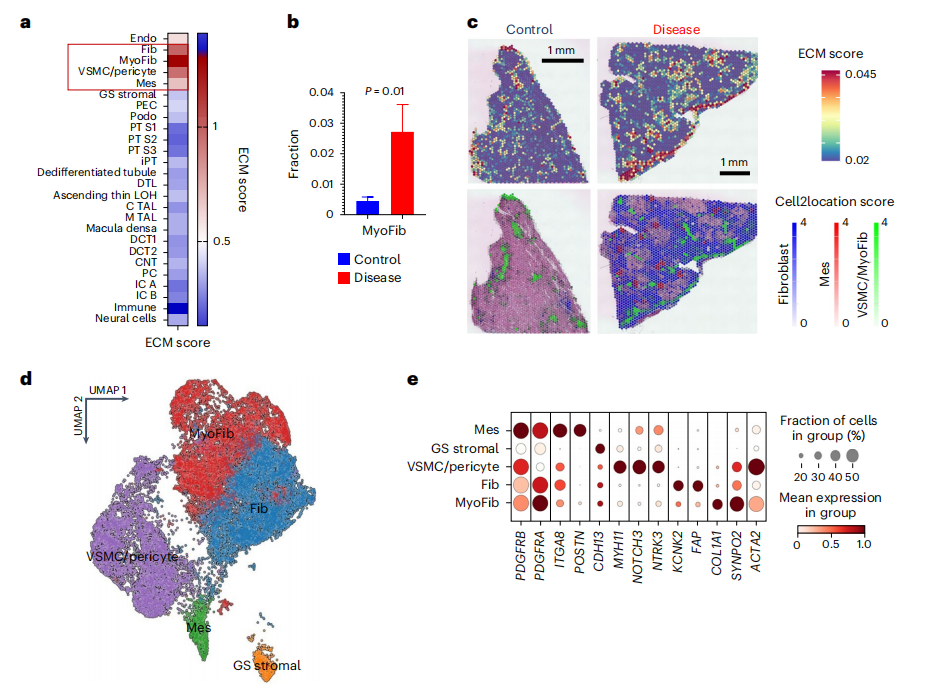
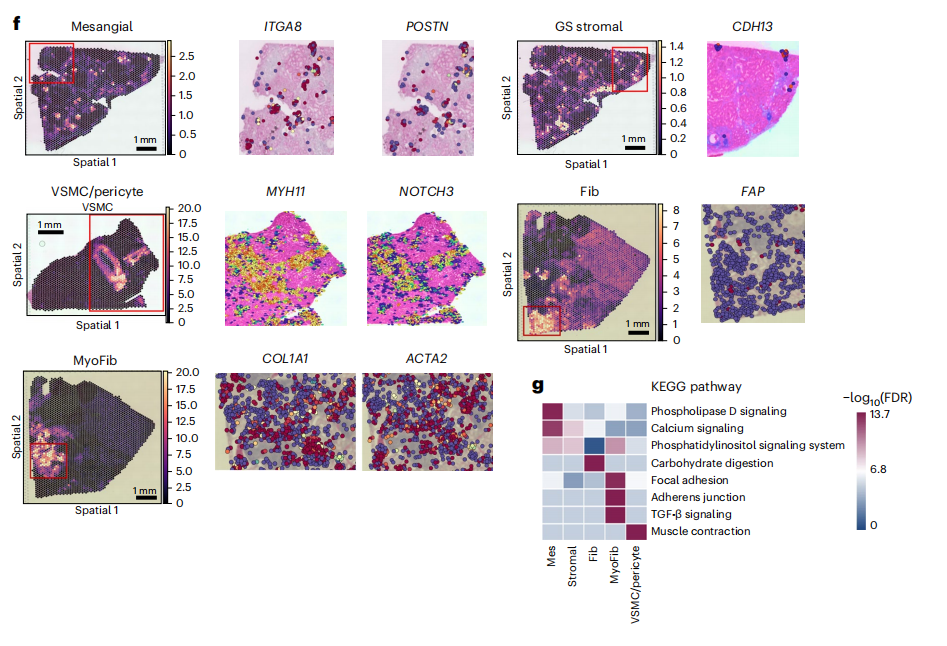
图3:人类肾脏基质细胞图谱
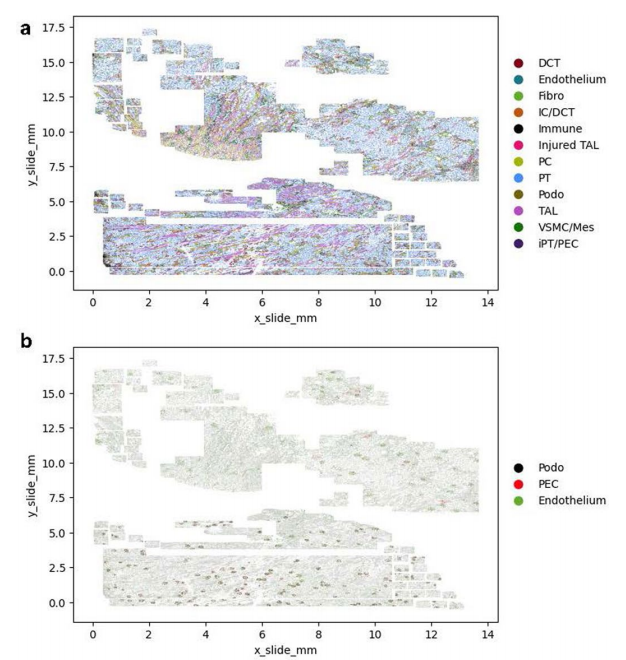
扩展数据图5:CosMx注释的各细胞类群位置
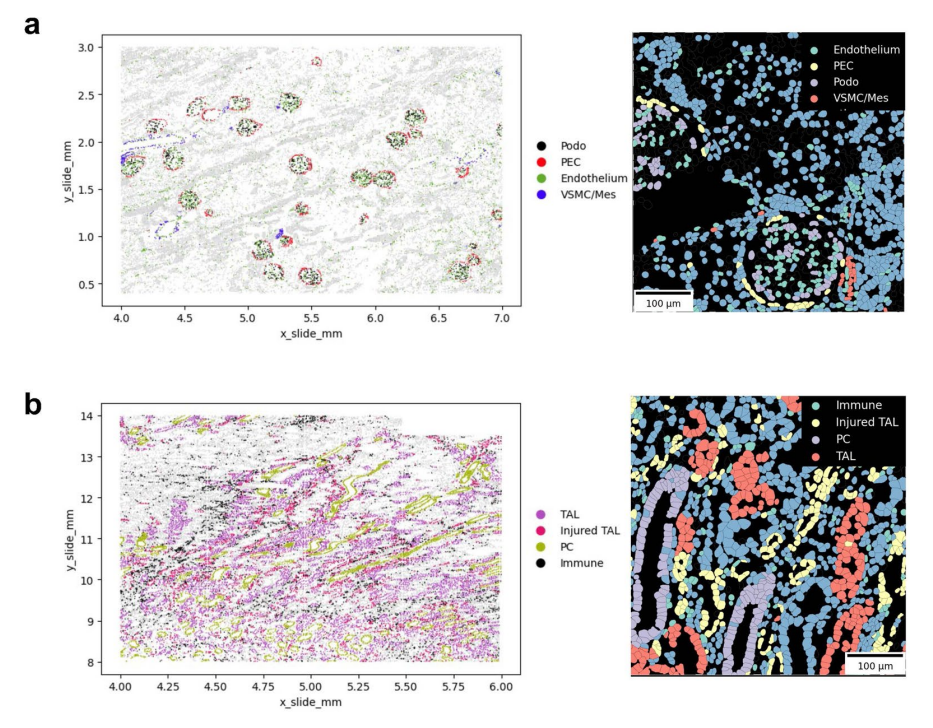
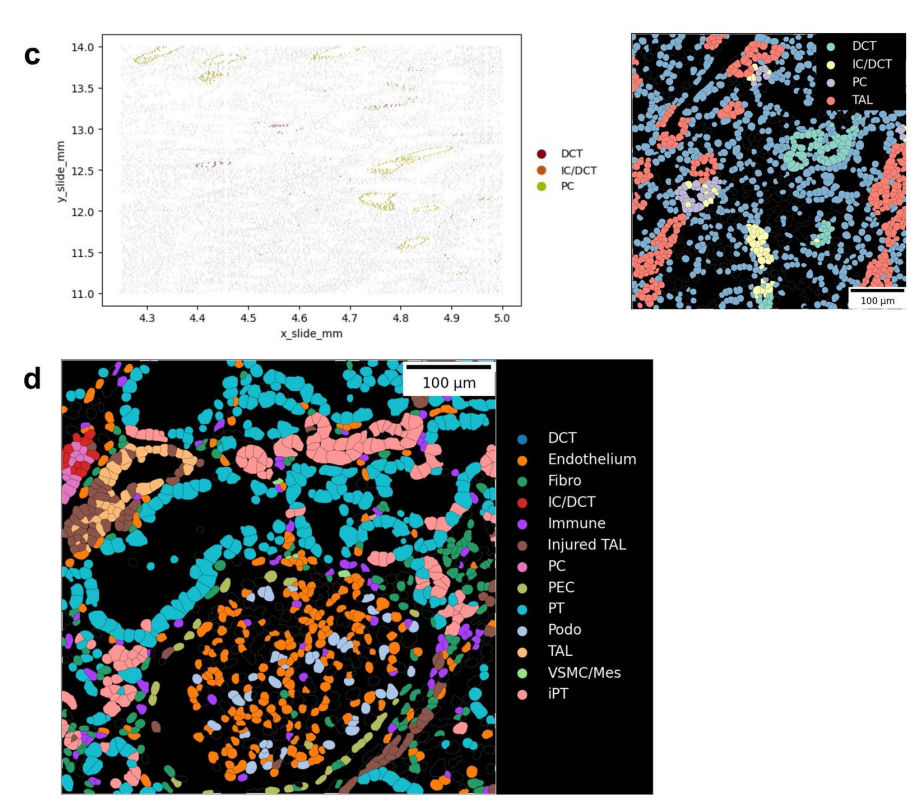
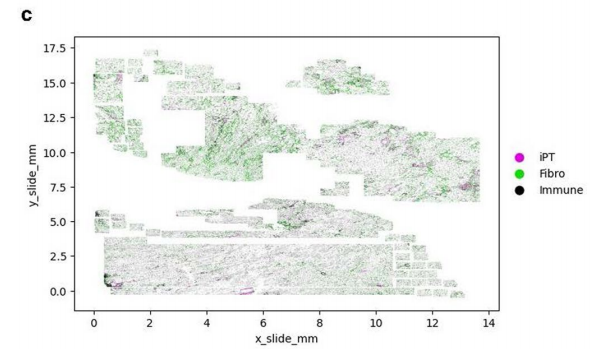
扩展数据图6:CosMx载玻片上肾脏各细胞类型的位置
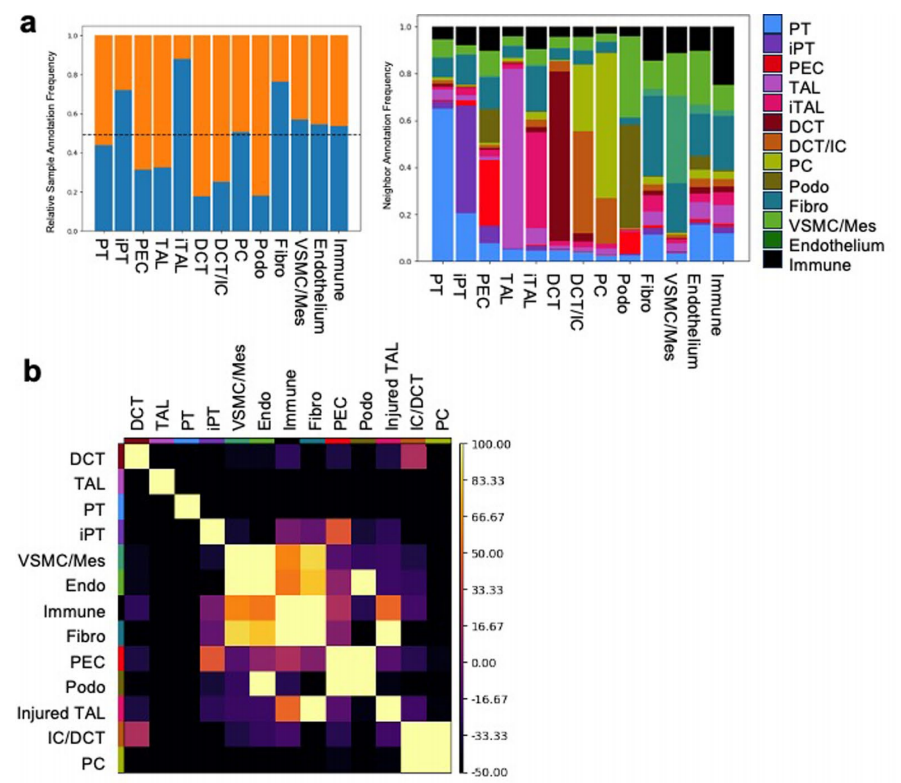
扩展数据图7:CosMx载玻片细胞类群间的邻域特征
结果4:定义肾脏FME(纤维化微环境)
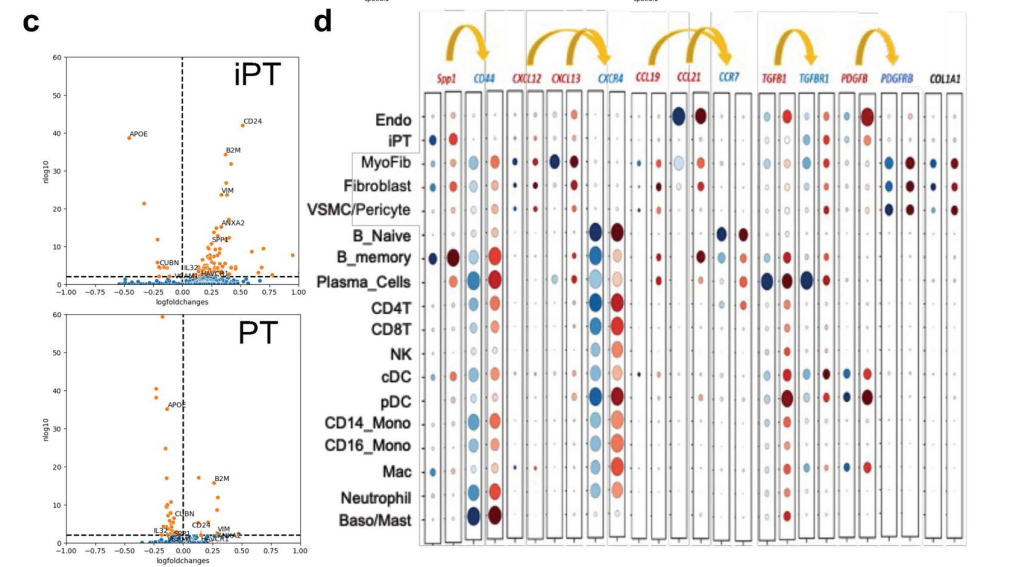
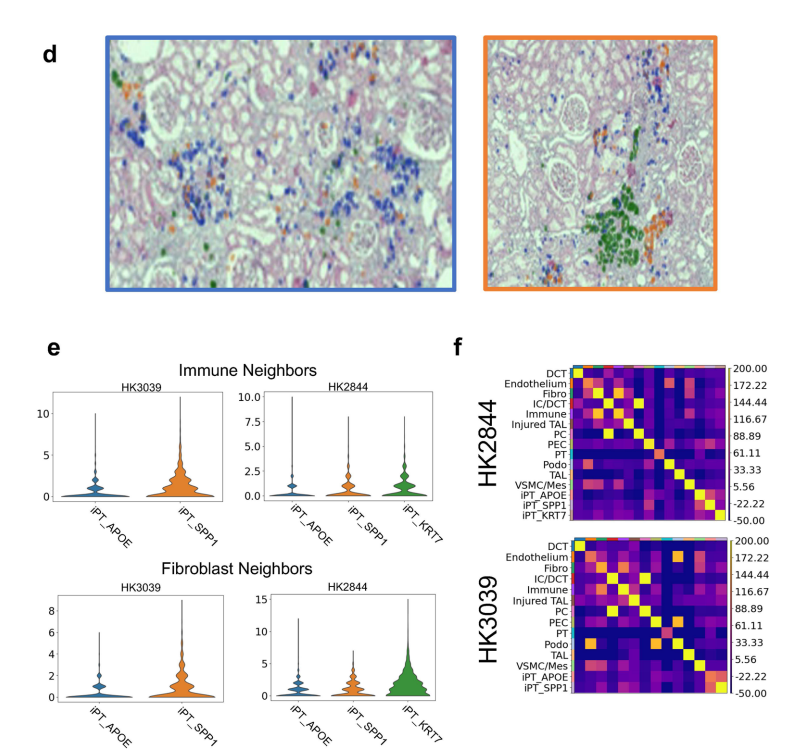
作者利用spRNA-seq对Visium数据集进行非负矩阵分解(NMF)定义的人肾MEs(微环境),结果发现了四种主要的ME,它们在视觉上对应于肾小球、肾小管、纤维化和免疫区域,对每个MEs中检测到的基因进行GO富集分析并与解剖位置对应,计算定义FME与肾脏ECM基因表达,评估纤维化(图4a)。通过ME与ECM评分、细胞类型的相关性,以及利用cell2、Celltrek和CosMxd对病变肾脏样本中FME中不同细胞类型的位置进行注释,鉴定了一种特异性免疫ME,位于FME区域内,呈斑片状分布,免疫ME由树突状细胞、浆细胞、B淋巴细胞和T淋巴细胞组成(图4b、c)。免疫性ME组织类似于早期的三级淋巴样结构,用细胞类型特异性抗体进行的免疫染色研究可证实这些特异性免疫细胞和免疫细胞聚集物的存在,与Visium的数据一致,作者通过IMC(原位质谱)证实了iPT-HAVCR1+细胞、B细胞、CD4T细胞、血浆、髓系和内皮细胞的蛋白表达(图4d)。为了进一步了解FMEs中的细胞相互作用,作者在集成的scRNA-seq/snRNA-seq和snATAC-seq数据集上实现了CellChat,并在spRNA-seq数据集上通过最优传输(COMMOT)进行通信分析,结果发现SPP1、CXCL12、CCL19、CCL21、PDGFB和TGFB1及其受体在FME区域富集(图 4e,扩展数据图8)。FMEs中的iPT细胞表达SPP1和PDGFB,并与基质细胞有很强的相互作用,此外还发现了在FME区域的内皮细胞表达CD34和CDH5,基质细胞富含CXCL12、CCL19和CCL21等趋化因子,而其受体在不同的免疫细胞中表达,提示基质细胞可能向免疫细胞发出信号,在FME相关的免疫聚集物中观察到了PDGFB和TGFB1,这些已知的纤维化介质(扩展数据图8)。
小结:通过对 Visium 数据集进行非负矩阵分解(NMF),确定了肾脏中的四个主要微环境(ME),包括肾小球、肾小管、纤维化和免疫微环境,并分析了这些微环境中的基因表达和细胞组成,发现 FME 与肾脏 ECM 基因表达和病理学家评估的纤维化密切相关,且其中的免疫微环境组织类似于早期的三级淋巴结构。

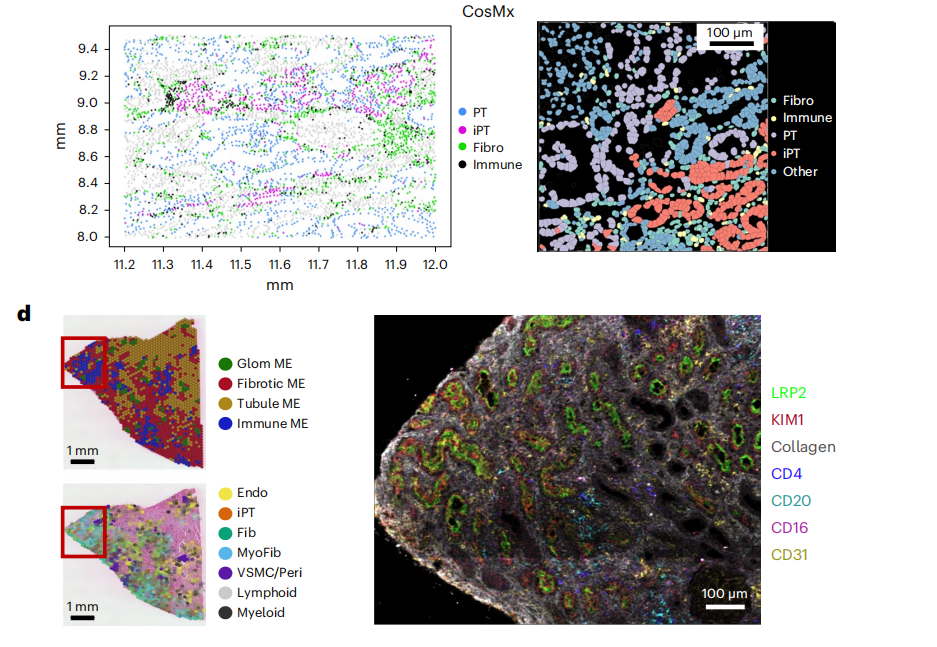
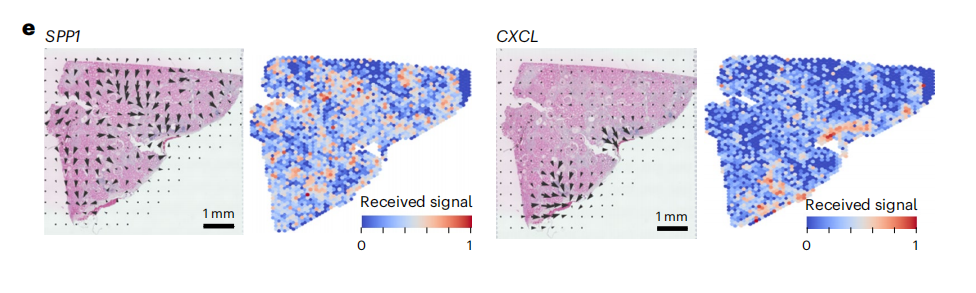
图:4:人肾脏纤维化微环境(FME)
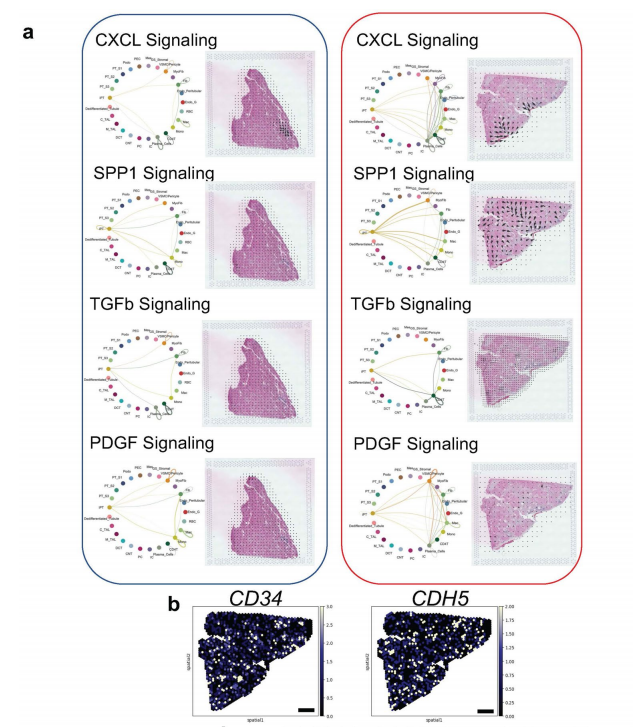
扩展数据图8:纤维化微环境中spRNA-seq数据集中的细胞-细胞相互作用分析
结果5:人肾纤维化中损伤的肾小管细胞
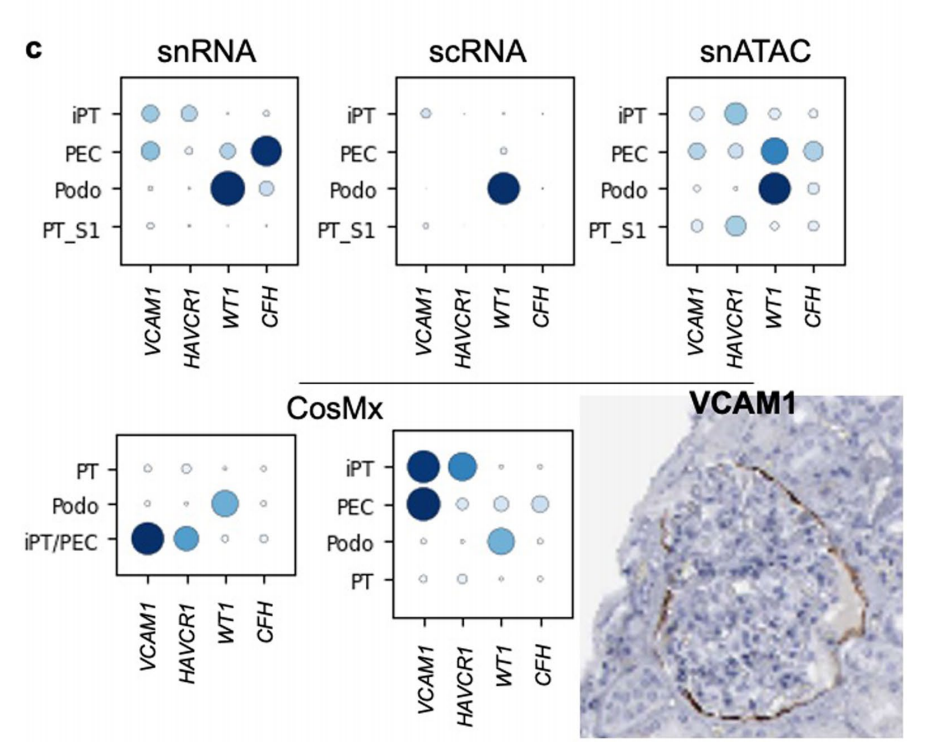
FME的细胞类型富集分析表明,FMEs中存在成纤维细胞、肌成纤维细胞、免疫细胞、内皮细胞和损伤的小管细胞,包括损伤的近端小管(iPT)细胞(图4b)。虽然iPT细胞尚未被很好的描述,但它们已经在患病的小鼠和人类肾脏样本中被鉴定出来,iPT细胞与PT细胞的物理位置很接近(图4c和5a)。此外,作者注意到PT细胞表现出与eGFR和纤维化相关的基因数量最多,而疾病和对照样本之间的细胞类型分数变化最大(图5b、c),相比之下,ME中iPT细胞明显富集,而在患病样本中数量增加(图5d)。作者通过对CosMx数据进行仔细的亚聚类,发现VCAM1在PEC和iPT中的表达,而HAVCR1对iPT具有特异性(图5e和扩展数据图9)。
作者通过Visium数据,检测iPT的异质性,首先利用CellTrek的单细胞共表达模块,鉴定了两种不同的iPT模块,分别对应于患病样本中的两种iPT亚型(图5f),而在“健康”样本中只对应于一种iPT亚型。回到丰富的整合图谱,作者发现其中一个iPT簇表达了VCAM1、ACSL1、ASS1和ASPA,这些基因在细胞代谢中起作用,定义这个集群为iPT_VCAM1+,该聚类存在于健康样本中,且该聚类与表达MT1等线粒体基因的整合数据集中其他损伤的PT细胞很接近(图5f)。第二个iPT簇表达HAVCR1(编码KIM1)、NFKBIZ、IL-18、ITGA3、PDGFB和ITGB1,并富集表达与细胞粘附和基质相关的基因(iPT-HAVCR1+),在Visium空间数据集和分离数据集中,大多数iPT-HAVCR1+细胞都在CKD样本中(图5g)。使用Monocle对PT和iPT细胞进行拟时间分析,发现PT细胞向iPT_VCAM1+和iPT_HAVCR1+的连续分化路径(图5h)。其次,作者通过已经位置验证的CosMx数据对iPT细胞进行亚聚类,结果发现iPT的异质性与邻近细胞的身份相对应(扩展数据图9),这为Visium数据提供了支撑,即iPT亚群共定位,并可能与潜在的ME相关。在CosMx数据集中,APOE、SPP1和KRT7(扩展数据图9b)标记了这些子簇,与其他iPT marker相比,作者对这些特异性marker的识别可能与CosMx平台与整个转录组方法相比所使用的转录本相对较少有关。总之,不同类型的单细胞组学数据表明了一个高度可塑性的PT细胞群,包括iPT细胞。SP分析强调了不同类型的iPT细胞(VCAM1+和HAVCR1+),在非ckd成人肾脏样本中观察到VCAM+ iPT和PEC细胞,而HAVCR1+细胞在FME和病变肾脏中富集。
小结:在肾脏纤维化中发现了受损的近端肾小管(iPT)细胞,这些细胞与近端肾小管细胞物理位置接近,且在疾病样本中富集。通过对 CosMx 数据的进一步分析,确定了 iPT 细胞的亚型及其标志物,并发现 iPT 细胞的异质性与相邻细胞的身份有关。
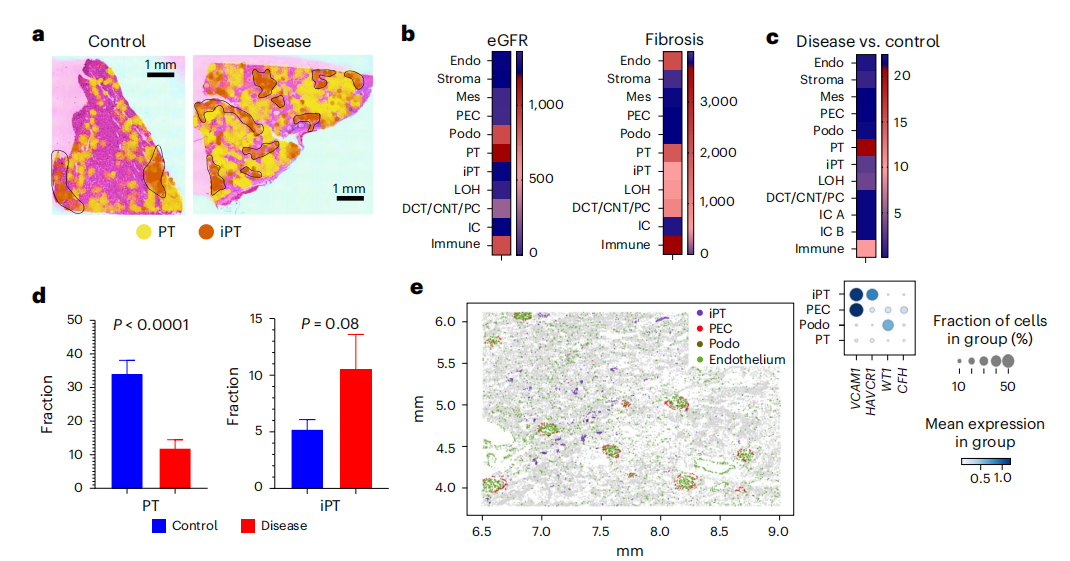
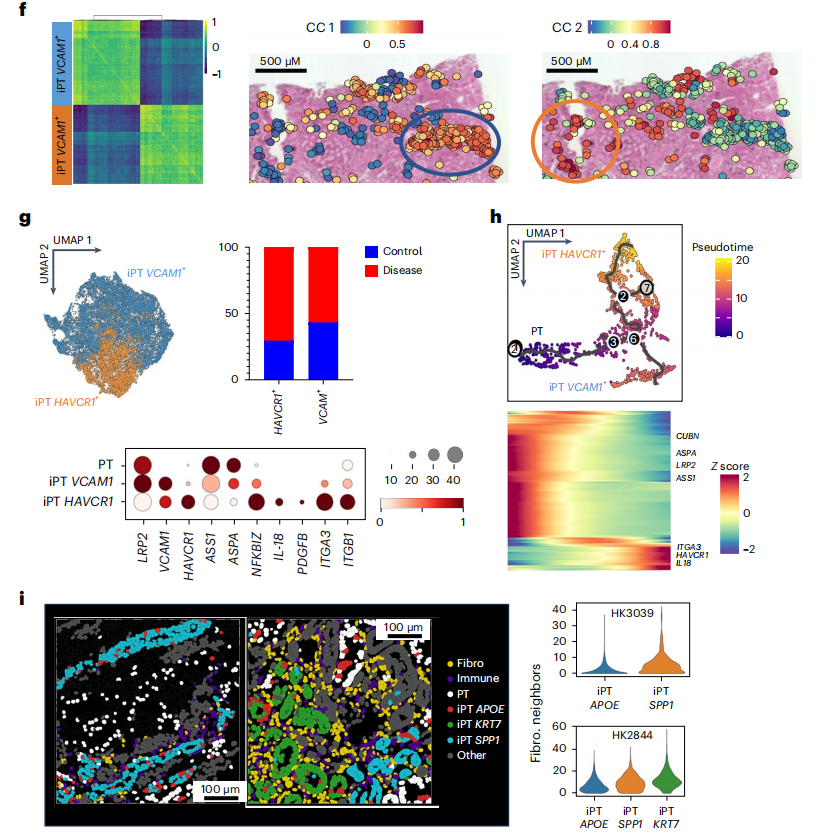
图5:在患病的人肾脏中的iPT细胞
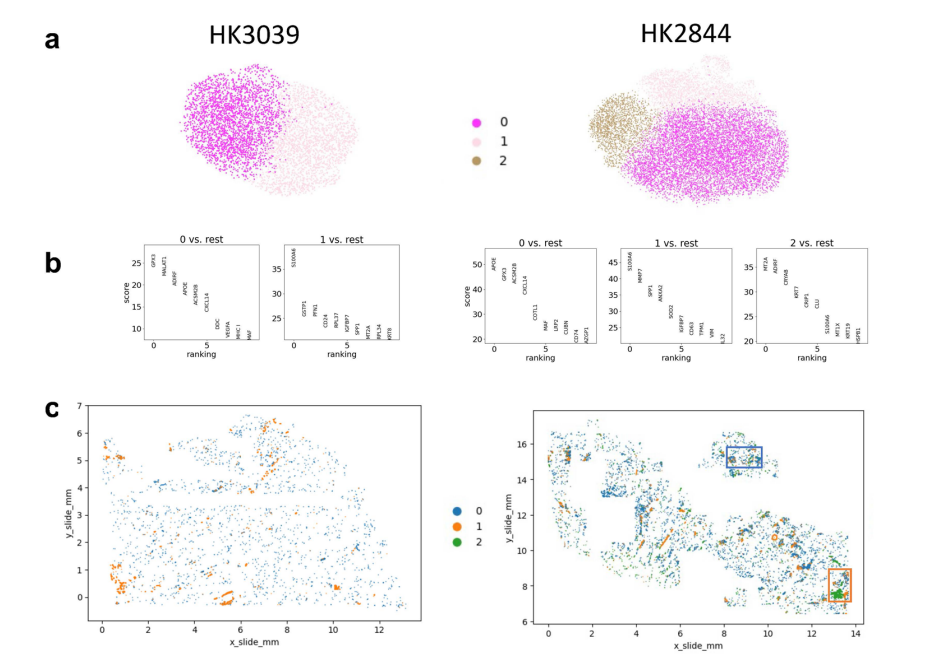
扩展数据图9:CosMx上损伤PT亚群的空间特征
结果6:FME基因可预测疾病进展
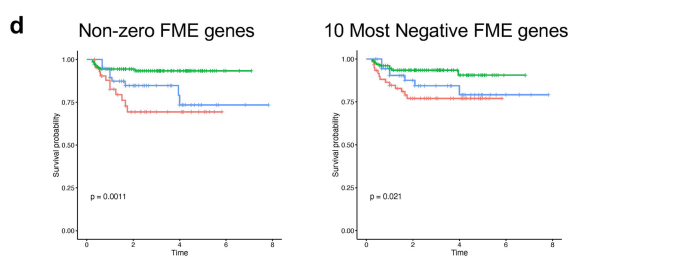
作者为了验证spRNA-seq是否有助于疾病分类和预后评估,首先生成了一个FME基因特征(FME-GS),并使用该基因特征基于空间单细胞基因表达信息进行分析,其中包含292个人类肾脏(图6a),包括健康样本和不同严重程度的CKD样本(归因于糖尿病和高血压),FME-GS成功地将患有更严重疾病(纤维化程度更高,eGFR更低)的样本与更健康的样本完全区分开来(图6b、c),尽管这些参数未包含在聚类算法中。接下来,为了了解FME-GS是否可以预测肾脏疾病的预后,作者在结果中发现细胞簇1亚群,具有最高FME-GS负荷的样本,达到终点的几率高出4倍,定义为eGFR有40%的变化或达到终末期肾衰竭(eGFR<15mlmin−1;图6c)。然而,亚组分析显示,FME-GS最高的样本的纤维化程度在统计学上更高,分别为12.1%和6.51%。虽然这种差异很小,但差异具有统计学意义。最后,作者想了解FME-GS是否也可以预测eGFR保留患者的肾脏疾病进展和最小可观察到的结构损伤,使用这些参数定义缺乏结构性和功能性肾损伤(CKD/纤维化)(图6d)。病理学报告显示纤维化评分无法预测这些样本的结果(图6e)。Kaplan-Meier分析表明,FME-GS负荷最高的细胞簇1达到终点时HR显著升高(图6e)。虽然整个FME基因集可以更好地预测结果,但仅使用最小绝对收缩和选择算子中(LASSO)回归的前十个基因仍显示出肾衰竭有统计学意义的富集(P=0.021;扩展数据图10)。使用随机基因集对样本进行聚类没有相关性结果,通过分析细胞类型与肾脏疾病进展之间的关系,发现基因与eGFR斜率相关的细胞富含iPT和基质细胞,这可能暗示了它们的因果作用(扩展数据图10)。
小结:生成了 FME 基因特征(FME - GS),并使用该特征分析了来自外部肾脏队列的 292 个人类肾脏样本,发现 FME - GS 能够成功区分疾病严重程度不同的样本,且在预测肾脏疾病预后方面具有重要价值,其预测效果优于传统的纤维化评分。
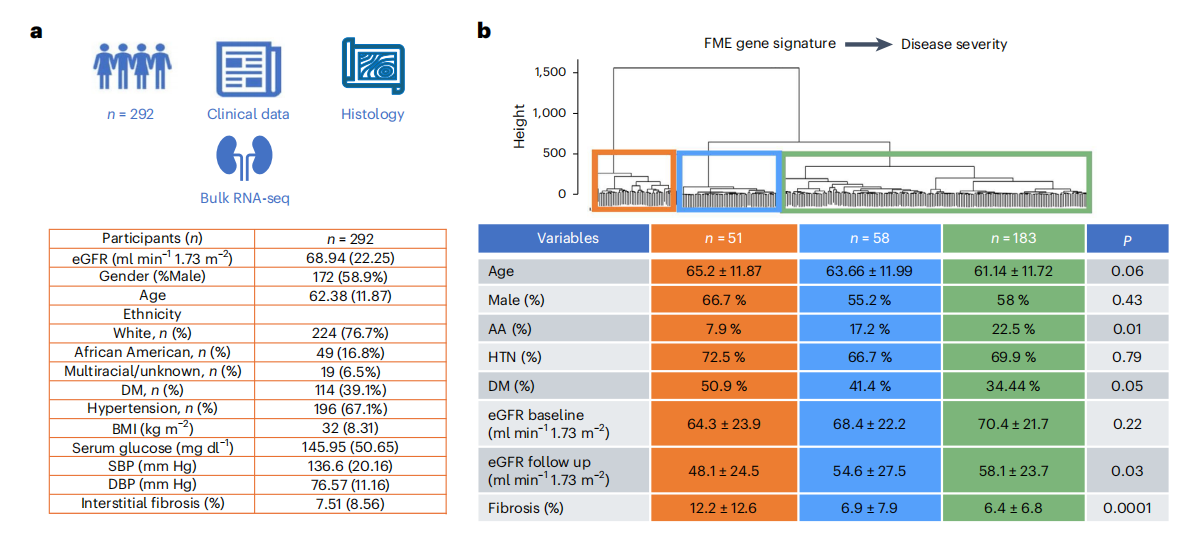
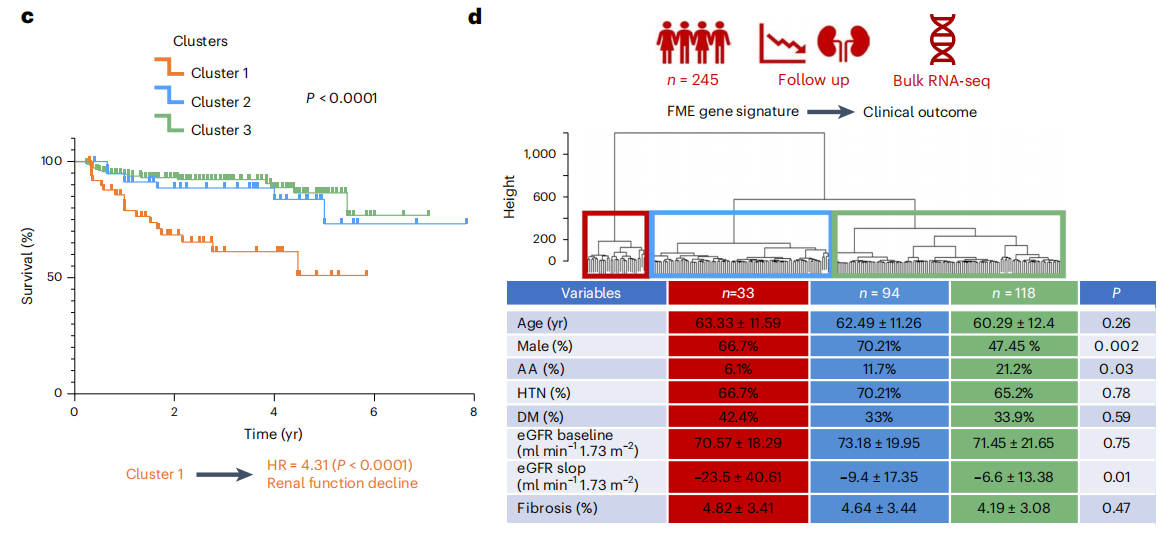
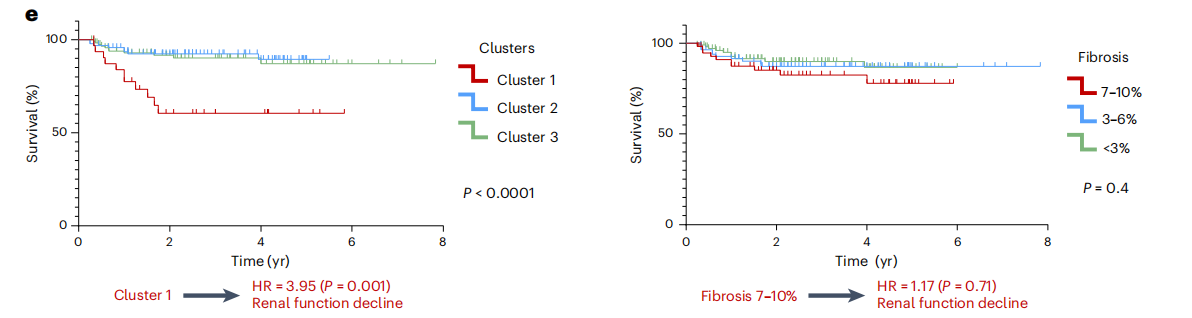
图6:FME-GS对大样本中疾病预后的预测
扩展数据图10:FME基因的表达可预测肾脏的预后。
Part.4
总 结
综上所述,该研究利用单细胞组学数据(scRNA-seq,snRNA-seq和snATAC-seq)与空间转录组测序(spRNA-seq,Visium FFPE和CosMx)技术结合,构建了全面且空间分辨率高的人类肾脏图谱,填补了肾脏健康和疾病的空间分子原理的知识空白,揭示了肾脏纤维化中基质细胞的异质性,定义了肾脏各种组织的微环境包括纤维化微环境(FME), 展示了 FME 作为临床有意义的预后疾病生物标志物的作用。总之,该研究为肾脏疾病的研究提供了新的视角和有价值的信息,有助于深入理解肾脏健康和疾病的机制,并为疾病的诊断和治疗提供了潜在的靶点。