2024-09-02

研究鉴定细胞分化中复杂的基因调控机制是发育生物学的主要目标。斑马鱼(Danio rerio)是一种脊椎类模式动物,具有胚体透明、繁殖速度快、信号通路和基因与人类具高度同源性等特点,目前,已有许多研究团队对不同时期的斑马鱼表观基因组和转录组进行数据收集,并且在发育中斑马鱼基因组中发现了数百种细胞类型和功能元件,但是对于胚胎发育过程中,决定细胞类型功能的染色质可及性缺乏详细且深入的研究。 2024年7月8日,来自清华大学的孟安明团队与蓝勋团队合作,在Nature Cell Biology上发表一篇Mapping the chromatin accessibility landscape of zebrafish embryogenesis at single-cell resolution by SPATAC-seq的研究文章,文中介绍了一种基于分裂池(split-pool)连接的高通量检测单细胞染色质可及性的测序方法(SPATAC-seq),作者将SPATAC-seq应用于斑马鱼胚胎,分析了不同发育阶段中超过80万个单细胞核的染色质可及性,通过绘制的染色质可及性图谱,确定了604种细胞状态并推断发育关系,识别了约96万候选顺式调节元件 (cCREs) ,进一步发现了发育特异性cCREs和定义不同细胞身份的转录因子。总而言之,SPATAC-seq为探索斑马鱼胚胎发育中决定细胞身份的调控机制提供全面且有价值的资源。 接下来,带大家解析这篇文章:
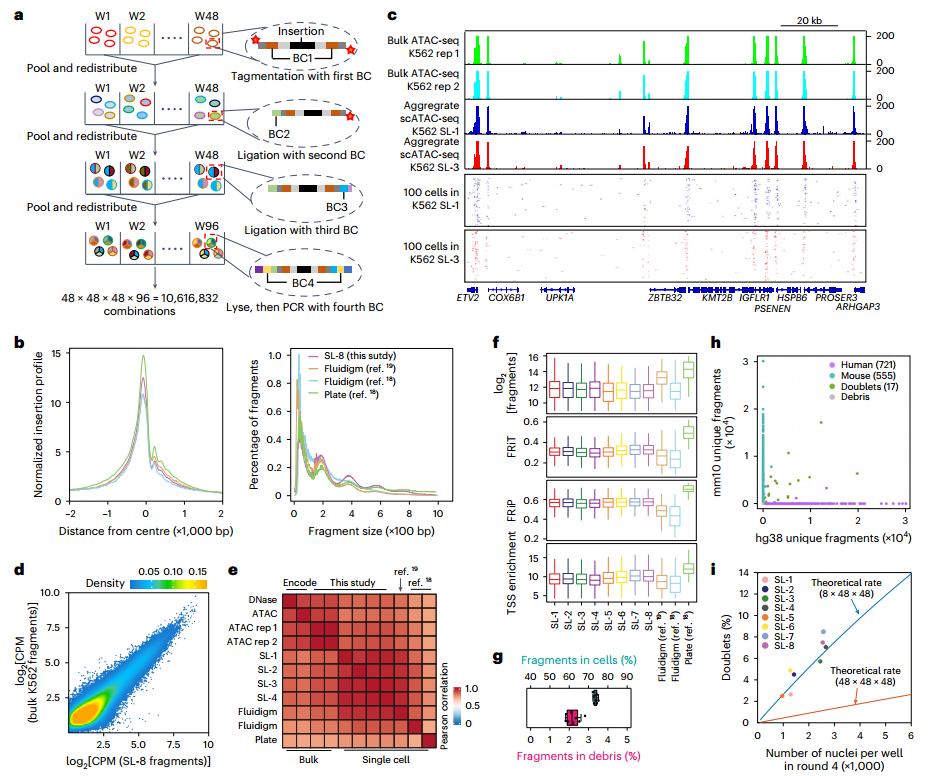
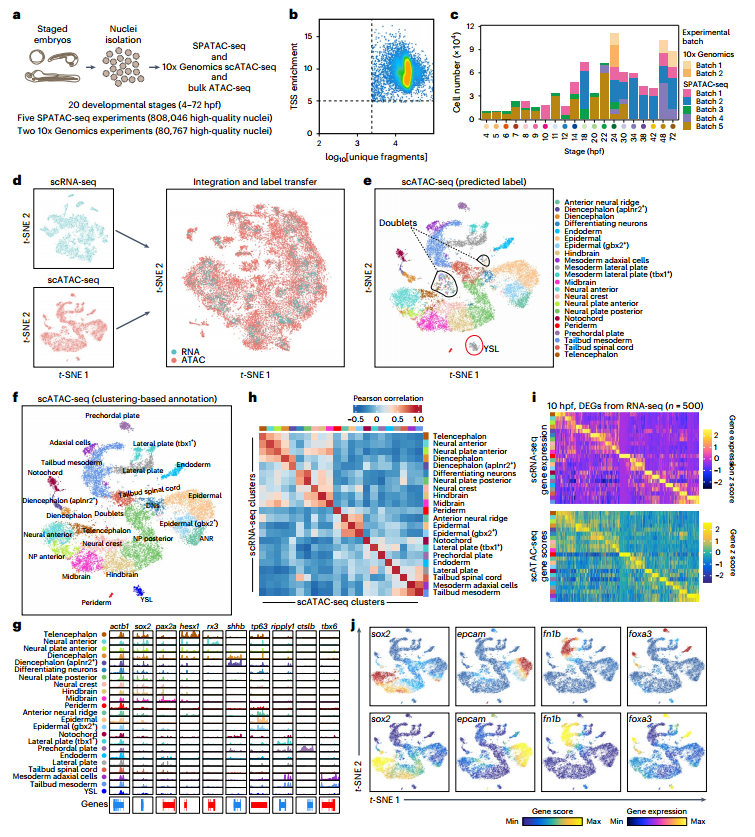
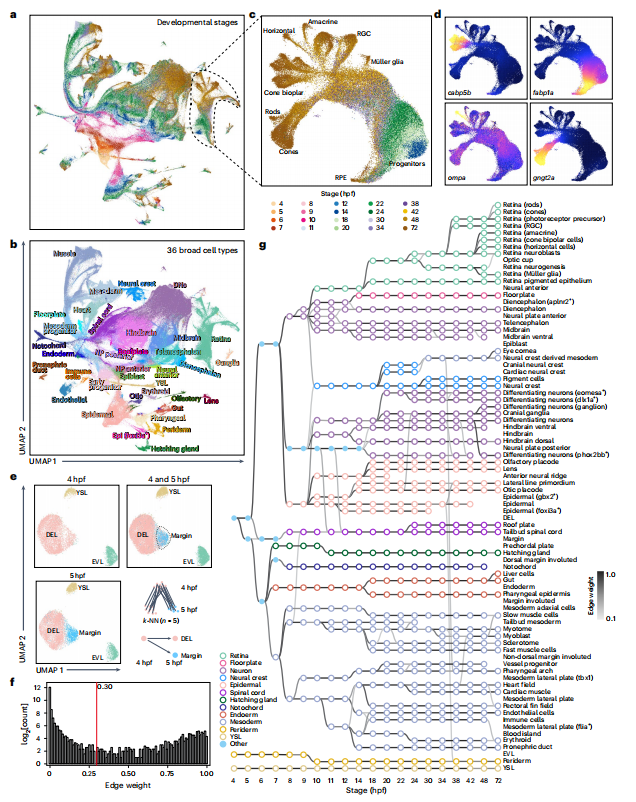
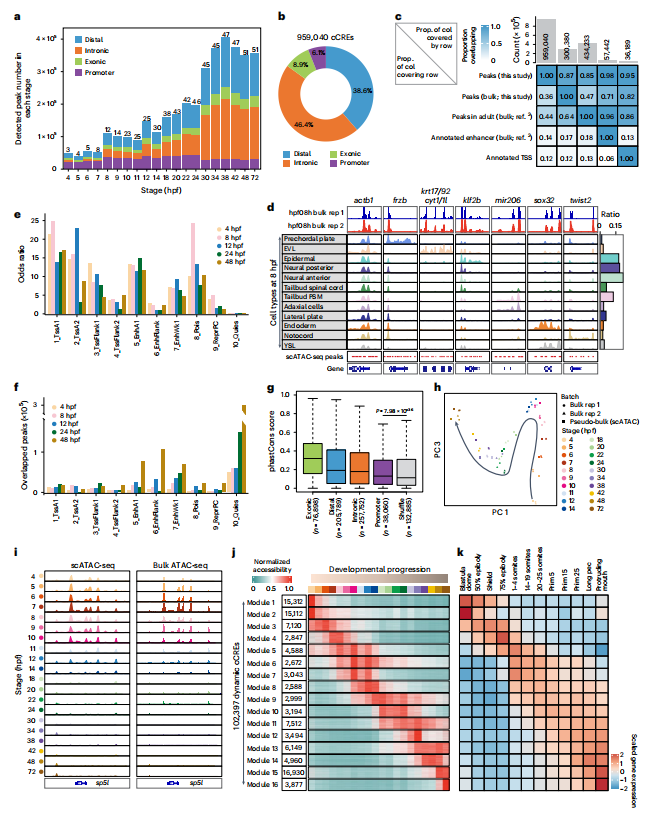
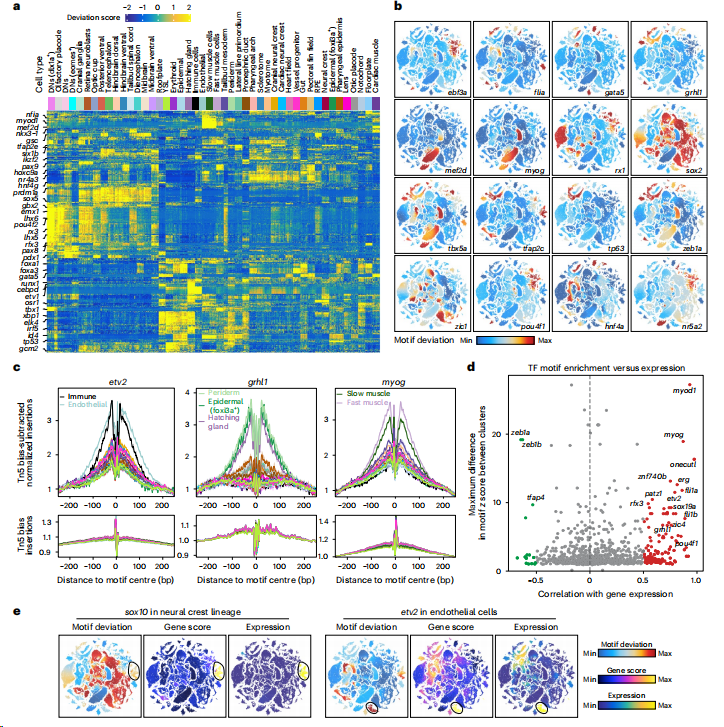
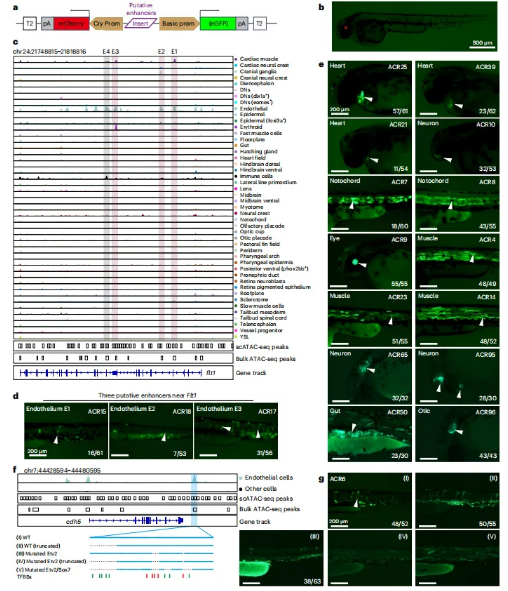
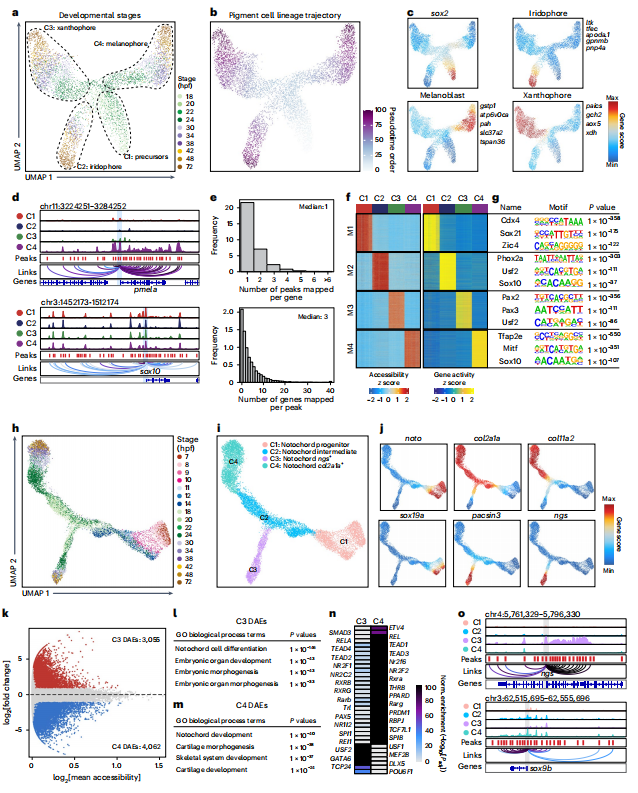
技术原理 SPATAC-seq是通过四轮组合索引对单细胞核染色质片段进行原位标记的测序方法,将斑马鱼胚胎抽核后利用0.5%甲醛固定后,进行四轮标记(图1a)。首先将固定后的细胞核置于48个含有不同Tn5转座酶的PCR孔中进行转座反应,其中Tn5转座酶接头不仅包含不同的Barcode,而且在5’端进行磷酸化修饰。收集48孔细胞核并随机重新分配,依次加入第二、第三轮的48孔板,PCR孔中不同Barcode通过T4连接酶分别连接至两端磷酸化位点,进行两轮标记,从而产生483个独特的Barcode组合。再次收集48孔细胞核并重新分配至96孔板中,加入i5、i7 index进行PCR,引入第四轮标签,建库后上机测序。四轮标记后可产生的Barcode理论上可分析上百万细胞,并且可以通过增加每一轮Barcode数量来增加细胞通量。 图1 SPATAC-seq原理与验证 SPATAC-seq验证 为验证SPATAC-seq的保真度,作者将人K562和小鼠Hepa细胞混合后进行实验,结果表明SPATAC-seq信号在转录起始区域(TSS)显示强富集,片段分布显示典型的核小体相位模式(图1b),与之前研究结果一致(图1c-e)。与现有scATAC-seq技术对比发现,SPATAC-seq在独特片段数量、TSS富集分数、有效Barcode等指标上表现出相似的性能(图1f,g)。最后,作者分析时发现双胞率仅为2.6%,与理论值高度相似(图1h,i)。 总而言之,SPATAC-seq与现有技术相比具有更高的细胞通量、更低的双胞率和更低的成本,是一种强大而可靠的分析染色质可及性的方法。 斑马鱼胚胎发育不同阶段的单细胞染色质可及性与细胞类型分析 为了全面表征斑马鱼胚胎发育过程中基因组可及性区域,作者利用SPATAC-seq分析了整个胚胎在4-72 hpf的20个发育阶段的染色质可及性(图2a),获得了808,046个细胞的高质量染色质可及性谱(图2b,c)。作为对比,作者选择10x Genomics的scATAC-seq试剂盒分析24,48和72 hpf的80,767个细胞的染色质可及性(图2a)。作者通过已发表scRNA-seq数据和细胞类型注释预测scATAC -seq细胞类型(图2d),在10 hpf下识别出23种不同的细胞类型(图2e,f),通过人工检查典型标记基因的染色质可及性进一步确认了细胞身份(图2g),scRNA-seq和scATAC-seq的细胞类型特异性标记的基因表达模式显示出高度一致性(图2h-j)。 作者在20个发育阶段中将所有细胞分为604种细胞状态,注释了82种细胞类型,同时发现SPATAC-seq与10x scATAC-seq细胞丰度高度相关,证明了SPATAC-seq在分析斑马鱼胚胎方面的高保真度,是理解发育时间内动态细胞组成的复杂性的重要工具。 图2 斑马鱼发育的单细胞染色质图谱和细胞类型的整合分析注释 斑马鱼胚胎发生轨迹的重建 作者整合了来自不同实验批次和技术平台的888,813个细胞绘制UMAP,并根据发育阶段进行着色,结果发现随着发育时间的增加,细胞多样性也随之增加(图3a),鉴定36种主要的细胞类型(图3b),并且发现了某些持续性细胞类型经历了渐进式分化(如视网膜细胞,图3c,d)。为了清晰地显示斑马鱼胚胎发育过程中不同细胞系的分化途径,作者生成了包含603个节点和635条边的有向无环图(图3f、g),可以通过从不同分支中分离细胞,从而剖析每个谱系细胞分化的基因调控程序。 图3 UMAP可视化显示了斑马鱼胚胎发育期间细胞类型变化及染色质可及性图谱。 斑马鱼胚胎发育过程中cCREs图谱构建与顺式调控动力学 为表征斑马鱼胚胎基因调控程序,作者在20个发育阶段中鉴定了CREs。作者对信号峰进行富集分析,绘制了斑马鱼胚胎发育过程中959,040个cCREs的综合图谱(占斑马鱼基因组的35.7%),其中,46.4%和38.6%的CRE分别位于内含子区和远端基因间区,表明所鉴定的CRE大多位于远端元件(图4a,b)。与以往研究对比发现,SPATAC-seq可以检测更罕见的细胞类型峰值(图4c,d),在识别斑马鱼基因组中更微妙的调控元件方面具有优势。与静止状态相比,这些cCREs在活跃的启动子和增强子区域显著富集,且它们的序列保守性高于随机基因组区域(图4e,f),进一步证实了它们在基因调控中的潜在作用。PCA分析显示斑马鱼胚胎的轨迹分布与发育时间的进展密切相关(图4h),同时发现,在胚胎水平上,不同发育阶段的染色质可及性不同(图4i)。为了系统地评估斑马鱼胚胎发生过程中染色质可及性的时间动态,作者确定了102,397个与发育相关的动态cCREs,将其分为16个模块(图4j),为了验证这些动态cCREs的基因调控作用,作者利用已发表RNA-seq数据计算每个模块中每个峰最近的基因在12个发育阶段的平均表达量(图4k),结果表明其表现出与图4j所示的cCREs相似的动态模式。 图4 斑马鱼发育过程中cCRE图谱的鉴定与表征 细胞类型特异性转录因子的鉴定 为了推断转录因子基序的活性,作者对24 hpf斑马鱼胚胎的46种细胞类型的转录因子活性进行聚类和偏倚校正,得到了揭示基序可及性的细胞类型或谱系特异性模式(图5a),并识别了细胞身份的关键调节因子(图5b),通过全基因组转录因子足迹分析进一步揭示了关键谱系定义转录因子的激活(图5c)。作者将同源基序活性与相应转录因子的基因表达结合起来,预测细胞类型特异性调节因子,以24hpf为例,作者对46种主要细胞类型的所有转录因子进行了分析,确定了115个假定的激活因子和16个假定的抑制因子(图5d),并且能够发现在特定细胞类型的特定阶段发现转录特定转录因子的基因(图5e)。 总而言之,以上结果强调了转录因子活性是细胞类型定义的重要特征之一。 图5 鉴定每种细胞类型的潜在主调控因子 假定的细胞类型特异性增强元件的体内验证 为验证细胞类型特异性调节元件是否在体内作为假定的器官或组织特异性增强子元件起作用,作者选择基于绿色荧光蛋白(GFP)的斑马鱼胚胎进行实验(图6a,b),测试了40个细胞类型特异性基因中的100个染色质可及性区域,其中65%显示出特异性的增强(eGFP)表达(图6c-e)。接下来作者通过干扰cdh5基因附近增强子的基序结构,测定同源基序结构的扰动对增强子报告活性的影响,结果发现去除特定转录因子结合位点可以在很大程度上影响增强子的活性,甚至使增强子失去活性(图f,g),表明这些增强子在细胞类型特异性基因表达调控中发挥重要作用。 图6 在体内验证假定的细胞类型特异性增强子元件 色素和脊索细胞分化过程中的调节活性 作者以色素细胞和脊索细胞为例,详细描述了分化过程。作者将色素细胞谱系分为四个不同的亚群(图7a-c),并根据先前开发方法确定与色素细胞分化相关cCREs(图7d),并确定cCRE-基因链接,这些链接代表了潜在的增强基因相互作用(图7e),根据cCRE可及性和基因评分的共变可以明显区分四个不同的细胞亚群(图7f),通过对cCRE-基因中cCREs进行基序富集,发现了与亚群特异性调控程序相关的转录因子(图7g)。 与色素细胞类似,脊索细胞随时间分成两个不同的分支(图7h),将其分为四种类型(图7i),C1和C2分别代表前体细胞和中间细胞,几乎完全来自于7-20 hpf;C4位于一个分支的末端,在许多软骨特有的基因中显示出高可及性,代表晚期鞘细胞;C3为空泡细胞,在ngs和pacsin3中特异可及(图7j)。作者鉴定7,117个差异可及cCREs (图7k),富集分析显示显示脊索细胞分化和胚胎器官发育等生物过程在C3和C4的DAEs中均富集(图7l),但在与软骨相关的生物过程则在C4中富集(图7m);作者通过基序富集分析推断出参与脊索细胞特化的潜在转录调控因子(图7n),最终确定在脊索细胞分化中起关键作用的基因调控网络(图7o)。 图7 色素细胞和脊索细胞分化的基因调控程序的表征 结 论 综上所述,作者介绍了一种规模化、低成本和高通量的基于组合索引的scATAC-seq方法,不仅性能与已发表方法相当,而且兼容Illumina测序。作者利用SPATAC-seq绘制了斑马鱼胚胎发育过程染色质可及性图谱,通过ZEPA数据集研究驱动细胞谱系指定过程的cCREs和转录因子描述定义细胞身份的潜在主调控因子,为深入探索生物发育过程中基因调控机制提供了新视角。作者提出,在未来将把SPATAC-seq与单细胞蛋白技术相结合,进一步验证不同发育阶段中斑马鱼胚胎cCREs的调节作用。