
2024-09-06

土壤是生物多样性最高的单一生境。据估计,地球上可能59±15%的物种栖息在土壤中,从结构最简单的微生物到最复杂的哺乳动物[1]。土壤生物多样性推动了重要的生态过程,包括分解、养分循环、碳封存和植物群落动态。有研究指出,目前地球可能正在进入第六次物种大灭绝。在 20 世纪,仅土地利用变化的影响就使地球丧失了近 2.3 ± 1.7% 的物种。如果假定地球的物种多样性为约 900 万种,则丧失了约 20 万种物种[2]。因此,了解土壤生物多样性的动态变化,对土壤生物多样性进行监测和分析至关重要。eDNA(environmental DNA)技术是一项有效、便捷的土壤生物多样性监测手段,近年来逐渐受到科研工作者的重视。eDNA研究中,所选基因引物和生境、关注类群的适配度如何十分重要。下面分享一些近两年的eDNA佳作,看看土壤环境中大家都在用哪些基因和引物,关注哪些生物类群吧。 2023年,李志鹏等人在Global Ecology and Biogeography期刊上发表eDNA研究,分析了中国亚热带和温带区域不同用地类型土壤中的后生动物和寄生虫(顶复门)的多样性格局,揭示了土地利用变化对寄生虫多样性及其与宿主联系的影响及机制。2024年,李志鹏等人在Global Change Biology期刊上发表eDNA研究[3],全面调查了中国亚热带和温带区域13个城市中不同土地利用(森林、城郊农田、居民区和公园)下的土壤,揭示了土壤原生生物及其猎物(细菌、真菌)和宿主(中大型动物)的空间分布格局。文章利用18S rRNA基因V4区、16S rRNA基因V4V5区、真菌内转录间隔区(ITS1)分别探究真核生物、原核生物和真菌类群。2023年,姚海凤等人在Science of The Total Environment期刊上发表eDNA研究,分析了中国厦门城市和城郊不同公园植被类型中细菌、真菌、原生生物、线虫、中/大型土壤动物的生物多样性,调查了城市化程度(城市与城郊)和植被类型(草坪、灌木-草坪、乔木-草坪和乔木-灌木混合物)对公园中土壤生物多样性的影响。
eDNA技术也可用于检测稀有、濒危的物种。2023年,Mynhardt等人在Biodiversity and Conservation期刊上发表eDNA研究,发现消失87年的罕见物种德温顿金鼹鼠重现南非[4]。 此外,通过eDNA技术,可以对不同营养级的生物类群进行研究,分析多类群生物之间相互作用的复杂网络。2024年,Calderón-Sanou等人在Soil Biology and Biochemistry期刊上发表eDNA研究,对法国阿尔卑斯山广泛的土壤生物多样性进行监测[5]。2024年,柳旭等人在PNAS期刊上发表eDNA研究,在全球 20 个地区的土壤调查中探索了涉及细菌、原生生物、真菌和无脊椎动物的多营养土壤生物之间的生态网络,证明了土壤生物之间广泛存在的正向关联,以及它们在维持全球土壤生物多样性复杂结构中的关键作用[6]。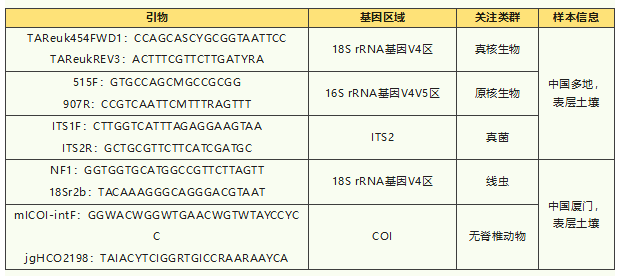


土壤eDNA送样指南
非根际土壤(bulk soil) (1)采样前应对采样工具及样本袋或取样管等进行灭菌处理,或用待采土壤样本擦拭; (2)根据实验设计选择具有代表性的土壤; (3)建议运用点状取样法中常用的五点取样法采集土壤样本,即先确定对角线的中点 作为中心抽样点,再在对角线上选择与中心点距离相等的点进行采样;或者运用等距取样法,由抽样的比率决定距离或间隔,如果老师想多采集一些生物学重复样本,建议用 此方法; (4)采样时需注意先去除表面浮土,同时每个采样点的取土深度及采样量应均匀一致,一般根据需求可挖去距地表 5-20 cm 深度的土壤,且土样上层与下层的比例要相同; (5)取完样后,去除可见杂质(可过2 mm筛进行去除); (6)野外采集的土样低温运输至实验室,分装完毕后,液氮速冻,-80℃冰箱保存。 根际土壤(rhizosphere soil) 根际是一个很窄的范围,并不是直接从根周围取的土样,严格的说是附着在根周围的土壤, 通常是根周围2mm直径范围的土壤。取样的时候是直接将植物连根拔起,抖掉根周围松散的土壤,剩下的是根际土。 (1)带土挖出整株植物的根系,挖出时尽可能多带些土; (2)轻轻抖去根系上大块的土壤,剪取约 15 g 的带土根系,置于装有灭菌的 0.86% NaCl 溶液 (或无菌 PBS 缓冲液)的 25 ml 离心管中,并快速带回实验室; (3)将上述离心管放在冰中 30 min,每隔 5 min 取出摇匀 1 次; (4)去掉植株根系,4 000 g、4 ℃低温离心 30 min,然后去除上清液; (5)将所得土壤沉淀物保存在无菌 EP 管中,于-20 ℃备用,尽快提取总 DNA;如果条件不允 许,可将样品保存在-80℃冰箱。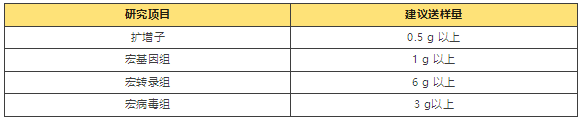
1.Anthony, M. A., Bender, S. F. & Van Der Heijden, M. G. A. Enumerating soil biodiversity. Proc. Natl. Acad. Sci. U.S.A. 120, e2304663120 (2023). 2.Pereira, H. M. et al. Global trends and scenarios for terrestrial biodiversity and ecosystem services from 1900 to 2050. Science 384, 458–465 (2024). 3.Li, Z. et al. Land use decouples parasite–metazoan host biodiversity associations in soils across subtropical and temperate zones in China. Global Ecol Biogeogr 32, 2164–2176 (2023). Li, Z. et al. Colonization ability and uniformity of resources and environmental factors determine biological homogenization of soil protists in human land‐use systems. Global Change Biology 30, e17411 (2024). Yao, H. et al. Degree of urbanization and vegetation type shape soil biodiversity in city parks. Science of The Total Environment 899, 166437 (2023). 4.Mynhardt, S. et al. Environmental DNA from soil reveals the presence of a “lost” Afrotherian species. Biodivers Conserv (2023) doi:10.1007/s10531-023-02728-2. 5.Calderón-Sanou, I. et al. Mountain soil multitrophic networks shaped by the interplay between habitat and pedoclimatic conditions. Soil Biology and Biochemistry 190, 109282 (2024). 6.Liu, X. et al. Positive associations fuel soil biodiversity and ecological networks worldwide. Proc. Natl. Acad. Sci. U.S.A. 121, e2308769121 (2024).