2024-09-25
翻译后修饰 (PTM) 属于表观遗传学领域,它不会改变 DNA 序列,但可以改变基因表达和功能水平,这为许多生命现象提供了新的解释。组蛋白是真核生物体细胞染色质中的一种碱性蛋白质,主要分成5类,分别称为H1、H2A、H2B、H3和H4。
组蛋白可以通过多种方式进行修饰,最常见的包括甲基化、乙酰化、磷酸化和泛素化。随着高灵敏度质谱技术的发展,近几十年来发现了各种新的组蛋白酰化标志物,如丙二酰化、巴豆酰化、丙酰化、丁酰化和乳酸化等,这些组蛋白氨基末端的多样化修饰扩展了遗传密码,共同构成“组蛋白密码”。
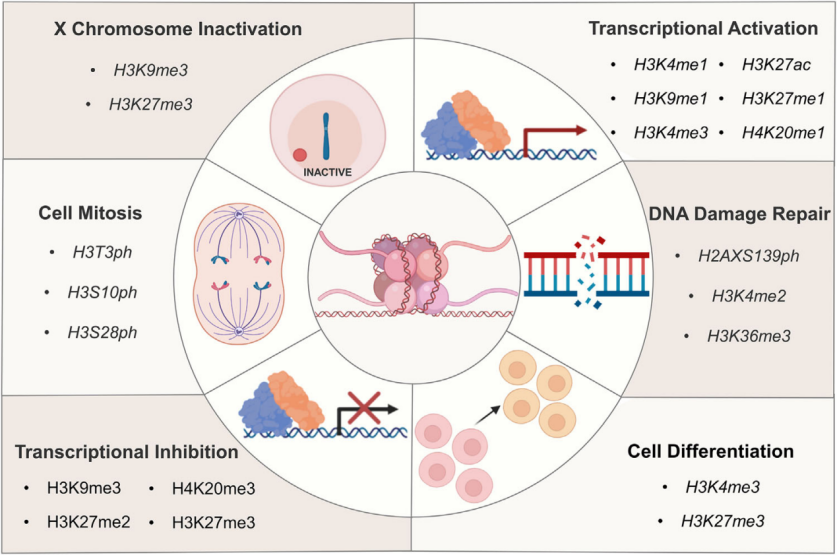
组蛋白氨基末端的翻译后修饰 组蛋白修饰的组合与生物学功能之间的关系可以用作重要的表观遗传标记。同一组蛋白残基的甲基化和去甲基化、乙酰化和去乙酰化、磷酸化和去磷酸化,甚至不同组蛋白残基之间的甲基化和乙酰化相互配合或拮抗,形成一个复杂的网络。因此,透彻了解组蛋白PTM在细胞生命活动中的作用对于预防和治疗人类疾病非常重要。接下来小派将对几种常见组蛋白修饰进行介绍。 组蛋白修饰介导的多种生物学效应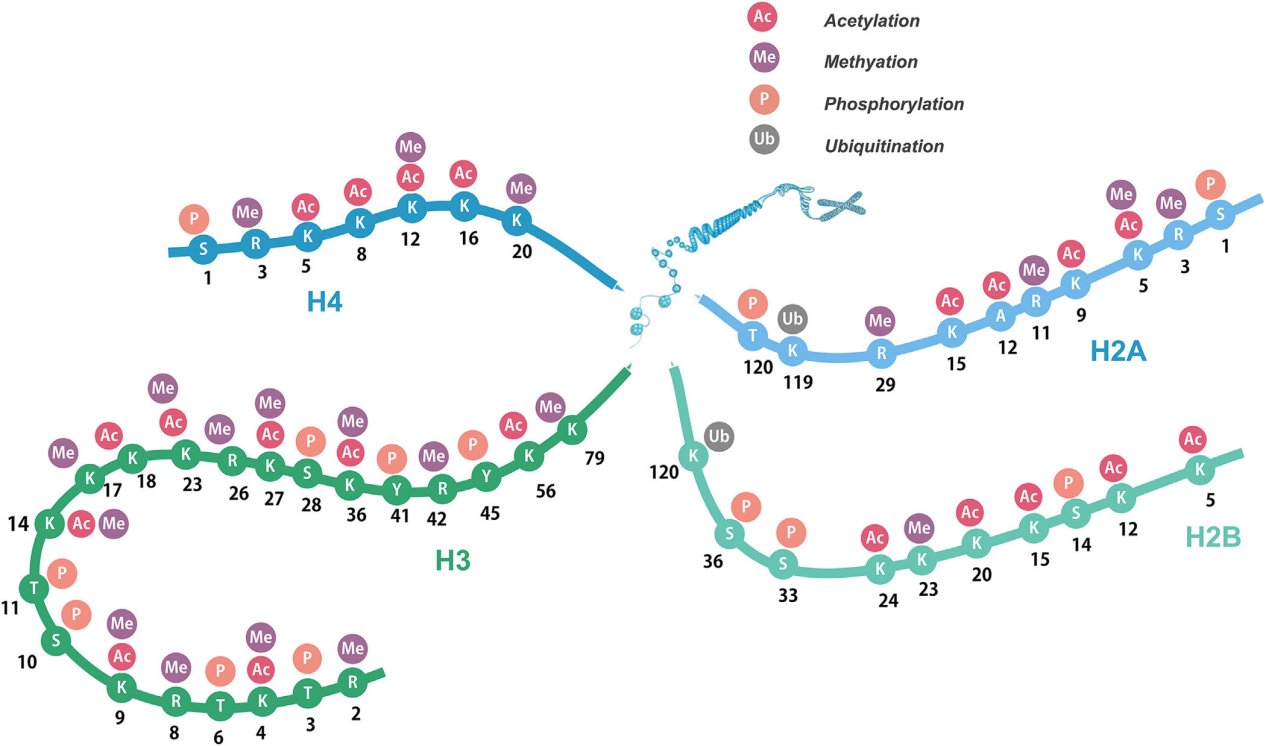
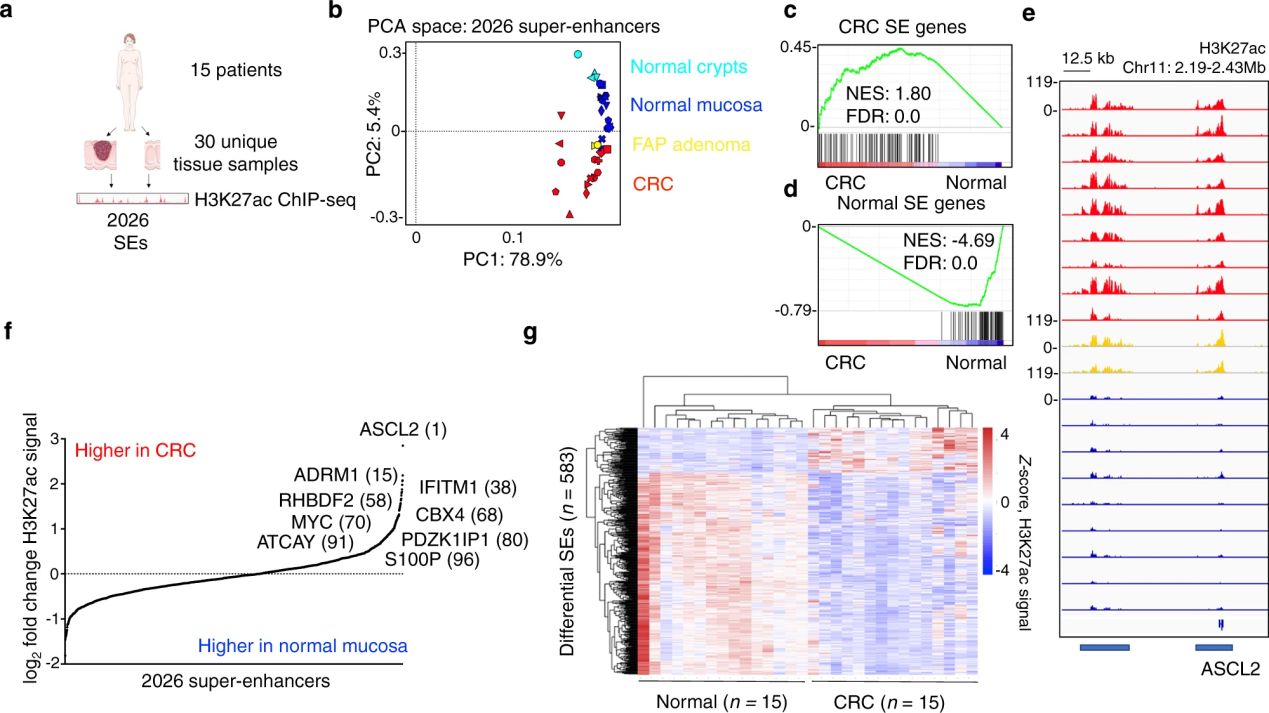
组蛋白乙酰化修饰 乙酰化修饰是进化上保守且可逆的 PTM,是最早描述的组蛋白修饰之一。其中赖氨酸乙酰化修饰由 Allfrey 等人 (1964) 首次在组蛋白中发现,并以深刻的洞察力提出了这种蛋白质修饰在转录调控中的调节作用。 乙酰化修饰广泛存在于原核和真核生物中。组蛋白乙酰转移酶(HAT)调节组蛋白乙酰化,由乙酰转移酶将乙酰辅酶 A 上的乙酰基转移到组蛋白的赖氨酸残基上,使赖氨酸残基上的电荷中和。这导致组蛋白与 DNA 的结合松散,染色质结构的松散有利于转录因子或转录调节蛋白结合到 DNA 上,进而促进了基因的转录和表达,因此,组蛋白乙酰化通常被认为是一种活性组蛋白标记。目前已鉴定出 13 个 HAT,由三个主要家族组成:CBP/p300、GCN5 和 MYST 乙酰转移酶家族。而组蛋白去乙酰化酶(HDAC)主要功能是从组蛋白和非组蛋白的赖氨酸残基中催化去除乙酰基官能团,从而维持动态平衡。HDAC 使组蛋白去乙酰化,强烈附着在带负电荷的 DNA 上,使染色质密集卷积,并抑制基因转录。人类基因组包含 18 个 HDAC,分为Rpd3 样蛋白、Hda1 样蛋白、Sir2样蛋白和HDAC11。 组蛋白乙酰化水平受 HDAC和 HAT的共同调节 相关研究 H3K27ac主要出现在组蛋白H3的第27位赖氨酸残基上。起通常与基因的转录激活状态相关,特别是在增强子和启动子区域。H3K27ac的富集通常标志着活跃的增强子,这些增强子是调控基因表达的重要元件,能够影响基因的时空特异性表达。 题目:A local tumor microenvironment acquired super-enhancer induces an oncogenic driver in colorectal carcinoma 局部肿瘤微环境获得性超增强子诱导结直肠癌的致癌驱动因素 发表期刊:Nature Communications 本文探讨了在结直肠癌(CRC)中,肿瘤微环境如何通过表观遗传学修饰影响基因表达,特别是通过H3K27ac修饰。研究发现肿瘤微环境中的炎症因子能够诱导特定的超级增强子(SEs),特别是PDZK1IP1基因的超级增强子,从而促进肿瘤生长。研究表明,PDZK1IP1通过戊糖磷酸途径增强了CRC细胞的还原能力,提高了肿瘤细胞在氧化条件下的生长效率。此外,研究发现肿瘤微环境中的炎症信号通过NF-κB和STAT3转录因子直接调控PDZK1IP1超级增强子的活性。这些发现强调了表观基因组分析在原始肿瘤样本中的重要性,并为开发针对肿瘤微环境的治疗策略提供了新的视角。 结直肠癌患者中反复失调的超级增强子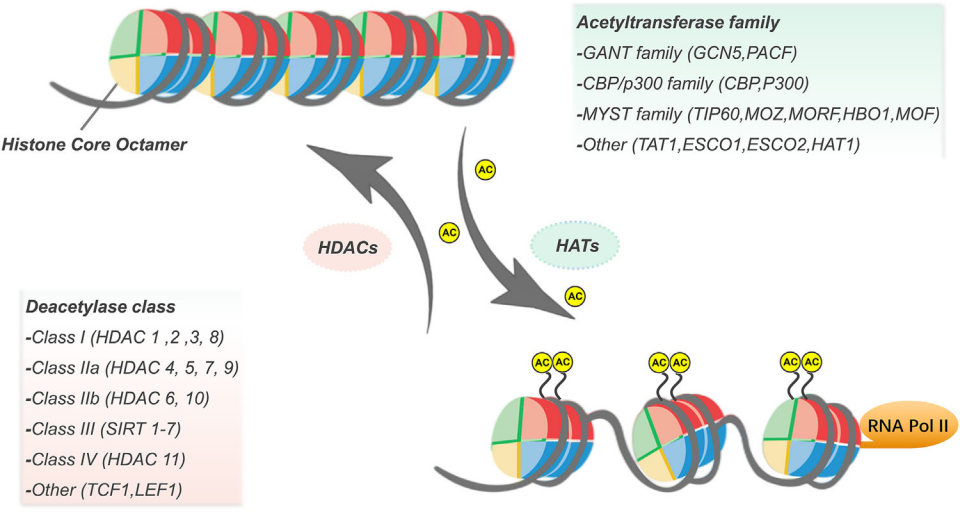

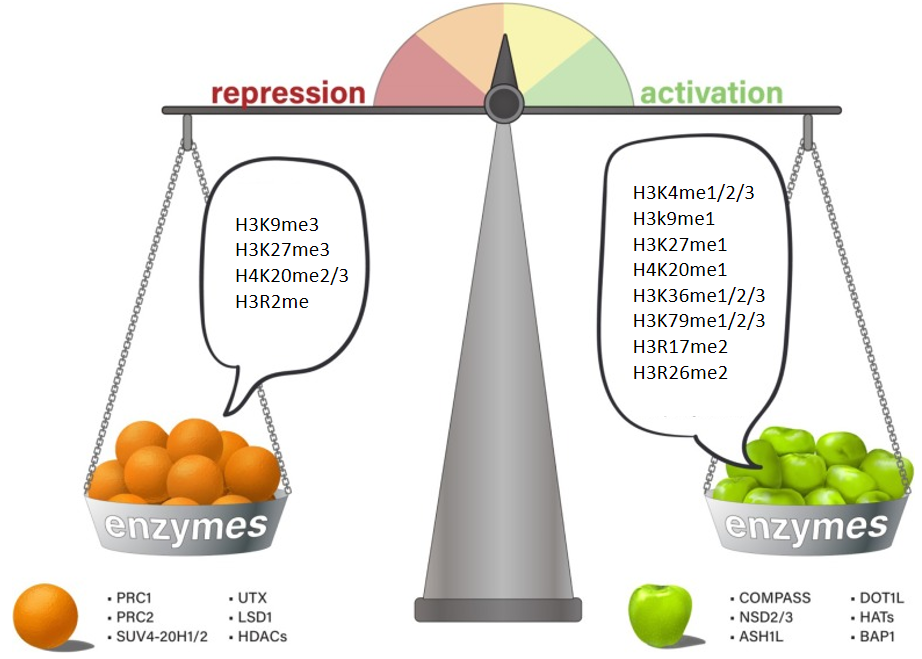
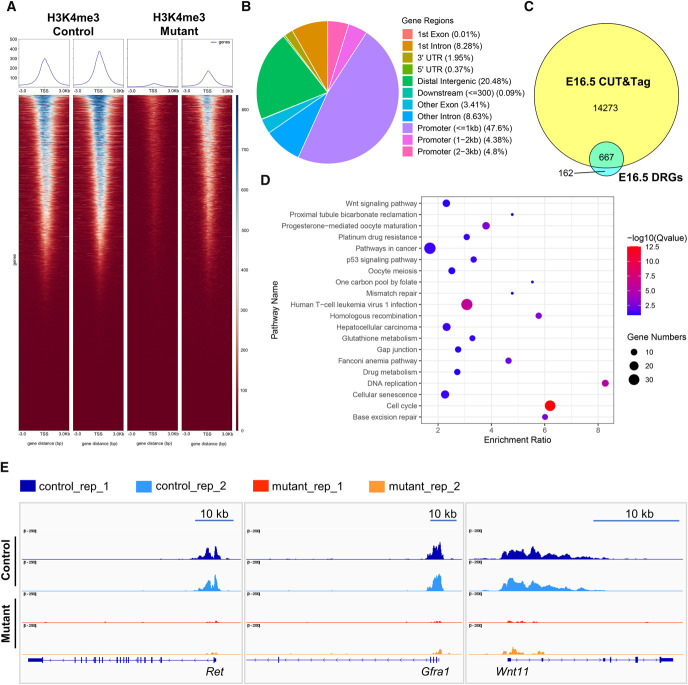
组蛋白甲基化修饰 1999年首次描述了组蛋白甲基化与DNA转录之间的联系,但与组蛋白乙酰化不同的是,随后很快就鉴定出了特定的组蛋白甲基转移酶(HMTs)。组蛋白甲基化是主要的转录后修饰之一,其发生在H3和H4组蛋白N端赖氨酸或精氨酸残基上。目前已鉴定出 24 个甲基化位点,其中 17 个位于赖氨酸,7 个位于精氨酸。这些组蛋白甲基化修饰通过募集不同的转录因子来调节基因表达,而不直接改变染色质结构。 甲基化主要由 HMT 催化,可分为组蛋白赖氨酸甲基转移酶(KMT )和组蛋白精氨酸甲基转移酶(PRMT)。赖氨酸残基可以发生单、双或三甲基化修饰,而精氨酸残基则只发生单和不对称双甲基化修饰,其中组蛋白H3K4和H3K9是常见的两个修饰位点。而组蛋白去甲基化酶,大致分为赖氨酸特异性去甲基化酶LSD和Jumonji C(JMJC)两个家族。LSD1是第一个报道的组蛋白赖氨酸去甲基化酶。它催化H3K4me1/2和H3K9me1/2 的去甲基化,特异性去除 H3K4中的单甲基和二甲基化修饰。而JMJC家族能去除赖氨酸三甲基化的修饰。 组蛋白甲基化招募不同的转录因子调控基因表达 组蛋白甲基化可参与染色质结构的维持与基因表达的沉默或激活。一般来说,精氨酸残基的甲基化能激活基因的表达,而赖氨酸甲基化根据不同的甲基化位点发挥转录激活或抑制的功能,如H3K4和H3K36位点发生的甲基化及H3K27的单甲基化能激活基因的转录,而H3K9、H3K79、H4K20位点的甲基化及H3K27的双甲基化和三甲基化能抑制靶基因的转录。H3K9me3、H3K27me3、H3K36me3、H4K20me3是胃癌、肝癌、乳腺癌、胰腺癌、卵巢癌和结肠癌等重要的肿瘤标志物。H3K9me2、H3K9me3和H3K27me3的表达模式与临床病理特征密切相关,可能是胃癌病人生存评价的独立危险因子。 组蛋白甲基化影响基因表达的沉默或激活 相关研究 H3K4me3是组蛋白H3第四位赖氨酸在甲基转移酶 (HMT) 催化下发生三甲基化。H3K4me3是最重要的甲基化修饰之一,真核生物中该修饰在转录起始位点普遍发生,通常在基因的启动子附近富集,并且与基因的转录相关,是表观遗传学一个标志,其水平可以反映出转录的程度,在基因的转录中有着重要的作用。 题目:ASH2L Controls Ureteric Bud Morphogenesis via Regulation of RET/GFRA1 Signaling Activity in a Mouse Model ASH2L通过调节RET/GFRA1信号活性控制小鼠模型中输尿管芽的形态发生 发表期刊:Journal of the American Society of Nephrology 本文发现ASH2L缺失可导致新生小鼠CAKUT样表型,主要涉及出生时肾发育不良。这些表型主要源于胚胎发育期UB发育衍生物的分支减少。转录组和CUT&Tag联合分析发现,UB特异性ASH2L敲除小鼠UB细胞中RET/GFRA1信号通路核心组分如Ret、Gfra1、Wnt11等基因的表达显著减少,ASH2L缺失所导致的启动子区域H3K4me3修饰减少导致了RET/GFRA1信号通路相关基因表达减少。该研究结果不仅有助于从表观遗传修饰的角度更好地理解胚胎肾脏发生、发育的精细调控机制,同时也揭示了表观遗传修饰改变与CAKUT发病机制内在联系,为CAKUT的预防和治疗提供了靶点研究思路。 UB谱系中H3K4me3的全基因组图谱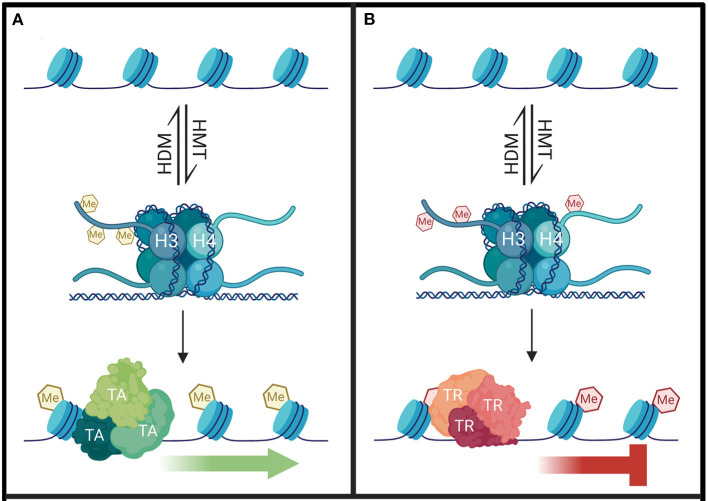

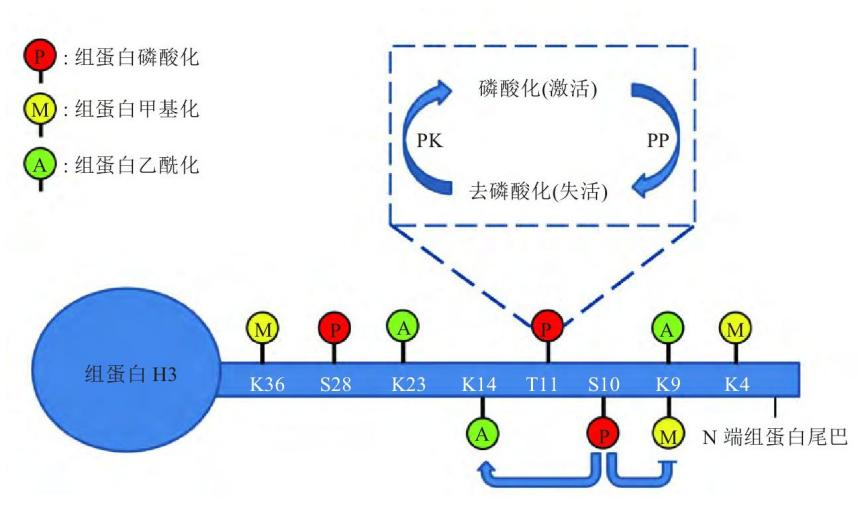
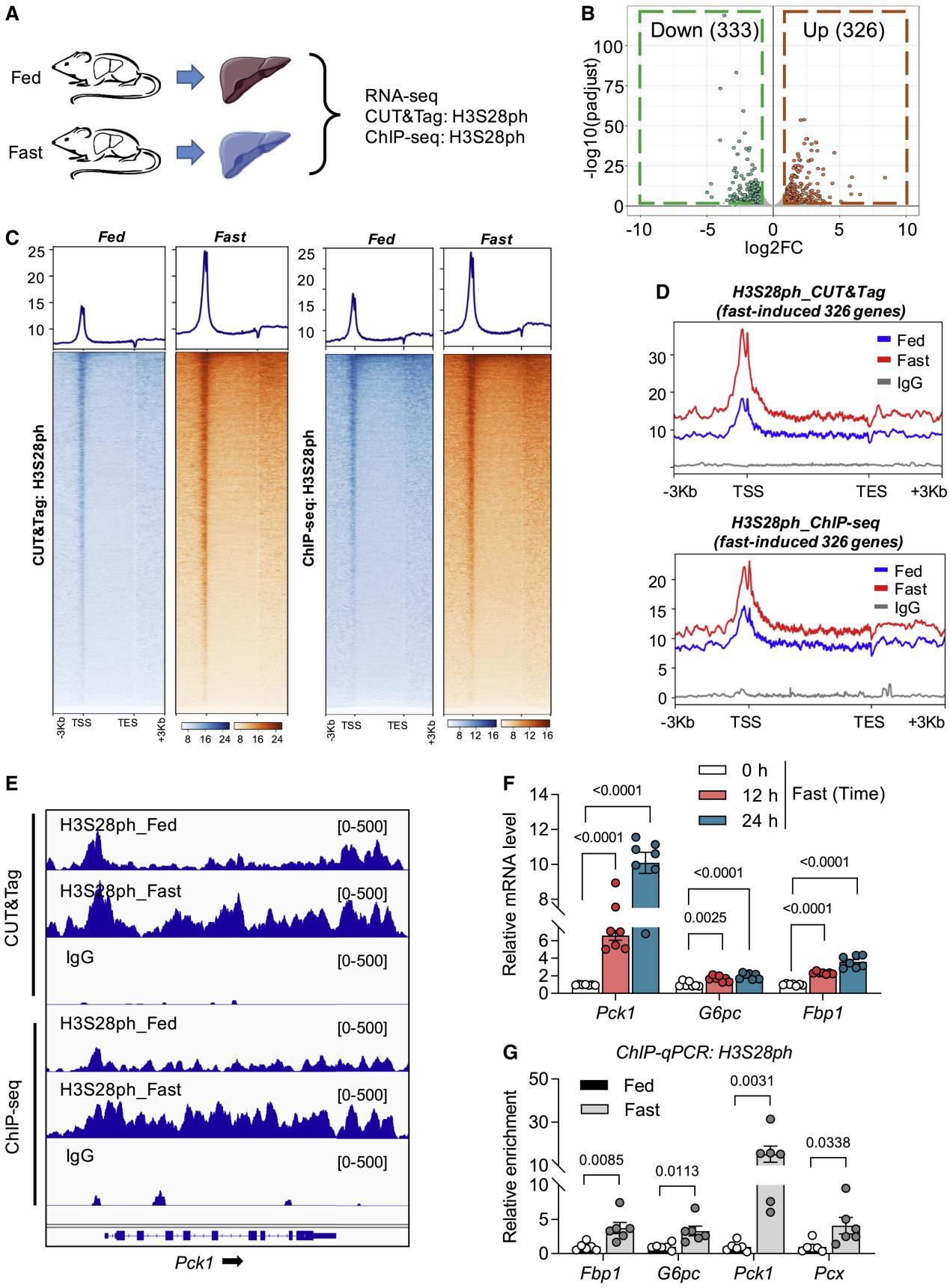
组蛋白磷酸化修饰 磷酸化是最常见的翻译后修饰之一,组蛋白磷酸化修饰大部分发生在丝氨酸(S)和苏氨酸(T)残基上,也可发生在酪氨酸(Y)残基上。组蛋白磷酸化与组蛋白去磷酸化过程处于动态平衡,由蛋白激酶(PK)和蛋白磷酸酶(PP) 共同调控,蛋白激酶催化组蛋白尾端的氨基酸残基与磷酸基团结合,与基因转录活化有关;而蛋白磷酸酶的作用则相反,脱去氨基酸残基上的磷酸基团,抑制基因转录的起始与表达。组蛋白磷酸化修饰影响染色体的结构和功能有两种可能的机制:第一,磷酸基团的负电荷中和了组蛋白所携带的正电荷,这造成组蛋白与DNA之间的亲和力下降;第二,磷酸化修饰有利于组蛋白与蛋白质的识别,促进蛋白质复合物的招募或者相互作用 组蛋白磷酸化参与广泛的细胞过程,包括转录调控、细胞凋亡、细胞周期进程、DNA 修复、染色体浓缩和发育基因调控。并且组蛋白不同位点翻译后修饰存在交互作用,如 H3S10磷酸化促进H3K14乙酰化的同时可抑制H3K9甲基化,更利于基因转录的调控。 组蛋白H3共价修饰示意图 相关研究 组蛋白H3的第28位丝氨酸磷酸化(H3S28ph)是一种重要的表观遗传修饰。它在细胞对环境变化的响应中起着关键作用,特别是在肝脏糖异生的调控中。此外,H3S28ph在细胞周期调控中也起着重要作用,在有丝分裂期间,H3S28ph与染色体的凝聚和分离密切相关;在转录调控方面,H3S28ph与其他组蛋白修饰存在交互作用。 题目:Histone phosphorylation integrates the hepatic glucagon-PKA-CREB gluconeogenesis program in response to fasting 禁食状态下组蛋白磷酸化在整合肝脏胰高血糖素-PKA-CREB糖异生程序 发表期刊:Molecular Cell 胰高血糖素-PKA信号通常被认为通过CREB转录因子控制肝糖异生。本文发现了该信号在直接刺激组蛋白磷酸化以调节小鼠糖异生基因。在空腹状态下,CREB 将激活的 PKA 募集到糖异生基因附近的区域,其中 PKA 磷酸化组蛋白H3丝氨酸28 (H3S28ph)被14-3-3ζ识别,促进RNA聚合酶II的募集和糖异生基因的转录刺激。在进食状态下,在糖异生基因附近发现了更多的 PP2A,它们通过去磷酸化 H3S28ph 和抑制转录来抵消 PKA。当肝脏PKA或CREB耗尽时,磷酸化H3S28的异位表达有效地恢复了糖异生基因的表达。这些结果共同强调了胰高血糖素-PKA-CREB-H3S28ph 级联反应调节糖异生,其中激素信号被传递到染色质,以实现快速有效的糖异生基因激活。 组蛋白H3S28磷酸化位于快速诱导基因附近