
2024-12-02

前言
说起表观遗传学,大家可能一知半解,遗传?有点熟悉,表观?又有点陌生。那什么是表观遗传学呢?我们从生活中常见的几个现象说起。
1、橘生淮南则为橘,橘生淮北则为枳,叶徒相似,其实味不同。所以然者何?水土异也。同一种水果在不同的产地生长,其叶和味都有了很大的改变。
2、同卵双胞胎有着相同的基因组,但他们长大成人后性格、外貌、喜好、言行都有很大的差异。
这些都是基因型相同而表型不同的现象。那在不改变DNA序列的情况下,基因表达如何受到调控以及这些变化是如何被继承给下一代的呢?这就是表观遗传学研究的内容。表观遗传学技术覆盖DNA、RNA、Chromatin三大方向,包括DNA甲基化、组蛋白修饰、RNA调控、染色质可及性分析等等。
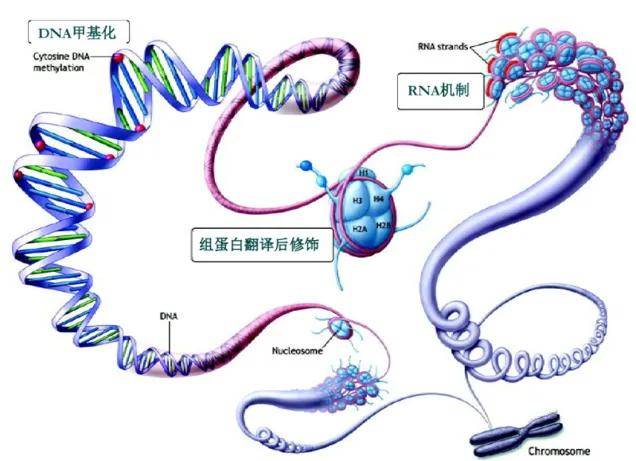
由于很多老师总是混淆表观遗传的一些测序技术,进而影响到方案设计以及成果转化。因此我们对表观组学常用到的测序技术以及常见问答进行了整理,希望能对您有所帮助。下面就跟随小派一起来看下吧!
测序技术
1、ATAC-seq(Assay for Transposase-Accessible Chromatin using sequencing)是利用Tn5转座酶探究可接近性染色质高通量测序技术。该技术通过Tn5转座酶对特定时空下开放的核染色质区域进行切割,获得在该时空下基因组中所有活跃转录的调控序列。因此,ATAC-seq得到的是全基因组尺度上处于开放状态的染色质区域,并且通过分析染色质开放区域的motif,可以获得潜在的活跃转录因子及其靶基因。
一次过瘾,你想要的ATAC这里都有
2、ChIP-seq(Chromatin Immunoprecipitation Sequencing)全称染色质免疫共沉淀测序,是一种用于研究蛋白质与DNA相互作用的技术,能够精确地识别特定蛋白质,例如转录因子和组蛋白,在基因组中的结合位点。
CHIP-Seq的10问10答
3、CUT&Tag(Cleavage Under Targets and Tagmentation)是一种新型DNA-蛋白互作研究技术,适用于无ChIP级别抗体的蛋白研究。相比于传统的ChIP-seq技术,该技术无需交联、超声打断、末端抹平和接头连接等操作,因此具有省时高效、所需的样品量少、背景信号低和可重复性好等优点,CUT&Tag反应在细胞内进行,创新性地使用了ProteinA/G-Tn5融合蛋白来结合目的蛋白上的抗体,并特异性切割目的蛋白结合的DNA,最终通过结合NGS实现靶蛋白结合位点的精准定位。
CUT&Tag-蛋白质-DNA互作关系研究的新工具
4、RIP-seq(RNA immunoprecipitation and high-throughput sequencing)是一种将RNA免疫共沉淀(RIP)与高通量测序技术(NGS)相结合的技术,通过免疫沉淀目标蛋白来捕获蛋白体内结合的RNA。主要用于解析细胞内RNA与蛋白质(特别是RNA结合蛋白,RBP)之间的相互作用。
【派森诺项目文章】IF39.3 !RIP-seq科研利器-为扩张型心肌病等相关研究“加油助威”
5、MeRIP-seq(methylated RNA immunoprecipitation with next generation sequencing) 甲基化RNA免疫沉淀结合高通量测序,是在转录组层面研究细胞内mRNA以及lncRNA的甲基化即m6A(腺嘌呤N6为甲基化)定位的技术。其基本原理是利用m6A特异性抗体,对细胞内的带有m6A修饰的RNA片段进行免疫沉淀。结合高通量测序技术对沉淀下来的RNA片段进行深度测序,在整个转录组层面揭示RNA甲基化这种转录后RNA表观修饰的整体水平和定位等信息。
RNA甲基化修饰m6A检测热门技术—MeRIP-seq
6、WGBS(Whole Genome Bisulfite Sequencing,全基因组甲基化测序)其采用重亚硫酸氢盐处理基因组DNA使未甲基化修饰的胞嘧啶C转化为尿嘧啶U,通过对处理后的DNA进行全基因组重测序,并与参考基因组进行比对,从基因组水平实现单碱基分辨率的、高精确度甲基化水平分析。
【派森诺项目文章】全基因组甲基化助力胰腺癌治疗分子机制研究
常见问答
ATAC
1、Q:什么是染色质可接近性?为什么要研究开放染色质?
A: 染色质可接近性(Chromatin Accessibility)是指基因组中特定区域的DNA在特定条件下变得易于被转录因子和其他调控元件接近的特性。在真核生物细胞核内,DNA与组蛋白结合形成核小体,核小体再进一步折叠压缩形成染色质。当染色质结构打开时,DNA暴露出来,这部分区域被称为开放染色质区域(Open Chromation region,OCR),允许调控因子结合DNA,从而进行转录调控。开放染色质区域通常富含活性或潜在活性的基因启动子及增强子序列,这些区域更容易被转录因子识别并结合,从而影响相关基因的表达水平。此外,许多遗传性疾病的发生与发展都与特定基因表达模式的变化有关。通过分析开放染色质状态,可以帮助科学家们理解某些疾病的分子机制,并为开发新的治疗方法提供线索。总之,通过对开放染色质的研究,不仅能够深入探讨基因表达调控的基本原理,还可能为医学、生物学等多个领域带来重要进展。
2、Q:ATAC-seq与ChIP-seq异同点?
A:ATAC-Seq,是在全基因组范围内检测染色质的开放区域,可以得到蛋白质的潜在结合位点,不依赖于抗体,一般用于不知道特定的转录因子。ChIP-Seq是实验前明确有一个感兴趣的转录因子,利用目标转录因子特异性抗体富集蛋白质及其结合的DNA片段,从而验证蛋白质与DNA的相互作用关系。
3、Q:ATAC-seq能回答什么科学问题?
A:找调控某一生物学过程的关键转录因子;找哪个转录因子调控了我感兴趣的基因;找我感兴趣的转录因子调控的靶基因。如果没有ChIP级别的抗体,无法做ChIP-seq,就可以用 ATAC-seq 找转录因子的靶基因。
4、Q:motif分析是什么意思?
A:转录因子等与DNA序列的结合位点具有一定的的特征,这些特征具有保守性,这些具有保守性的特征序列叫做motif,motif分析就是解析目标区域具有保守性的DNA结合位点,结果中会有序列logo图片,不同高度的字母表示每个位置上核苷酸的频率,较高的字母表示该位置上某种核苷酸出现的频率较高,较低的字母表示频率较低。
5、Q:ATAC项目结果中酶切片段的长度分布峰怎么看?
A:酶切片段是指ATAC-seq实验中经转座酶Tn5切割后获得的DNA片段。酶切片段的长度分布可以反映Tn5 酶用量是否合适。单个核小体是由146bp的DNA缠绕在组蛋白上构成的,适量的Tn5酶只会切割裸露的DNA,而不会切割被核小体保护的DNA,因此正常实验,酶切片段长度分布图中会出现2-3个峰,分别为短片段峰:小于150 bp,对应于非常开放的染色质区域;主峰:大约在150-200 bp,对应于单核小体;次峰:大约在300-400bp,对应于双核小体。
ChIP-seq&CUT&Tag
1、Q:chip-seq、cut&tag分析中中peak是什么意思?
A:ChIP-seq(cut&tag)分析中peak指的是特定蛋白质(如转录因子或组蛋白修饰)在基因组上富集的区域,这些蛋白质富集的区域被称为peak,这些peak可能位于基因的启动子区域或者基因区域。
2、Q:chip-seq、cut&tag等分析中IP组和Input组分别代表什么,后续是如何分析的?
A:IP组是指通过特定抗体捕获目标蛋白及其结合的DNA片段后得到的样本,Input组是指在进行免疫沉淀之前,从细胞或组织中提取的总DNA样本,分析时input组通常作为背景对照,用于校正和归一化IP组的数据。
3、Q:在Peaks_Annotation的文件夹中Locus和Nearest分别代表什么?
A:Peak_annotation的结果是对peak落点基因的分析,peak在基因上的落点主要分为两种,一种是在基因的上下游区域,另一种是落在基因区域,Locus文件夹中是对peak落点在基因区域的基因注释表格,Nearest文件夹是peak落点在基因的启动子区域的基因注释表格。
4、Q:如何查看结果中某个peak对应基因的reads覆盖峰图?
A:可以使用IGV软件打开Map文件中各样本的bam文件,通过bam文件查看某个基因具体位置reads的覆盖情况,IGV软件使用教程:干货!IGV快速入门手册
5、Q:chip-seq分析中基因附近信号分布图怎么看?
A:信号分布图包含信号谱图和热图两部分,信号谱图横坐标是基因的位置信息,TSS代表基因的转录起始位点,TES代表转录的终止位点,-3.0代表转录起始位点上游 3kb ,3.0kb代表转录终止位点下游3kb,纵坐标代表的是在基因的不同位点peak的平均信号值,整个信号谱图代表的是peak在转录起始位点TSS上游 3kb 到转录终止位点下游3kb 范围内每个位点上所有基因的平均信号值;下方是对应的信号热图,每一行代表每一个基因,横坐标代表的同样是转录起始位点TSS上游 3kb 到转录终止位点下游3kb 范围内每个位点上对应的信号值,颜色越偏黄,则表明附近有较强的信号峰出现,该区域的reads覆盖越多。
RIP-seq
1、Q:RIP 试验需要注意些什么?
A:1.防止 RNA与蛋白非特异性结合;2.避免RNA 蛋白质结合被破坏;3.避免外源RNase污染;4.抑制内源RNase的活性;5.避免RNA结合蛋白的降解;6.选择适合做RIP的抗体,一定要是IP级别的抗体;7.细胞的选择,对于需要做转染实验的需要选择转染效率较高的、RNA 在细胞中本底表达量要相对较高的。
2、Q:一般RIPSeq项目高质量uniq序列占比是多少为正常?CallPeak数目是否和高质量uniq序列相关。callpeak所用参数是多少呢?
A:常规项目20M以上的高质量uniq序列是一个比较理想的结果。高质量uniq序列的多少是会影响callpeak的结果的,我们默认的callpeak参数是qvalue < 0.05。
3、Q:RIP和ChIP基因信号分布图的区别是什么?
A:RIP-seq研究RNA结合蛋白(RBPs)与RNA的相互作用。ChIP-seq研究DNA结合蛋白(如转录因子、组蛋白修饰等)与DNA的相互作用。RIP-seq 的信号分布图主要关注RNA的不同区域(5' UTR、CDS、3' UTR、内含子),揭示RNA结合蛋白如何调控RNA的代谢过程。其中5' UTR信号富集可能表明RNA结合蛋白参与翻译起始调控;编码区 (CDS)信号富集可能表明RNA结合蛋白参与mRNA的剪接、转运、稳定性和翻译调控;3' UTR信号富集可能表明RNA结合蛋白参与mRNA的稳定性、降解和翻译抑制;内含子信号富集可能表明RNA结合蛋白参与剪接调控。ChIP-seq 的信号分布图主要关注DNA的不同区域(启动子、增强子、基因体、终止子),揭示DNA结合蛋白如何调控基因表达。其中启动子区域信号富集可能表明转录因子参与转录起始调控;增强子区域信号富集可能表明转录因子参与远端调控;基因体信号富集可能表明组蛋白修饰或其他调控蛋白参与转录延伸或其他调控过程;终止子区域信号富集可能表明某些蛋白参与转录终止。
MeRIP-seq
1、Q:RNA甲基化分析时,peak对应的reads数是否也跟这个RNA的表达水平有关,如果这个基因mRNA表达量本来就少,那是否甲基化peak也少呢?
A:这两者有一定的关联,但不是绝对的,一个基因的mRNA表达水平高并不直接意味着其甲基化修饰的程度高,有些低表达的基因,可能由于其低表达所导致检测到的甲基化的peak会少一些,RNA甲基化更多地是一种调控机制,参与调控特定RNA,如稳定性、定位和翻译效率,而不单纯由mRNA的丰度决定,在某些情况下,低表达的基因可能由于其RNA被甲基化并降解而导致mRNA水平低,但这并不是因为原始的转录水平低导致甲基化水平低。
2、Q:为什么MeRIP-seq需要同时测Input和IP样本?
A:MeRIP-seq实验设置中Input和IP组成一对样品。实验环节IP样品用m6A抗体特异性富集甲基化修饰的RNA片段,而Input仅仅是片段化的RNA则作为对照消减背景噪音,在建库、测序平行开展。结合峰检测分析需整合两个样本的数据,并利用Input数据排除本底表达水平高或非特异性结合的peaks,以提高call peak的准确性。
WGBS
1、Q:什么是5mC DNA甲基化?
A:DNA甲基化主要发生在胞嘧啶和鸟嘌呤(CpG)二核苷酸位点,即5'-CG-3'序列上。在DNA甲基转移酶(DNA methyltransferases,DNMTs)的催化作用下,将甲基供体S-腺苷-L甲硫氨酸(SAM)上的一个甲基转移至胞嘧啶的5位碳原子处(C5),从而形成5-甲基胞嘧啶(5mC)。
2、Q:甲基化水平是如何计算的?
A:计算方法为:支持某位点(区域)甲基化C的reads条数除以覆盖该位点(区域)的总的reads条数,即为某位点(区域)甲基化水平,计算公式为 ML=mC/(mC+umC)。例如:位点A覆盖的reads数为10,支持mC(mC)的reads数为2,不支持mC(umC)的reads数为8,该位点的甲基化水平为2/(2+8)=0.2。
3、Q:Bisulfite处理后C-T转化率正常范围是多少?
A:用文库中测到的Lambda噬菌体DNA序列中CHH位点的检测结果,在分析前中对甲基化位点水平的可靠性进行评估,一般Bisulfite转换效率在99%以上,我们则认为计算得到的C位点的甲基化水平是可靠的。
4、Q:DNA甲基化分析中差异甲基化结果diff.Methy和areaStat分别代表什么,怎么通过这两个值确认差异甲基化程度?
A:在Result\04_DMRs\DMR_result这个文件夹中包含每个比较组所有差异甲基化区域的结果,diff.Methy这一列代表两组之间的差异甲基化水平,这个值的绝对值越大,代表两组之间差异甲基化程度越高,areaStat代表差异甲基化显著性高低,这个值的绝对值越大,证明该差异甲基化显著性越高。