
2024-12-06
在现代生物学研究中,空间转录组测序技术犹如一把神奇的钥匙,为我们打开了深入探索细胞在组织内原位基因表达奥秘的大门。它突破了传统转录组测序仅能提供基因表达丰度信息的局限,解决了单细胞测序无法定位到空间原位信息的缺点,将基因表达数据与细胞的空间位置信息紧密结合,为我们揭示组织发育、疾病发生发展等复杂生物学过程提供了前所未有的视角。然而,面对空间转录组测序所产生的海量而复杂的数据,许多研究者往往感到困惑,不知从何下手进行分析。对此别担心,本文将为您介绍空间转录组测序数据一些常用的分析方法,让您打通空间转录组数据分析的任督二脉。
空间转录组的高级分析:
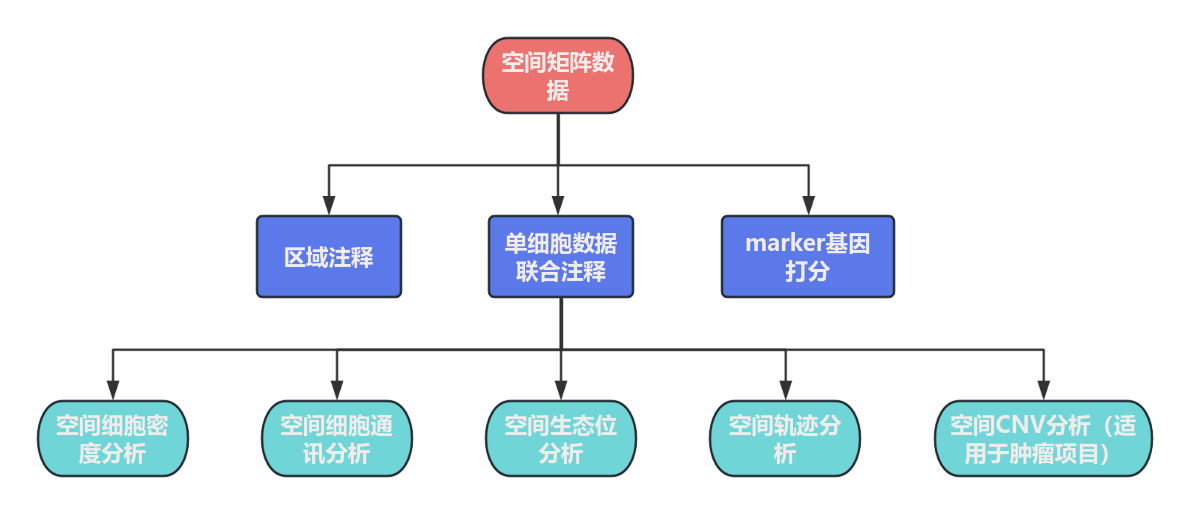
图1 空间转录组测序分析
1、空间转录组spot细胞类型或者区域注释
空间转录组 spot 注释是空间转录组分析中的一个关键步骤。在空间转录组技术中,组织被划分成许多小的区域(spots),这些 spots 包含了细胞和基因表达信息。对 spots 进行注释就是要确定每个 spot 的细胞类型、细胞状态或者所属的组织区域等信息,这对于理解组织的空间结构和细胞功能是非常重要的。
1.1、基于单细胞数据进行空转spot注释
由于当前空间转录组学方法尚无法在组织中生成深层单细胞分辨率的转录组图谱,因而整合单细胞与空间转录组数据展开分析就显得尤为关键,其将有力促进对细胞类型分布结构以及形成该结构的细胞间通讯潜在机制的深入理解。整合scRNA-seq和空间转录组数据有两种主要方法:去卷积(Deconvolution)和映射(Mapping)。去卷积旨在根据单细胞数据,从每个捕获点的mRNA转录物的混合物中分离出离散的细胞亚群;映射有两方面:将指定的基于scRNA的细胞亚型定位到高倍RNA成像(HPRI)图谱上的每个细胞和将每个scRNA-seq细胞定位到组织的特定生态位或区域。
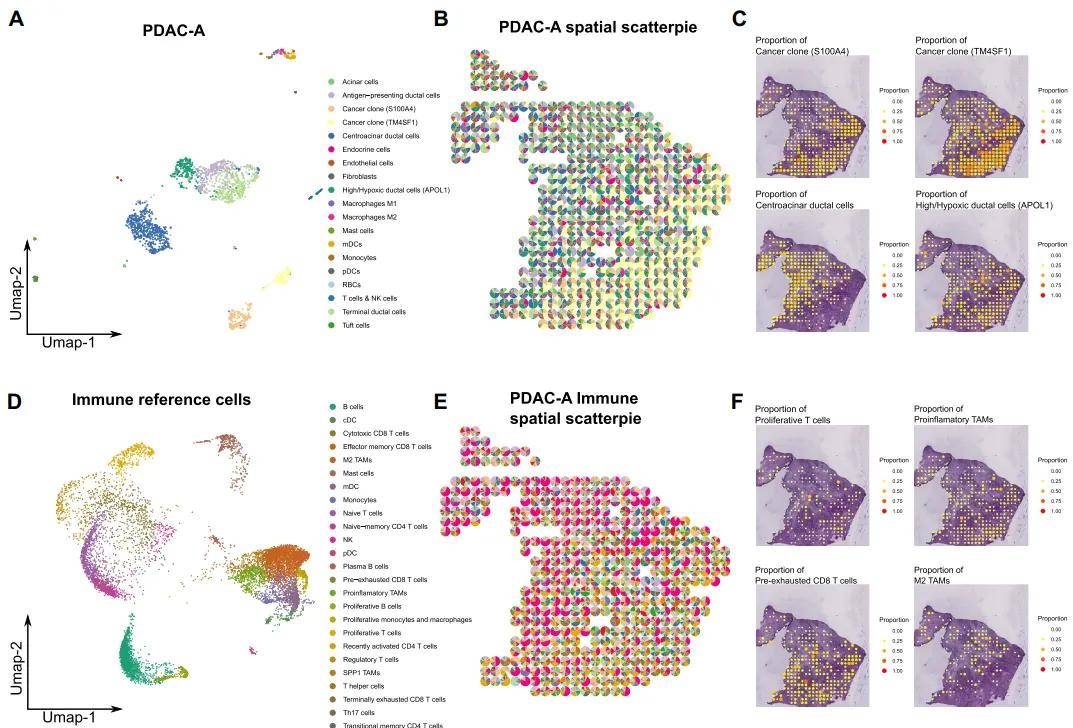
图2 SPOTlight注释空转[1]
1.2、基于已知标记基因的打分分析
首先需要利用已有的生物学知识,确定不同细胞类型或组织区域的标记基因,然后使用标记基因的基因集对空转spot聚类分群得到的cluster进行打分确定各个cluster的优势细胞类型。
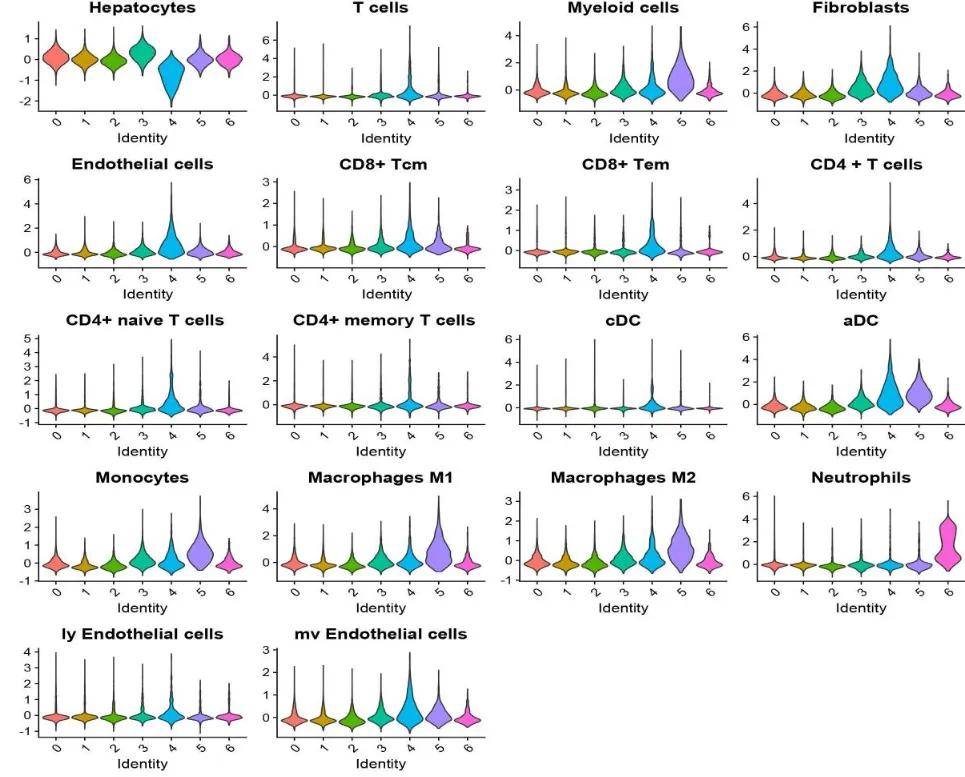
图3 空转cluster进行marker基因集打分分析[2]
1.3、基于形态学或病理学知识对空间区域注释
在空间转录组研究中,基于形态学与病理学领域的专业知识开展空间区域注释是一种行之有效的策略。通常,凭借病理学家丰富的经验以及对不同组织部位形态学特征的精准认知,能够为空间转录组数据赋予具有生物学意义的形态学注释信息。可精准定位细胞与组织区域分布、揭示疾病空间异质性、助力细胞间相互作用研究、挖掘生物标志物并确定诊断靶点,从而推动组织架构、疾病机制等多方面研究进展。
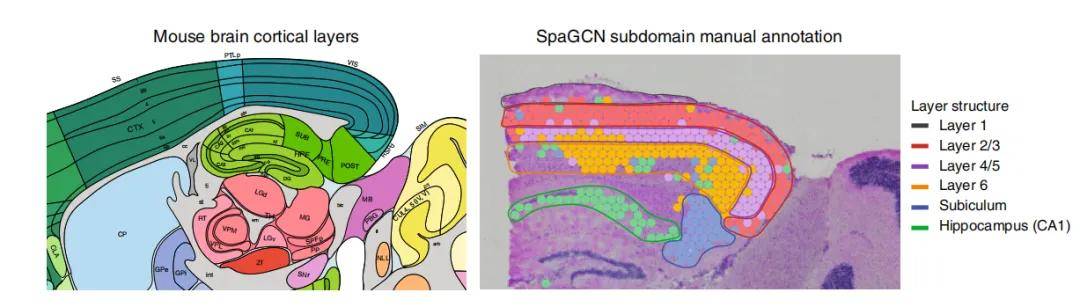
图4 空间形态学或病理学注释[3]
2、 空间细胞密度分析
在组织样本的微观世界里,其结构呈现高度的组织性与有序性。各类细胞类型依据特定的生物学规律,定位于相应的组织微环境中,而非呈随机分布态势。细胞类型在空间维度上的分布密度,实则为组织形态学有序性的一种直观量化表征。于疾病发生发展进程中,细胞空间位置的特异性改变,深刻反映了外界致病因素对组织内稳态的显著扰动与重塑作用,这种细胞空间分布格局的变化往往与疾病的病理生理机制紧密关联,成为深入探究疾病机制的关键切入点之一。
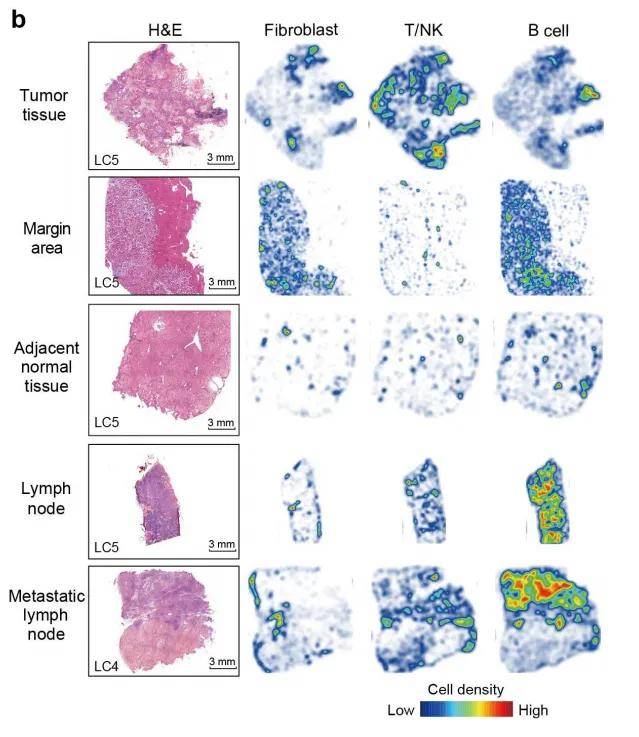
图5 空间细胞密度分析[4]
3、空间细胞通讯
相较于单细胞转录组的细胞间通讯分析,基于空间转录组的 spot 分析具备独特优势。在单细胞转录组的细胞通讯研究基础上,空间转录组的细胞通讯研究不仅能够达成对细胞通讯的全面剖析,还能充分利用空间转录组所蕴含的位置信息。结合组织学信息,其在病理学观察方面极具价值,可使细胞间通讯分析的效能得以充分彰显。
众多研究表明,细胞之间具有生物学意义的有效通讯往往局限于其周边约 200 微米的范围之内,这种空间临近性的通讯模式更精准地反映了真实的细胞间相互作用状态,对于深入理解组织微环境内细胞的协同运作机制以及相关生理病理过程具有极为关键的意义。
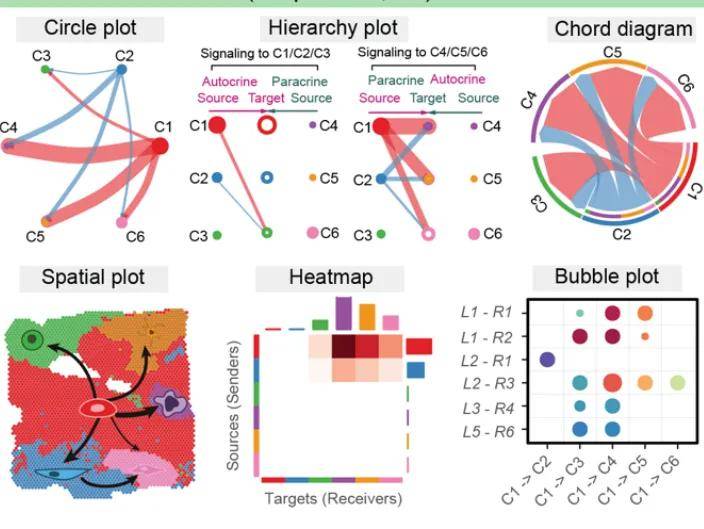
图6 空间通讯[5]
4、空间生态位
组织作为一个严密的组织,细胞类型之间有着密切的相互作用,在空间上的体现就是细胞类型的共定位关系,空间上经常出现在同一位置的细胞类型,会组成一个小的“unit”,行驶着特殊的生物学功能。
空间生态位并非指代某一特定的细胞类型,而是聚焦于细胞在组织内部的空间分布格局特征。无论是从分子层面还是细胞层面所进行的聚类分析结果,均指向对空间生态位的界定与描述。组织内的细胞分布呈现出高度的有序性,细胞间的空间位置关系能够精准地映射出细胞类型相互作用的频率与强度。借助对空间生态位中细胞类型的深入剖析,可以系统地解析细胞共定位现象及其相互依赖的程度与机制。不同的空间生态位具有其独特的细胞类型构成,而相似的细胞类型组合则暗示着共通的细胞结构特征。通过对不同条件下样本间细胞结构的比较分析,能够有效地甄别出由疾病引发的组织结构变异与重塑过程。此外,空间生态位的分析还深入涵盖了细胞类型之间在空间层面的相互依存关系,例如巨噬细胞与肿瘤细胞之间的交互作用,这种相互依赖关系构成了组织有序性的核心要素之一,并且在疾病的治疗策略开发与优化过程中具有极为关键的指导意义与潜在应用价值。
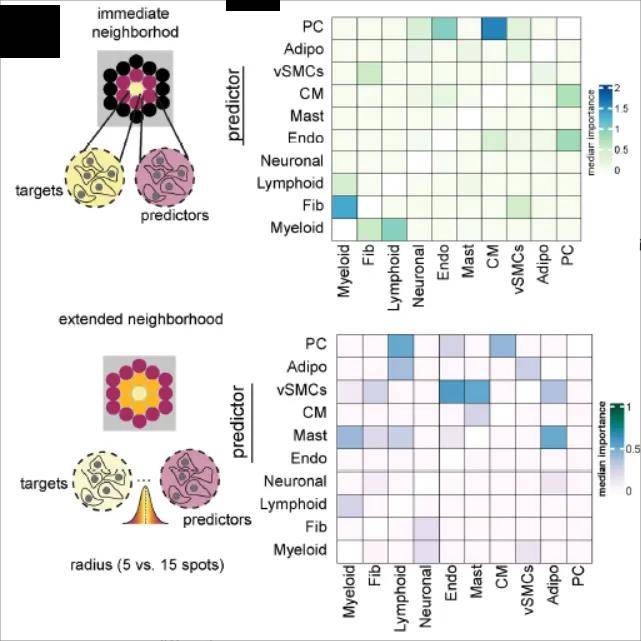
图7空间生态位分析[6]
5、空间轨迹分析
对于单细胞而言,轨迹分析反映了细胞类型之间的分化关系,但是对于空间转录组而言,轨迹代表了随着组织部位的变化,细胞类型发生的变化,体现了组织细胞类型的亲疏远近关系。通过剖析细胞的基因表达模式以及其所处的精确空间位置信息,有助于推断细胞在发育、分化、疾病进展等过程中的连续轨迹。
在组织发育研究里,能够清晰地呈现细胞从原始的多能状态逐步分化为各类成熟细胞类型时的迁移路径与基因表达演变,有助于揭示器官形成的奥秘。
在疾病研究方面,尤其是肿瘤学领域,空间轨迹分析可详细描绘肿瘤细胞的起源、增殖、侵袭和转移轨迹,使我们深入洞察肿瘤的发生发展机制,为精准诊断和靶向治疗提供关键依据。
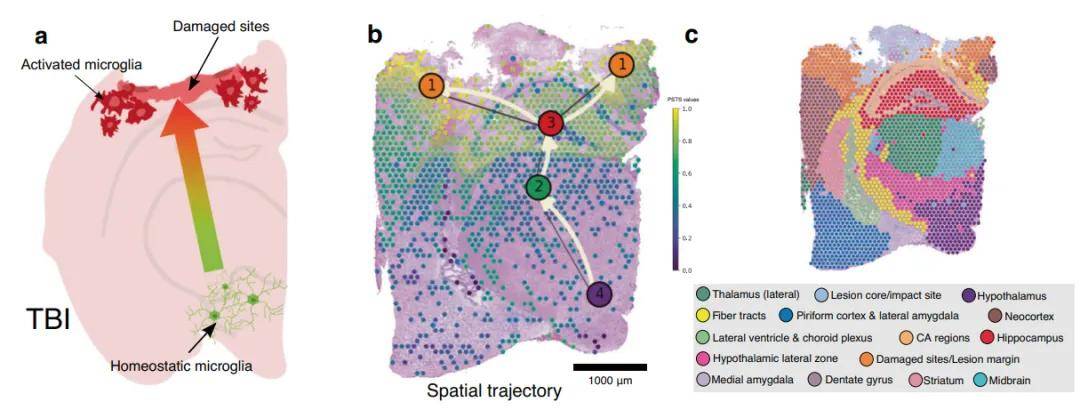
图8 空间轨迹分析[7]
6、空间CNV分析
CNV分析对于单细胞和空间而言都是重要的分析内容,我们不仅要知道CNV发生的事件,也要知道CNV发生的空间位置,尤其对于CNV事件的积累过程是怎样的。
空间 CNV 分析聚焦于拷贝数变异(CNA)在空间层面的特征与意义。CNA 作为恶性细胞的关键标志,像癌基因局灶性扩增或肿瘤抑制因子丢失,会促使治疗耐药与肿瘤复发。通过明确特定区域的 CNV 特征,可以更好地理解肿瘤细胞在空间上的增殖、迁移和侵袭模式,以及与周围微环境的相互作用关系。
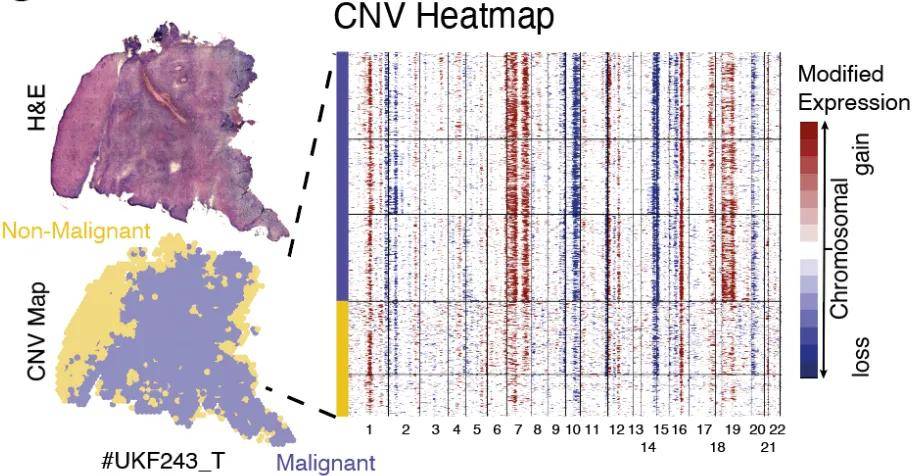
图9 空间CNV分析[8]
总 结
怎么样?读完此文,是否对空间转录组分析有了全新的感悟与思考?是否已然按捺不住内心的冲动,想要即刻投身于数据的探索之中?既然如此,切莫再犹豫徘徊,赶快踏上这充满惊喜与发现的快乐分析之旅,让数据在您的智慧与巧手下,展现出其蕴含的无限奥秘与价值,在空间转录组的科研海洋里乘风破浪,收获属于您的科研硕果。
参考文献:
[1]SPOTlight: seeded NMF regression to deconvolute spatial transcriptomics spots with single-cell transcriptomes. Nucleic Acids Res.doi: 10.1093/nar/gkab043.
[2] Spatial transcriptomics reveals a low extent of transcriptionally active hepatitis B virus integration in patients with HBsAg loss. Gut. doi: 10.1136/gutjnl-2023-330577.
[3]SpaGCN: Integrating gene expression, spatial location and histology to identify spatial domains and spatially variable genes by graph convolutional network. Nat Methods. doi: 10.1038/s41592-021-01255-8.
[4]Spatially-resolved transcriptomics analyses of invasive fronts in solid tumors.doi: https://doi.org/10.1101/2021.10.21.465135.
[5]CellChat for systematic analysis of cell-cell communication from single-cell and spatially resolved transcriptomics. doi: https://doi.org/10.1101/2023.11.05.565674.
[6]Identification of HSC/MPP expansion units in fetal liver by single-cell spatiotemporal transcriptomics.doi: 10.1038/s41422-021-00540-7.
[7]Robust mapping of spatiotemporal trajectories and cell-cell interactions in healthy and diseased tissues. Nat Commun. doi: 10.1038/s41467-023-43120-6.
[8]Spatiotemporal heterogeneity of glioblastoma is dictated by microenvironmental interference.