2025-01-07

随着 2024 年的落幕,回首这一年,可谓是蛋白组快速发展的一年。从医学领域对疾病发病机制的深度探寻,到农业范畴助力作物优良性状的挖掘,蛋白组学的身影无处不在,其广泛应用推动了科学研究的发展。
如今,2025年已悄然而至,新征程开启之际,蛋白组的研究依然火热。小派这里整理了十个高频问题,帮大家一起排排雷。
Q1.蛋白质组的研究技术有哪些?
目前蛋白组研究技术“百花齐放”,按照通俗易懂的研究目的主要可划分为以下几种:
研究样本当中所有蛋白的表达量:TMT标记定量蛋白组、label-free非标记定量蛋白组、4D-DIA蛋白组、Astral-DIA蛋白组等。
就想知道样本中有哪些蛋白:shotgun蛋白鉴定
更加关注蛋白翻译后修饰(PTM):修饰蛋白组(磷酸化、乳酸化、泛素化、乙酰化等)
非常有目的性的只关注某几种蛋白:Olink蛋白组、PRM靶向蛋白组
Q2.定量蛋白组产品这么多,我该如何快速选择?
随着科学技术的不断发展,技术的可选择性只会越来越多。有的新技术在逐步取代旧技术,有的新技术依然无法遮住旧技术的光芒。小编在这里主推两款技术给大家,如果非常在乎定量的准确性,可以选择TMT标记定量蛋白组,否则则选择Astral-DIA蛋白组。
具体的技术区别介绍可参考TMT、LFQ与DIA技术深度解析
Q3.蛋白质组实验是否需要重复?
为了确保实验结果的可靠性和代表性,减少个体差异带来的偶然误差,揭示样本间的生物学差异,所以对于生物学实验一般都建议至少做3个重复,对于实验室外培养的材料建议6-10重复,如果是临床样本由于个体差异较大建议至少20个以上。如果不设重复,并且后期验证实验也较少时,在发表文章时容易被质疑,从而影响文章的发表。
Q4.不同批次的蛋白组可以一起分析吗?
不可以。因为质谱的批次效应比较大,两个检测时间点仪器的响应会发生变化,这样可能导致的一些含量低的物质可能只在一个批次里被检出。并且由于仪器的波动会导致物质的峰面积整体发生变化,从而影响结果的一致性和准确性。
Q5.蛋白组如何选择数据库?
结论:UniProt>NCBI>其他
UniProt是目前世界上最大最完整的蛋白数据库。其中除了人和小鼠可以用Swiss-Prot更好以外,其他物种都推荐UniProt Proteomes。UniProt的信息大多数都是经过验证或人工校验的,冗余度非常低。
NCBI是由美国国立生物技术信息中心(NCBI)维护的一个包含各种物种蛋白质序列的大型数据库,蛋白库的信息是任何一个研究者都可随意提交的,因此NCBI中收录的蛋白质信息非常丰富。但是很多蛋白的信息是没有经过验证或人工校验就直接提交的,所以会有很多冗余的蛋白信息。
注:如果有转录组数据和蛋白组数据一起分析,为了联合分析保持对应关系的一致性,建议和转录组使用相同的基因组。
Q6.什么时候需要去除高丰度蛋白?不去除有什么影响?
一般来说体液样本如尿液,血液,乳汁等都会存在高丰度蛋白。
高丰度蛋白在样本中占据了大部分的蛋白质总量,它们的存在会一定程度上干扰低丰度蛋白的检测信号,增加数据的复杂性,降低样本的分辨率从而影响检测效果。
Q7.去除高丰度蛋白的方法有哪些?
目前常用的去除高丰度蛋白的方法有三种:
物理化学法:通过高速离心、色谱分离等方式去除高丰度蛋白;
高丰度蛋白去除试剂盒:通过特异性结合去除高丰度蛋白,使样品复杂性显著降低,从而检测到更多低丰度蛋白。
中低丰度蛋白富集试剂盒:这个方法的思路和第二种正好相反,通过特异性富集中低丰度蛋白,达到更好的检测中低丰度蛋白的目的。
Q8.蛋白组学样本寄送前是否需要精确计数或是称量?
可以不精确称量。项目开展前会进行蛋白提取和质检,后续也是取等蛋白量的样本上机检测,保证每个样本提取的蛋白量能达到上机要求即可。
Q9.为什么通过ELISA/WB能检测到的蛋白在蛋白组实验中没有检测到?
在复杂的样本中,蛋白质的种类是非常繁多的,而质谱检测并不能保证鉴定到所有的蛋白质,有些低丰度的蛋白质可能不会在质谱结果中完全体现。而ELISA/WB与质谱检测的灵敏度是不一样的,前者具有放大信号的效应,通过实验可以进一步放大目的蛋白的检测效果。
Q10.为什么蛋白鉴定结果偏少?
1)如果 SDS-PAGE 结果显示条带较少且颜色较淡,这可能是由于样本本身的蛋白量较少导致的。
2)数据库不完整可能会导致蛋白质鉴定结果偏少。对于不常见的物种,数据库中的信息可能非常有限,当物种本身蛋白库信息较少时,可以选择搜索近缘物种的蛋白库。
3)如果样品中含有高丰度蛋白未去除,也可能会影响质谱鉴定结果。
随着蛋白组学技术的不断革新和应用领域的不断拓展,我们有理由相信,2025年的蛋白组将会有更多的突破性成果涌现,让我们一起期待!
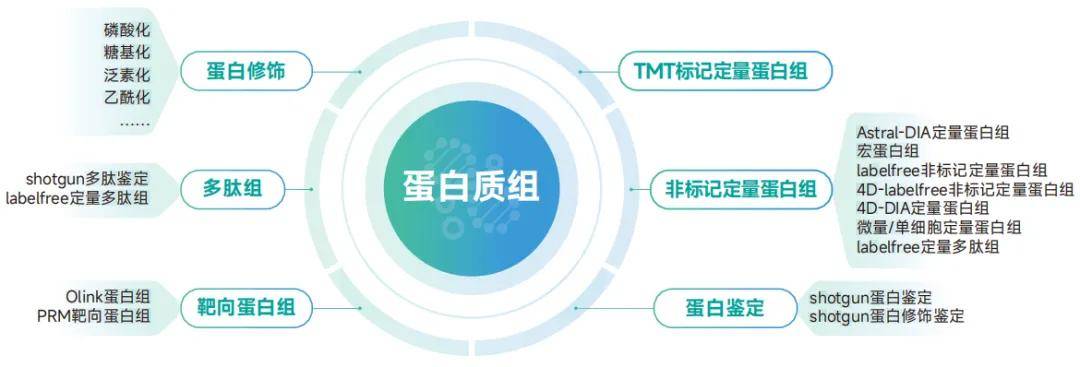 派森诺蛋白组产品总览
派森诺蛋白组产品总览


