
2025-01-17

上期为大家介绍了科研中的提取实验,本期小编继续带大家走进RNA提取,RNA(核糖核酸)主要功能是作为遗传信息从 DNA 传递到蛋白质的媒介,参与蛋白质的合成、调控以及其它多种细胞功能,从遗传信息的传递、蛋白质的合成到细胞代谢的调节等各个方面都有涉及。对于咱们科研人来说,提取 RNA 是开启诸多研究大门的钥匙。不管是探索基因的奥秘、了解疾病的发病机制,还是开发新的药物,高质量的 RNA 样本都是不可或缺的。像在基因表达分析中,通过实时定量 PCR(qRT-PCR )、数字 PCR(dPCR)、微阵列(Microarray)和 RNA 测序(RNA-seq)等技术,研究人员可以利用提取的 RNA 来量化特定基因或整个转录组的表达水平,这有助于理解基因在不同条件下的活性变化。
一、RNA 提取的常用方法
(一)Trizol 提取法
在众多 RNA 提取方法中,Trizol 提取法堪称 “明星选手”。它的原理是利用异硫氰酸胍等强力蛋白质变性剂,迅速破碎细胞,让核蛋白复合体解离,把 RNA 释放出来。同时,试剂中的酚可以裂解细胞,使蛋白质和核酸解聚,再加上氯仿的助力,促使溶液分层,RNA 就乖乖地跑到上层水相去啦,后续通过异丙醇沉淀、乙醇洗涤,就能得到纯净的 RNA。
Trizol 法的优点:
1、适用性广泛,不管是动物组织、植物组织,还是微生物,统统不在话下;
2、操作简单易上手,无需高端复杂的仪器,新手小白也能快速掌握;
3、提取效率高,能在短时间内收获高质量、高纯度的 RNA,还没有 DNA 和蛋白质的污染。
不过呢,它也有个小缺点,就是试剂里的酚和异硫氰酸胍有一定毒性,使用时得小心防护,通风橱里操作才安全。
(二)其他方法
除了 Trizol 法,还有一些其他的 RNA 提取方法。盐酸胍 - 有机溶剂法,利用盐酸胍抑制 RNA 酶,匀浆裂解细胞后,用有机溶剂抽提去除蛋白质,再选择性沉淀 RNA 分子,不过操作过程有点繁杂费时。氯化锂 - 尿素法,靠高浓度尿素变性蛋白质、抑制 RNA 酶,氯化锂选择性沉淀 RNA,速度倒是挺快,就是偶尔会出现 DNA 污染,还容易弄丢一些小分子量的 RNA,像 5S RNA 等。这些方法各有优劣,大家在选择的时候得根据样本特点、实验要求和自身条件来综合考量。
二、 Trizol 法提取 RNA详细步骤
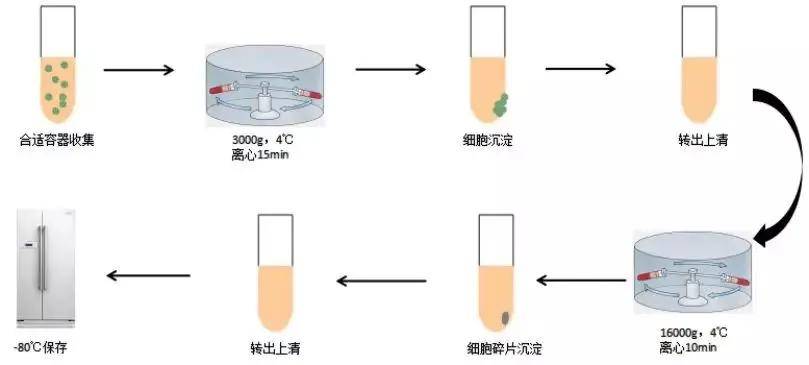
(一)样本采集
工欲善其事,必先利其器。首先,样本的新鲜度至关重要,刚采集的样本 RNA 完整性最佳,要是没法立刻提取,务必液氮速冻后存于 -80℃冰箱。
其次,无酶耗材得备齐,像 RNase-free 的离心管、枪头,还有处理过的玻璃器皿等,这能有效避免 RNA 酶污染。最后,冰盒也不能少,大部分操作都得在冰上进行,低温能抑制 RNA 酶活性,让 RNA 更稳定。试剂方面,无水乙醇、氯仿、异丙醇、RNase-free 水等都要提前准备好,这些都是提取过程中必不可少的提取工具。
(二)详细步骤
样本处理:如果是组织样本,像动物组织得先用液氮速冻,再放到研钵里,加液氮研磨成粉末状,动作要快,防止 RNA 降解,一般 50 - 100mg 组织加 1mL Trizol。要是植物组织,可能还得考虑细胞壁比较厚的问题,多研磨几次确保细胞破碎充分。对于细胞样本,贴壁细胞就先用胰酶消化下来,离心收集沉淀,弃掉培养基,按 1mL Trizol/10cm² 培养皿的量加入 Trizol,吹打混匀;悬浮细胞直接离心,弃上清后加 Trizol 吹打裂解。
裂解:把处理好的样本转移到 RNase-free 的离心管里,按比例加入 Trizol,细胞样本一般每 5~10×106个细胞加 1mL Trizol,组织样本 50 - 100mg 加 1mL Trizol,加的时候要精准,然后室温静置 5 - 10 分钟,让细胞充分裂解,核酸酶被抑制,RNA 释放出来。
分层:接着往裂解液里加氯仿,氯仿和 Trizol 的体积比大概是 1:5,盖紧盖子,使劲涡旋振荡 15 - 30 秒,让溶液充分混合,然后室温静置 2 - 3 分钟。这时候溶液会分层,底层是酚 - 氯仿相,里面有蛋白质和 DNA,中间可能有少量杂质,上层透明水相就是咱们心心念念的 RNA 啦。之后 12000g、4℃ 离心 15 分钟,让分层更彻底,吸取上层水相的时候可得小心,千万别吸到中间层,不然 RNA 纯度就大打折扣了。
沉淀:把上层水相转移到新管子里,加入等体积异丙醇,轻轻颠倒混匀,这时候 RNA 就会慢慢聚集沉淀下来。要是预期 RNA 量少,还可以加点糖原助沉淀,然后室温静置 10 分钟,或者 -20℃ 放久一点,像过夜沉淀得率会更高,之后 12000g、4℃ 离心 10 分钟,弃掉上清,底部白色沉淀就是 RNA 啦。
洗涤:用 1mL 75% 乙醇(用 DEPC 水配的)洗涤沉淀,涡旋或颠倒混匀,把残留的杂质洗掉,7500g、4℃ 离心 5 分钟,弃上清,再重复一次,确保洗干净,最后尽量吸干残留液体。
溶解:沉淀晾干一会儿,看到有点半透明了,就用适量 RNase-free 水溶解 RNA,一般 30 - 50μL,具体看沉淀量,溶解后室温静置 10 分钟,让 RNA 充分溶解,测个浓度,合格的就分装保存,-80℃ 冰箱是它的 “长期住所”,避免反复冻融降解 RNA。
三、RNA 提取常见问题及对策
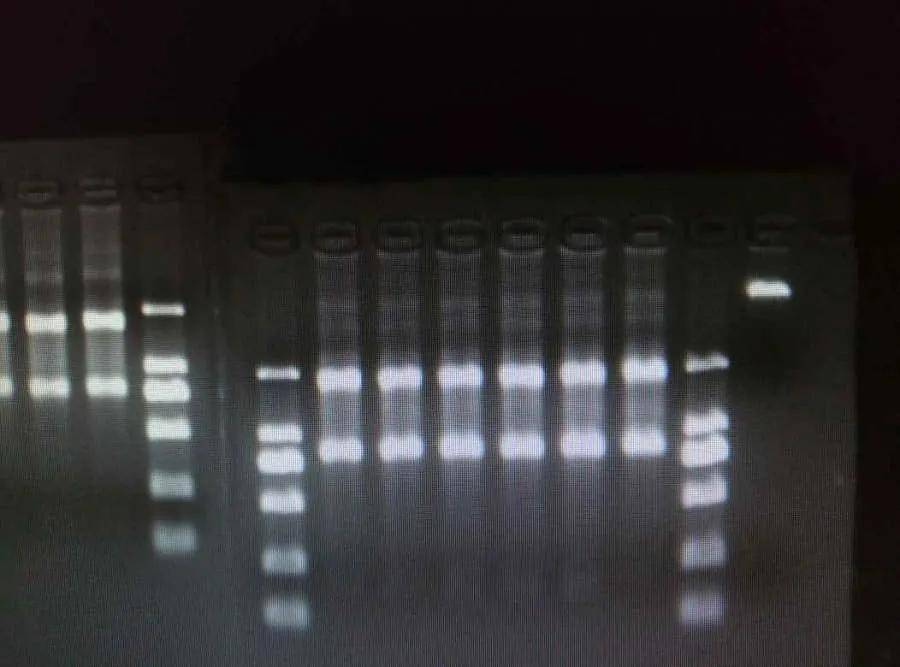
(一)RNA 产量低
1、样本量不足
背景:如果起始样本中的细胞或组织量太少,能够提取到的 RNA 总量自然就会比较低。例如,在从少量血液样本中提取 RNA 时,白细胞数量有限,导致 RNA 产量受限。
解决方案:增加起始样本量。对于细胞样本,可以扩大培养规模后再收集细胞;对于组织样本,可以适当增加组织的重量或体积,但要注意不能超出提取试剂盒的处理范围。
2、RNA 降解
背景:RNA 是一种不稳定的分子,很容易被 RNA 酶(RNase)降解。RNase 存在于几乎所有的环境中,包括实验人员的手上、空气中的灰尘等。如果在提取过程中没有有效抑制 RNase 的活性,RNA 就会被降解,导致产量降低和质量下降。例如,在研磨组织样本时,如果没有在含有 RNase 抑制剂的缓冲液中进行,RNA 酶就会迅速降解 RNA。
解决方案:操作过程中使用 RNase 抑制剂,如焦碳酸二乙酯(DEPC)处理水来配制试剂,DEPC 可以使 RNase 失活。同时,在提取试剂中添加 RNase 抑制剂蛋白,如 RNasin 等。保持低温环境,因为 RNase 的活性在低温下会降低。在研磨组织或裂解细胞后,应尽快将样本置于冰上或者在低温离心机中离心。尽量缩短操作时间,减少 RNA 暴露在可能含有 RNase 的环境中的时间。
3、提取试剂效率低
背景:不同品牌或批次的 RNA 提取试剂盒可能存在差异,某些试剂可能对特定样本类型的提取效率不高。例如,一些基于硅胶膜吸附的试剂盒可能对富含多糖的植物组织提取效果不佳。
解决方案:尝试更换不同品牌或类型的提取试剂盒。对于植物组织,可以选择专门针对植物的 RNA 提取试剂盒,这些试剂盒通常含有去除多糖和多酚等杂质的成分,能够提高 RNA 的提取效率。同时,确保按照试剂盒的说明书正确操作,包括试剂的用量、孵育时间等。
4、细胞或组织类型特殊
背景:某些细胞或组织具有特殊的结构或成分,会影响 RNA 的提取。例如,脂肪组织中含有大量的脂类物质,这些脂类可能会干扰 RNA 与提取试剂的结合,导致提取效率降低。
解决方案:对于脂肪组织,可以在提取前先采用适当的方法去除脂类,如用有机溶剂(如氯仿)进行脱脂处理。对于其他特殊组织,如骨骼组织,可能需要先进行脱钙等预处理,以提高 RNA 的可提取性。
(二)RNA 纯度低
1、蛋白质污染:
背景:在 RNA 提取过程中,如果细胞裂解不充分或者蛋白去除步骤效果不好,就会导致蛋白质污染。例如,在使用酚 - 氯仿抽提 RNA 时,如果没有充分振荡使蛋白质变性并进入有机相,蛋白质就会残留在水相RNA 溶液中。
解决方案:优化细胞裂解条件,如增加裂解液的用量或者延长裂解时间,确保细胞完全裂解,使 RNA 充分释放。改进蛋白去除步骤,在酚 - 氯仿抽提时充分振荡,使蛋白质与有机相更好地结合。也可以增加蛋白酶 K 处理步骤,将蛋白质降解后再进行后续提取。使用 RNA 清洁试剂盒进一步去除蛋白质杂质,这些试剂盒通常基于柱层析等原理,可以有效地去除蛋白质等污染物。
2、DNA 污染
背景:如果在提取过程中没有有效去除基因组 DNA,就会导致 RNA 样本中存在 DNA 污染。这在使用某些提取方法时比较常见,例如,如果在裂解细胞后没有使用 DNase(脱氧核糖核酸酶)处理,基因组 DNA 就会和 RNA 一起被提取出来。
解决方案:在提取过程中加入 DNase 处理步骤,将 DNA 降解。一般在提取的适当阶段,如在 RNA 初步分离后,加入适量的无 RNase 的 DNase,在合适的温度和缓冲条件下孵育一段时间,然后再通过酚 - 氯仿抽提或柱层析等方法去除 DNase 和降解的 DNA 片段。对于一些有 DNA 残留风险较高的提取方法,可以在提取后使用专门的 DNA 去除试剂盒,这些试剂盒可以特异性地结合 DNA 并将其去除,而不影响 RNA 的完整性。
3、有机溶剂残留
背景:在使用有机溶剂(如酚、氯仿等)进行提取时,如果有机溶剂去除不彻底,就会残留下来影响 RNA 的纯度。这些有机溶剂可能会干扰后续的 RNA 分析实验,如逆转录和 PCR 等。
解决方案:在提取最后阶段,确保充分离心使有机溶剂和水相完全分离。例如,在使用酚 - 氯仿抽提后,增加离心时间和转速,使有机相沉淀在底部,小心吸取上层的水相 RNA 溶液,避免吸取到有机相。可以使用乙醇沉淀等方法进一步纯化 RNA,乙醇可以使 RNA 沉淀下来,而残留的有机溶剂则留在上清液中,离心后去除上清液即可减少有机溶剂残留。
(三)RNA 完整性差
1、过度机械力作用
背景:在处理样本时,如研磨组织或剧烈涡旋细胞裂解液,过度的机械力可能会导致 RNA 断裂。例如,在使用研钵研磨坚硬的植物组织时,如果用力过猛,RNA 分子的长链结构可能会被破坏。
解决方案:对于组织样本,采用温和的研磨方式,如使用液氮冷冻后在研钵中轻轻研磨,避免过度用力。也可以使用组织破碎仪,设置合适的参数,减少对 RNA 的机械损伤。在处理细胞裂解液时,避免剧烈涡旋,如需混合可以轻轻颠倒离心管来达到目的。
2、不合适的裂解条件
背景:裂解液的成分和裂解条件(如温度、时间等)如果不合适,可能会影响 RNA 的完整性。例如,某些裂解液中的化学物质可能会对 RNA 产生化学损伤,或者过长时间的高温裂解可能会导致 RNA 降解。
解决方案:根据样本类型选择合适的裂解液,对于敏感的样本可以选择温和的无毒性裂解液。严格按照推荐的裂解条件操作,包括温度和时间。一般来说,裂解温度不宜过高,时间也不宜过长,以避免 RNA 的损伤。
3、反复冻融
背景:RNA 样本如果经过多次冻融循环,会导致 RNA 的降解和完整性受损。每次冻融过程中,冰晶的形成和融化可能会对 RNA 分子产生物理损伤。
解决方案:将 RNA 样本分装保存,每次只使用一份,避免反复冻融。可以将 RNA 样本按照实验需求分装成小份,保存在 - 80℃冰箱中。如果需要长期保存 RNA,也可以考虑将其制成 RNA 干粉,这样可以更好地保持 RNA 的完整性,在需要使用时再用适当的缓冲液溶解。
四、RNA 质量检测
(一)纯度检测
RNA纯度一般用紫外分光光度计来检测,重点关注 OD260/OD280 和 OD260/OD230 这两个比值。OD260 代表核酸的吸光度,OD280 代表蛋白质的吸光度,纯RNA 的比值理论上是 2.0,在实际操作中,1.8 - 2.0 这个范围都还算能接受,要是比值小于 1.8,那很可能存在蛋白质杂质;大于 2.2 的话,RNA 说不定已经水解成单核酸了。而 OD260/OD230 比值反映的是碳水化合物、盐类等杂质残留情况,一般要大于 2.0,比值偏小,就提示可能有异硫氰酸胍、β- 巯基乙醇或乙醇这些家伙没清理干净,得想办法补救,像是再沉淀一次、重复乙醇洗涤步骤之类的。
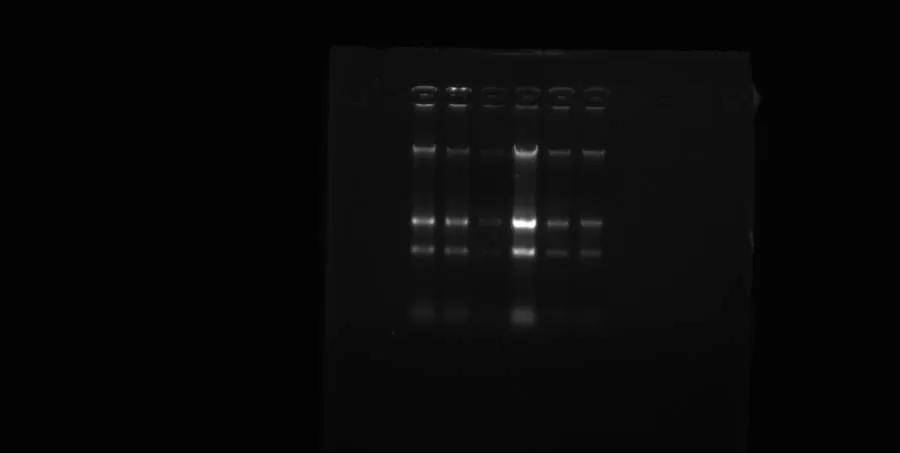
(二)完整性鉴定
RNA完整性鉴定,琼脂糖凝胶电泳是常用手段,真核生物的 RNA 在电泳后,正常情况下会出现 5S、18S 和 28S 三条清晰条带,要是 28S 条带亮度正好是 18S 的两倍,还边缘锐利,那恭喜你,RNA 完整性很棒;要是条带模糊、弥散,或者比例不对,那 RNA 可能降解得有点惨,后续实验得小心。除了电泳,还有些 “高科技武器”,像 Agilent 2100 生物分析仪,利用微流控芯片电泳技术,能给出 RNA 完整性数值(RIN),RIN 值在 1 - 10 之间,大于 7 就是高质量 RNA,6 - 7 算部分降解但勉强能用,小于 6 的话,这 RNA 质量就不过关了。
五、小结
随着科技的飞速发展,RNA 提取技术在不断革新。新的试剂、试剂盒层出不穷,让操作更简便、效率更高;自动化设备崭露头角,减少人为误差,实现高通量提取;微流控技术等前沿科技也在 RNA 提取领域 “大展拳脚”,有望带来革命性的变化。相信在这些新技术的助力下,咱们的 RNA 提取研究将更上一层楼,为生命科学的探索开辟更广阔的天地!派森诺竭诚为大家提供有关RNA提取实验中涉及的所有试剂、耗材和设备,助力每一位生命科学实验室的科研人收获属于自己的完美实验结果,逐梦高分文章~

RNA提取实验相关试剂、耗材和仪器可洽询当地销售或拨打咨询电话:021-80118168-6720