2025-03-19
Highlights
1、本文汇总了食品营养与健康领域中的热点研究方向及组学研究思路。
2、传统营养学研究常受限于单一维度的分析,而多组学联合分析技术的崛起,正为食品营养与健康领域打开一扇全景视窗——从基因到代谢,从肠道菌群到细胞信号,揭示食物与人体互作的深层密码!
3、派森诺提供多组学检测服务,包括微生物组、基因组、转录组、蛋白组、代谢组及表观调控等,结合多组学联合分析技术,助力食品营养与健康科学高效突破,案例成果多多。
随着慢性疾病高发与健康意识觉醒,“吃什么、怎么吃”早已超越温饱需求,成为关乎生命质量的核心议题。当传统营养学遭遇技术革命,食品营养与健康研究正以多组学技术为引擎,掀起一场从微观基因到宏观健康的认知变革。今天,让我们揭开这场科学盛宴的神秘面纱,探寻未来健康饮食的底层逻辑。
以下是当前该领域的热点方向及典型研究思路:
1. 个性化营养干预
研究思路:通过整合基因组、代谢组和微生物组数据,解析个体对食物吸收、代谢的差异,建立精准营养模型。
涉及组学:基因组学(SNP分析)、代谢组学(血液/尿液代谢物)、微生物组学(肠道菌群)。
实验设计:
①队列研究:招募不同表型(如肥胖、糖尿病)人群,采集生物样本(血液、粪便)。
②干预实验:定制饮食方案,跟踪代谢标志物和菌群变化(如低GI饮食对血糖波动的影响)。
分析方法:
机器学习模型(如随机森林)预测饮食响应;
多组学数据整合(如基因-代谢物-菌群网络分析)。
2. 肠道微生物与代谢调控
研究思路:探究特定饮食成分(膳食纤维、多酚)如何通过调节肠道菌群结构,影响宿主代谢(如短链脂肪酸生成)。
涉及组学:宏基因组学(菌群结构以及功能基因)、代谢组学(宿主/菌群代谢物)、转录组学(宿主肠道基因表达)。
实验设计:
①动物模型:无菌小鼠定植人源菌群,给予不同膳食干预;
②人群试验:高纤维饮食干预,对比干预前后菌群多样性和炎症指标(如IL-6)。
分析方法:
相关性网络分析(如菌群-代谢物共现网络);
代谢通路富集(KEGG、MetaCyc数据库)。
3. 功能性食品开发
研究思路:利用多组学技术解析天然活性成分(如姜黄素、Omega-3)的作用靶点及分子机制。
涉及组学:蛋白质组学(靶蛋白鉴定)、代谢组学(药效代谢物)、表观t组学(甲基化修饰)。
实验设计:
①体外实验:细胞模型(如Caco-2肠道细胞)分析抗炎活性;
②临床试验:双盲随机对照试验(RCT)验证功能性食品效果(如降血脂)。
分析方法:
差异表达蛋白/代谢物筛选(如TMT标记定量蛋白质组学);
多组学联合通路分析(如IPA、MetaboAnalyst)。
4. 慢性病预防与靶向干预
研究思路:识别饮食因素与慢性病(心血管疾病、糖尿病)相关的生物标志物,开发早期预警模型。
涉及组学:脂质组学(脂质代谢谱)、蛋白质组学(炎症因子)、代谢组学(糖基化终产物)。
实验设计:
①前瞻性队列:长期跟踪健康人群,采集基线多组学数据,分析疾病发生关联;
②病例对照研究:对比患者与健康人的组学特征差异(如氧化应激标志物)。
分析方法:
多变量统计分析(PLS-DA、OPLS-DA);
生物标志物组合筛选(ROC曲线评估诊断效能)。
技术路线
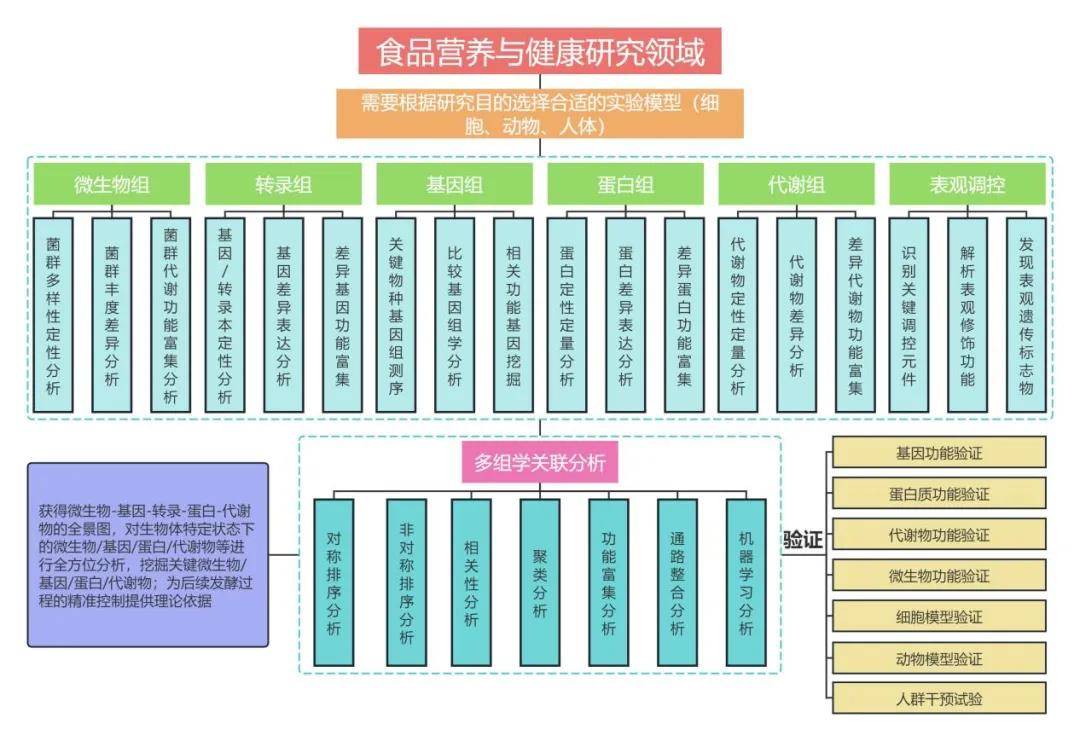
案例分享
多组学联合揭示猪去氧胆酸治疗非酒精性脂肪肝的机制
Hyodeoxycholic acid alleviates non-alcoholic fatty liver disease through modulating the gut-liver axis
发表期刊:Cell Metabolism
影响因子:29
通讯单位:上海交通大学医学院附属第六人民医院
组学技术:转录组、宏基因组、胆汁酸靶向代谢组
研究背景:非酒精性脂肪性肝病(NAFLD)被认为是一种影响全球约四分之一人口的流行病。但驱动NAFLD发生和发展的病因和病理因素尚未完全阐明。此外,尚未有抗NAFLD药物得到国际权威机构的批准。胆汁酸(BAs)是一组由肝细胞内胆固醇合成的两亲性分子,BA-肠道菌群串扰与包括NAFLD在内的代谢性疾病有关,在调节宿主葡萄糖和脂质代谢中起重要作用。前期研究显示非12α-羟基化胆汁酸、猪胆酸(HCA)和猪脱氧胆酸(HDCA)在调节葡萄糖稳态和预测2型糖尿病未来风险方面具有治疗潜力。因此我们假设了一种药物治疗策略,通过靶向替代BA合成通路来治疗代谢性疾病。
技术路线:
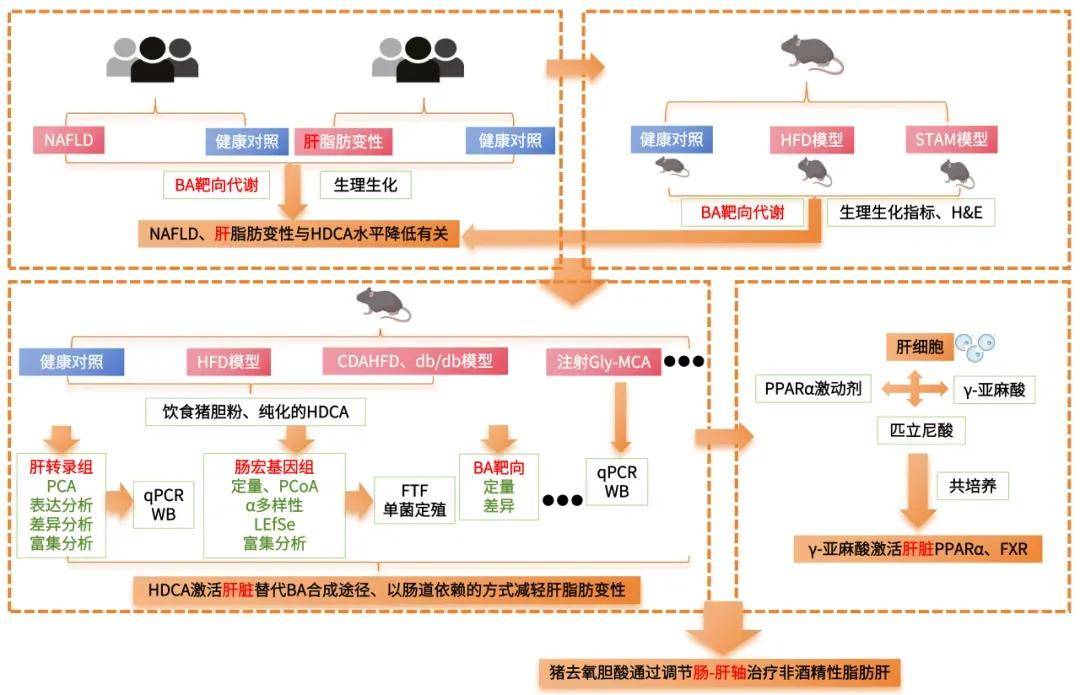
部分研究结果:BA作为一种信号分子,在NAFLD的发病机制中发挥着重要作用,已被越来越多的人所认识。本研究首次发现,在从脂肪变性到肝硬变的所有阶段,NAFLD患者的血清HDCA水平都显著降低,而在NAFLD和糖尿病患者以及动物模型中,HDCA水平的下降更为明显。值得注意的是,使用HDCA治疗后,小鼠的NAFLD表型和IR显著改善。肝脏经典的BA合成途径和替代的BA合成途径分别产生12OH和非12OH BA。在生理条件下,寄主在两条合成途径之间保持着微妙的动态平衡。在HDCA干预后,我们观察到非12OHbas的比例增加,12OHbas的比例降低。以前的研究已经报道了12OHbas升高与宿主糖和脂代谢紊乱之间的高度相关性。肝细胞色素P7B1是BA合成途径中的限速酶,与NAFLD和糖尿病的进展和治疗密切相关。研究者还提出,通过激活CYP7B1驱动的替代BA合成途径来恢复BA生物合成的动态平衡状态,有利于许多代谢性疾病,包括肥胖、糖尿病、高胆固醇血症和NAFLD。在本研究中,我们发现选择性地激活BA的替代合成途径可以显著降低肝甘油三酯。这些结果为经典途径和替代途径在调节肝脂代谢中可能发挥不同作用提供了证据。
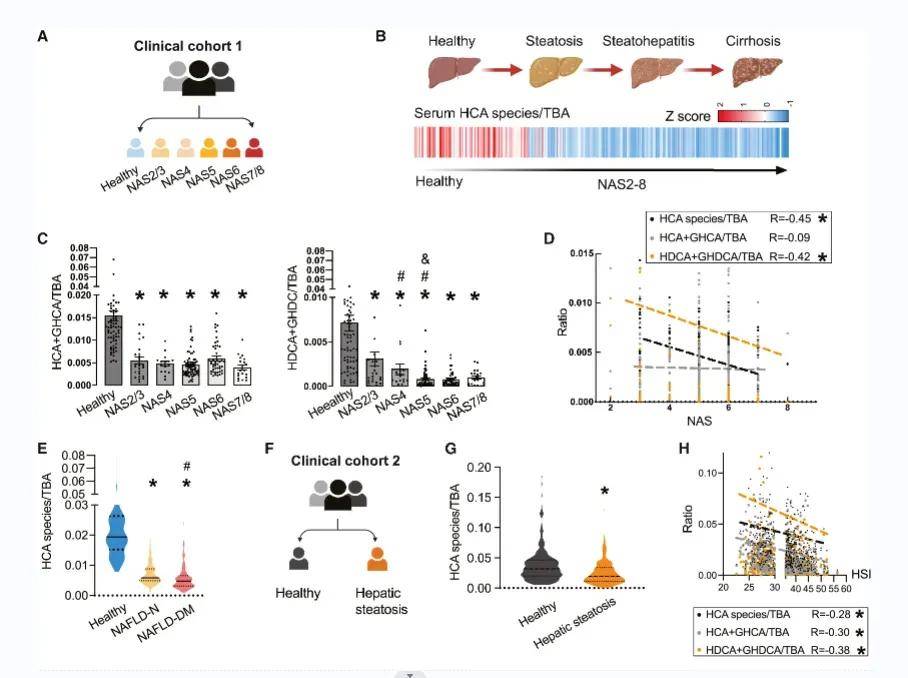
图 在NAFLD患者和hfd诱导的NAFLD小鼠的HCA种类减少
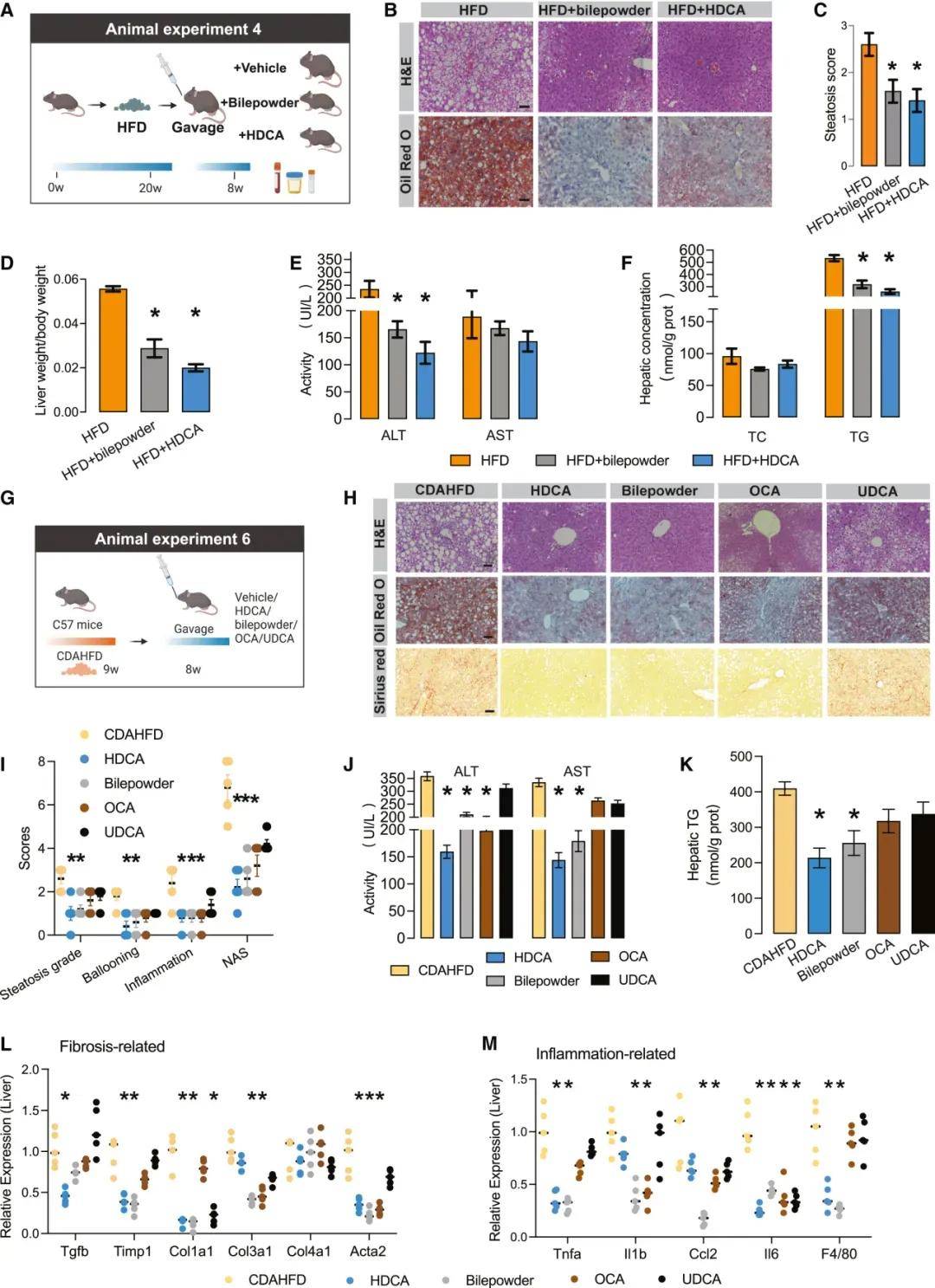
图 HDCA减弱了NAFLD相关的代谢表型
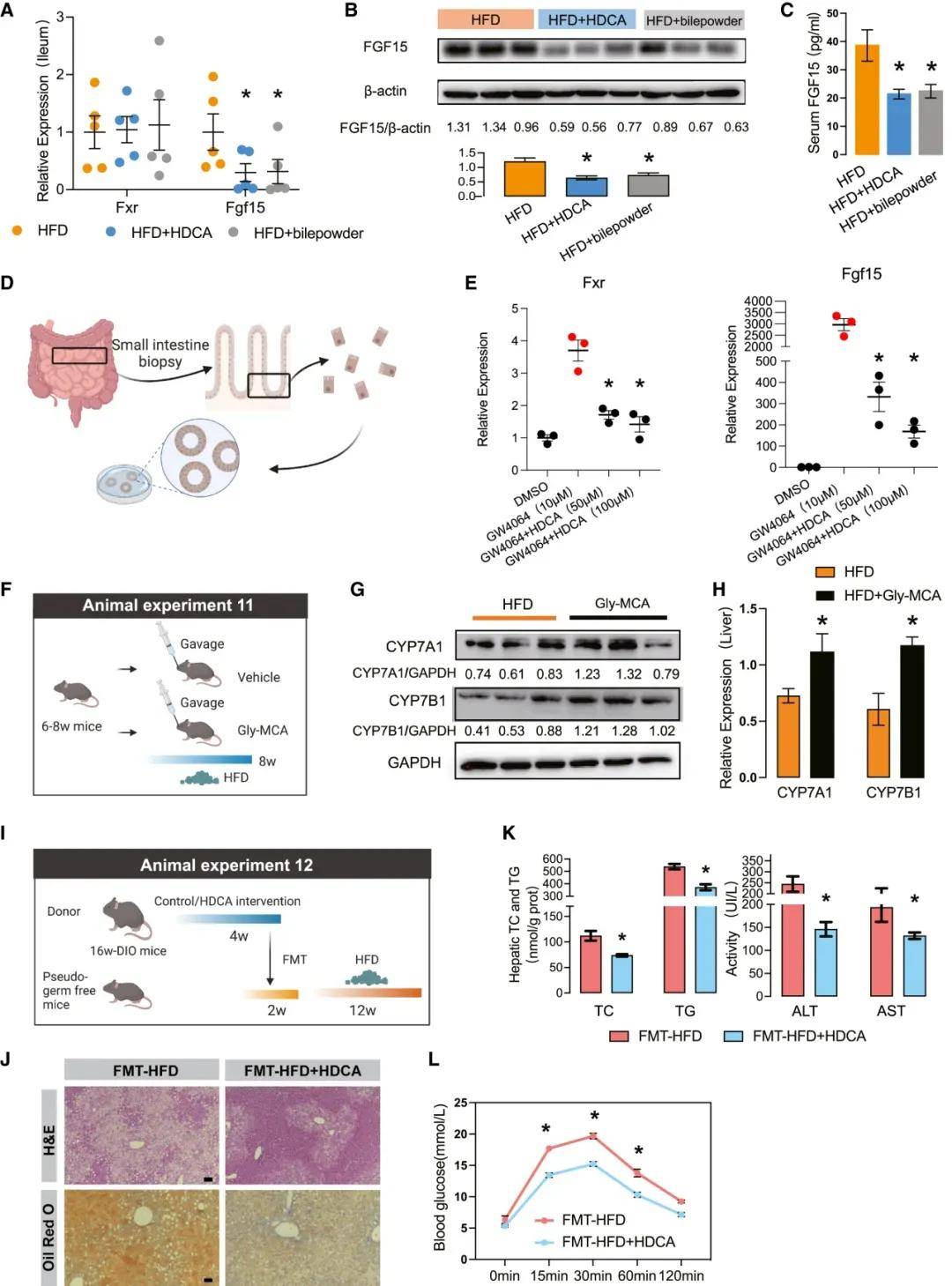
图 HDCA以肠道依赖的方式减轻肝脂肪变性
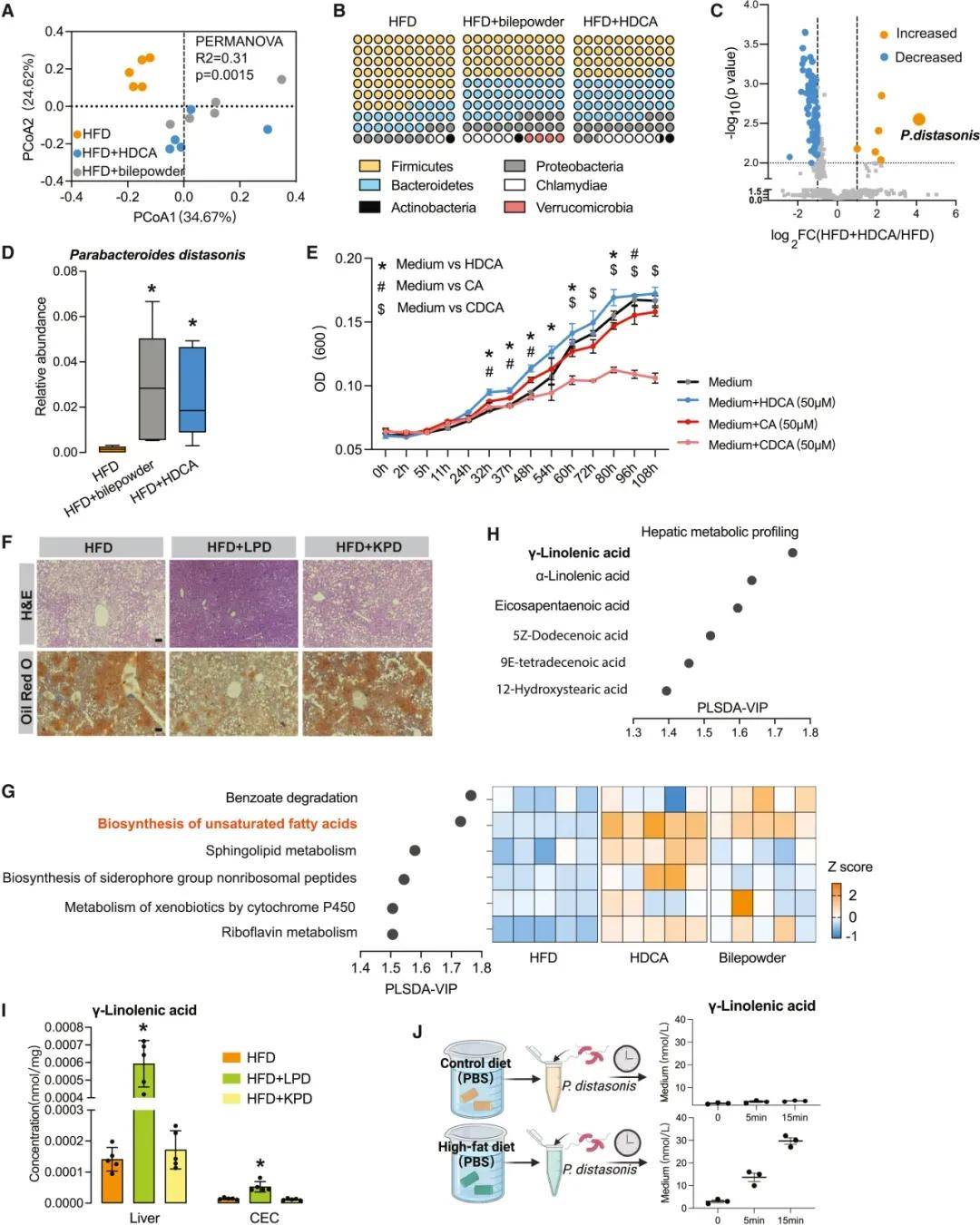
图 HDCA富集了异裂副杆菌及其衍生的脂肪酸
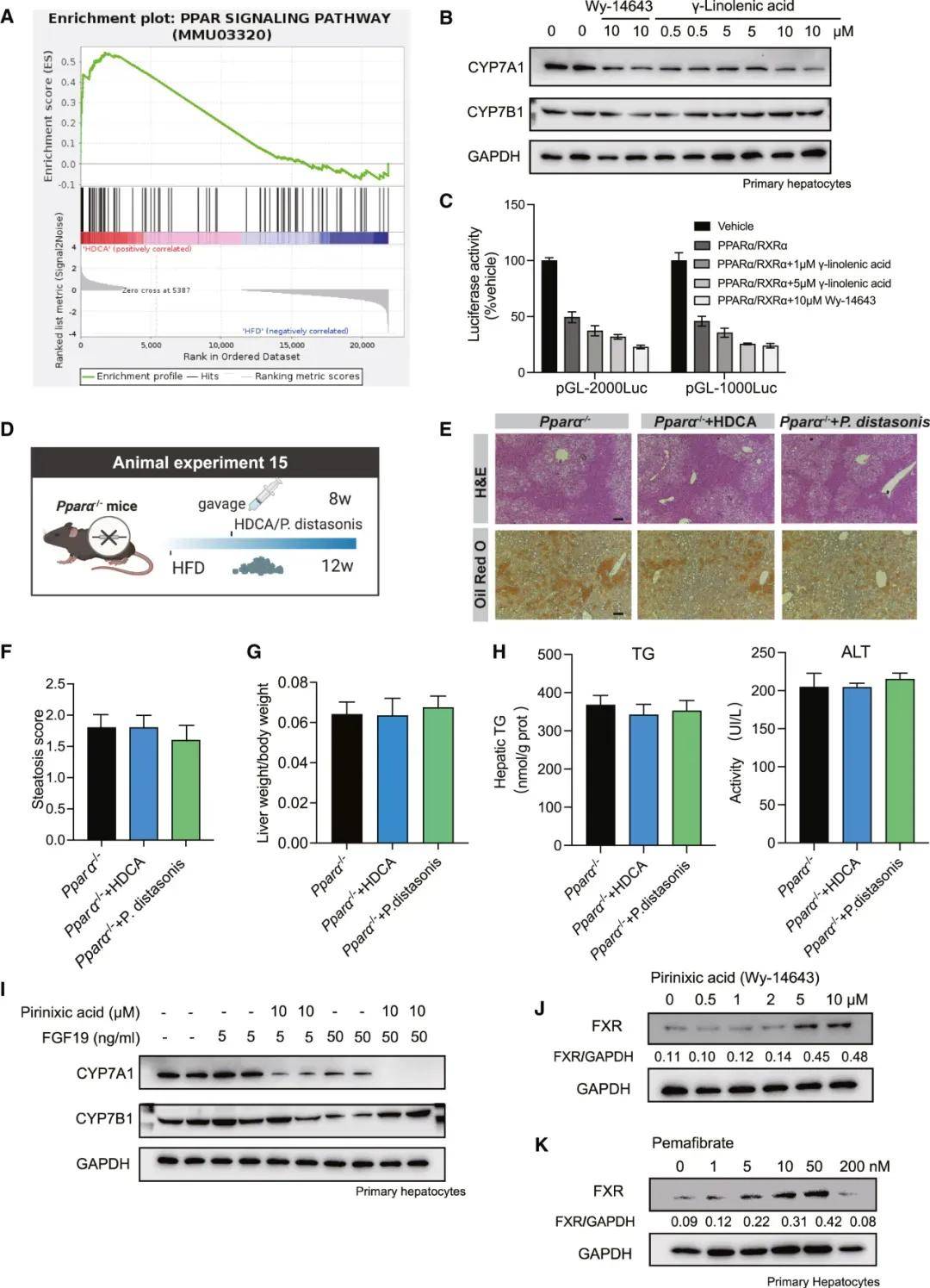
图 CYP7A1被肠道菌群产生的脂肪酸介导的PPARα激活所抑制
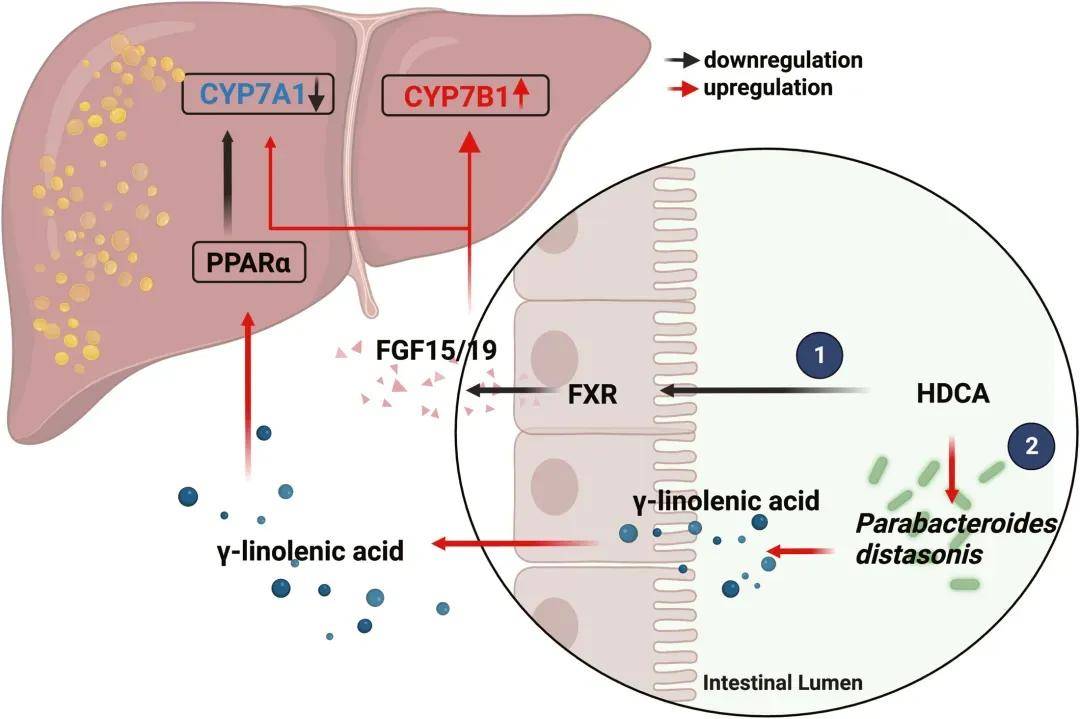
图 HDCA改善肝脂肪变性的分子机制
研究结论:本文研究了一组由肠道微生物群修饰的胆汁酸(BAs),即猪去氧胆酸(HDCA)species,与非酒精性脂肪肝病的存在和严重程度呈负相关。在多种小鼠模型中,HDCA被证实能够通过抑制肠道的法尼酯X受体(FXR)并上调肝脏的CYP7B1来缓解NAFLD。此外,HDCA显著增加了益生菌种类如狄氏副拟杆菌的丰度,这种益生菌通过脂肪酸-肝脏过氧化物酶体增殖物激活受体α(PPARα)信号通路增强脂质分解代谢,进而上调肝脏的FXR。这些发现表明,HDCA具有治疗NAFLD的潜力,其独特机制是同时激活肝脏的CYP7B1和PPARα。


