
2025-06-10
癌症远非单纯的遗传性疾病,而是一个动态演化的生态系统。在这个系统中,肿瘤细胞与非癌细胞(包括免疫细胞、基质细胞、微生物群落)通过复杂的信号网络、代谢互作和空间竞争共同塑造了肿瘤微环境(TME),进而驱动癌症的进展与治疗抵抗。
肿瘤微环境(TME)被认为是肿瘤发生和扩散的重要部分。TME的复杂性是由于不受调节的癌细胞增殖和缺陷的血管发育[1]。TME包括多种免疫细胞、肿瘤相关成纤维细胞( CAFs )、内皮细胞和细胞外基质( ECM )等。这些成分可能因组织类型而异,并随着肿瘤的进展而共同进化。正常的组织微环境可以通过免疫细胞、成纤维细胞和细胞外基质的抑制功能来限制肿瘤的生长。然而,为了癌症的进展,它必须逃避这些功能,并反过来影响TME中的细胞成为肿瘤促进细胞,从而导致原发部位的增殖、侵袭和内侵增加。TME的细胞和因子在预备中也起着至关重要的作用。
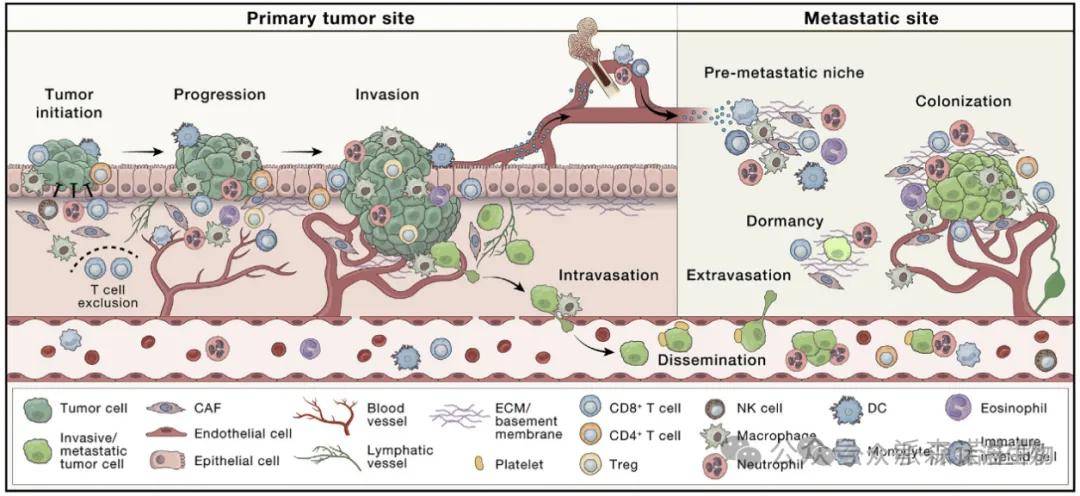
图1 原发性肿瘤进展和转移的微环境调控[2]
肿瘤免疫治疗
将免疫系统作为治疗肿瘤性疾病的工具的想法起源于19世纪[3]。150年前,魏尔啸在观察肿瘤中白细胞的流行情况时首次提出了免疫功能与癌症之间的关键关系[4]。2011年,ipilimumab (Yervoy)获批上市,开启了临床疗效持久的肿瘤免疫治疗新时代。癌症免疫治疗通过延长快速致命癌症患者的生存期,现在已经彻底改变了肿瘤学领域。肿瘤免疫治疗是指外源干预机体免疫系统,重新启动并维持“肿瘤-免疫”循环,恢复、提高机体的抗肿瘤免疫反应,加强对肿瘤细胞的识别和杀伤能力,从而达到控制甚至特异性清除肿瘤的治疗效果。相较于手术、放疗和化疗等传统方法,免疫治疗具有特异性强,副作用相对较小的的优势。目前临床应用的肿瘤免疫治疗方法包括:免疫检查点抑制剂、过继性细胞免疫治疗、癌症疫苗,以及一些新兴免疫治疗方法等。
免疫功能与肿瘤的免疫反应
NK细胞负责第一轮先天免疫反应,吞噬肿瘤细胞。树突状细胞侵入肿瘤,吞噬并将肿瘤抗原呈递给各种类型T细胞( CD4+辅助性T细胞和CD8+效应性T细胞,调节性T细胞( TReg)细胞、自然杀伤( NK )细胞),以便肿瘤引流淋巴结中激活T细胞。活化的CD4+和CD8+效应T细胞和NK细胞通过外周血返回到肿瘤床,有助于基于肿瘤-抗原启动的进一步肿瘤消退。TReg细胞同样可以返回肿瘤并抑制效应T细胞和NK细胞的杀伤效率,以防止明显的炎症和邻近正常组织的损伤。髓系来源的抑制性细胞( MDSCs )参与免疫抑制调节,进一步参与这种调节,并可间接促进肿瘤的存活和生长。B细胞产生针对肿瘤抗原的抗体,从而有助于肿瘤的根除。巨噬细胞分泌各种细胞因子,侵入并分化为肿瘤抑制(M1)和肿瘤促进(M2)谱系。成纤维细胞构建肿瘤微环境,还可以分泌各种免疫抑制剂,对抗免疫部队。
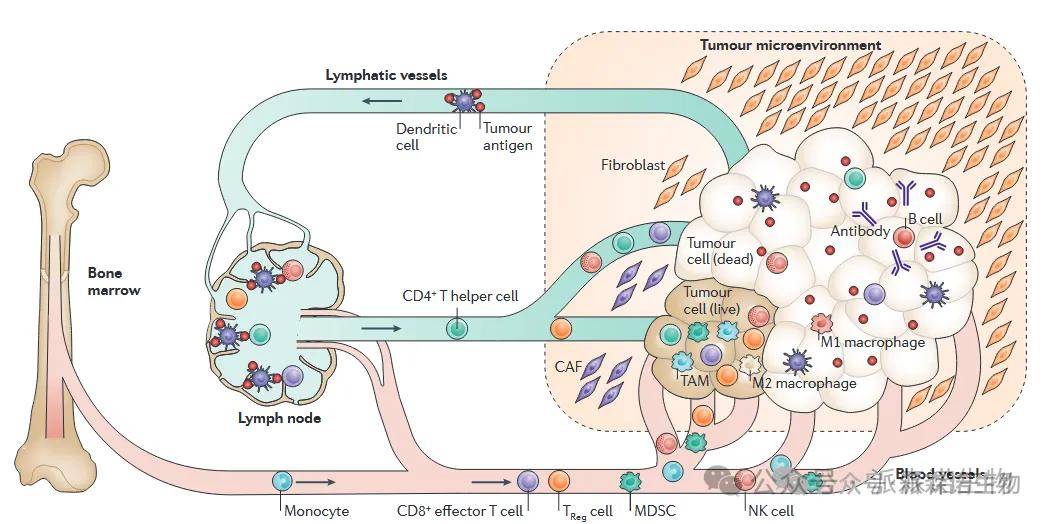
图2 免疫功能与肿瘤的免疫反应[5]
派森诺肿瘤免疫治疗研究案例
《Cell Metabolism》 :微生物代谢物氧化三甲胺促进三阴性乳腺癌的抗肿瘤免疫

英文题目:The microbial metabolite trimethylamine N-oxide promotes antitumor immunity in triple-negative breast cancer.
期刊名:Cell Metabolism
影响因子:27.7
组学技术:16S V3V4多样性组成谱、TMAO靶向代谢
主要研究结果:对三阴性乳腺癌(TNBC)队列(n=360)的多组学分析发现,免疫调节亚型(肿瘤微环境免疫活化)患者的肿瘤组织中,Clostridiales目的多个菌属及相关代谢产物氧化三甲胺(TMAO)丰度升高,且较高的血浆TMAO水平与较好的免疫治疗应答相关;细胞和TNBC小鼠实验表明,TMAO通过活化内质网应激激酶PERK来诱导GSDME介导的癌细胞焦亡,从而增强CD8+ T细胞介导的抗肿瘤免疫;为TNBC小鼠补充膳食胆碱(TMAO前体)能提高肿瘤TMAO水平,增强免疫治疗应答。综上所述,本研究提供了共生菌群影响宿主肿瘤免疫能力的新视角。特定的微生物代谢产物及其前体分子可作为调节肿瘤免疫微环境,从而改善TNBC免疫治疗效果的潜在干预策略。因此,微生物代谢产物TMAO可能具有提高TNBC免疫治疗效果的临床潜力,为TNBC的精准免疫治疗提供了新的思路;
《Biomaterials》:肽-AIEgen纳米复合材料介导的全肿瘤免疫循环-级联扩增改善肿瘤免疫治疗

英文题目:A peptide-AIEgen nanocomposite mediated whole cancer immunity cycle-cascade amplification for improved immunotherapy of tumor
期刊名:Biomaterials
影响因子:12.8
组学技术:RNA-Seq
主要研究结果:本研究设计了一种级联放大纳米复合材料,PMRA/Poly(I:C)参与癌症免疫循环的六个步骤。通过全面改善肿瘤免疫循环,极大地提高了抗肿瘤疗效,ORR从不足30%提高到几乎100%。从体内实验结果来看,全癌症免疫循环强化免疫治疗促进了50%的小鼠获得长期生存。以PMRA/Poly(I:C)为起点,基于全癌症免疫循环增强的策略可以进一步发展和改进。综上所述,我们提出了肿瘤治疗的全免疫循环增强概念,有望为临床上的肿瘤治疗策略提供参考。
《Advanced Science》:KK2DP7刺激脾脏中CD11b+细胞群引发抗肿瘤治疗的训练免疫

英文题目:KK2DP7 Stimulates CD11b+ Cell Populations in the Spleen to Elicit Trained Immunity for Anti-Tumor Therapy
期刊名:Advanced Science
影响因子:14.3
组学技术:RNA-Seq、ATAC-Seq
主要研究结果:本研究发现KK2DP7可诱导训练免疫抑制肿瘤生长。脾脏CD11b+细胞是关键靶细胞。KK2DP7训练可使CD11b+细胞的免疫反应和细胞因子分泌通路激活,增强细胞增殖、吞噬和杀伤肿瘤细胞的能力,且这些变化受TLR2-IRF7信号轴调控。KK2DP7与免疫检查点抑制剂抗体联合使用,抗肿瘤效果更优。树突状肽KK2DP7作为模型佐剂给药后可以刺激脾脏中的CD11b+细胞群,激发针对肿瘤治疗的训练免疫。
参考文献
[1]Liu J, Chen Q, Feng L, Liu Z. Nanomedicine for tumor microenvironment modulation and cancer treatment enhancement. Nano Today. 2018;21:55‐73
[2]De Visser KE, Joyce JA. The evolving tumor microenvironment: From cancer initiation to metastatic outgrowth. Cancer Cell. 2023 Mar 13;41(3):374-403. doi: 10.1016/j.ccell.2023.02.016. PMID: 36917948.
[3]Oiseth, S. J. & Aziz, M. S. A.-E. Cancer immunotherapy: a brief review of the history, possibilities, and challenges ahead. J. Cancer Metastasis Treat. 3, 250–261 (2017).
[4]Balkwill, F. & Mantovani, A. Inflammation and cancer: back to Virchow? Lancet 357, 539–545 (2001).
[5]Adams, J., Smothers, J., Srinivasan, R. et al. Big opportunities for small molecules in immuno-oncology. Nat Rev Drug Discov 14, 603–622 (2015). https://doi.org/10.1038/nrd4596