
2025-06-10
文章题目:Super-Enhancer Reprograming Driven by SOX9 and TCF7L2 Represents Transcription-Targeted Therapeutic Vulnerability for Treating Gallbladder Cancer
中文标题:SOX9和TCF7L2驱动的超增强子重编程揭示了胆囊癌靶向治疗中潜在靶点
发表期刊:Advanced Science
影响因子:14.3
发表时间:2024年
研究对象:胆囊癌(组织和细胞)
组学策略:ChIP-seq, CUT&Tag, Single-Cell Sequencing, Transcriptome Sequencing

研究背景
胆囊癌是一种罕见且高度侵袭性的恶性肿瘤,其五年生存率仅为5%至10%。腺癌占据大多数病例,而鳞状细胞癌则相对少见。目前的外科手术和化疗仅能提供姑息性治疗,几乎所有患者最终均会因该病而失去生命。基因组分析揭示了如TP53和ERBB2等高频突变,但由于GBC的遗传异质性,突变靶向治疗的机会极为有限。因此,研究者亟需探索其他生物学机制,以寻找有效的治疗策略。
表观遗传特征,包括组蛋白修饰和染色质可及性,在癌症中表现出显著变化,并逐渐显示出在胆囊癌发病机制中的重要作用。增强子,尤其是超级增强子,在调节基因表达方面发挥关键作用,并与主要转录因子形成核心调控回路。尽管已知超级增强子在癌症中的重要性,但其在胆囊癌中的具体功能尚未得到充分探讨。本研究旨在系统分析胆囊癌的超级增强子景观,揭示其调控网络,并评估超级增强子靶向转录抑制的潜在治疗效果。
研究思路
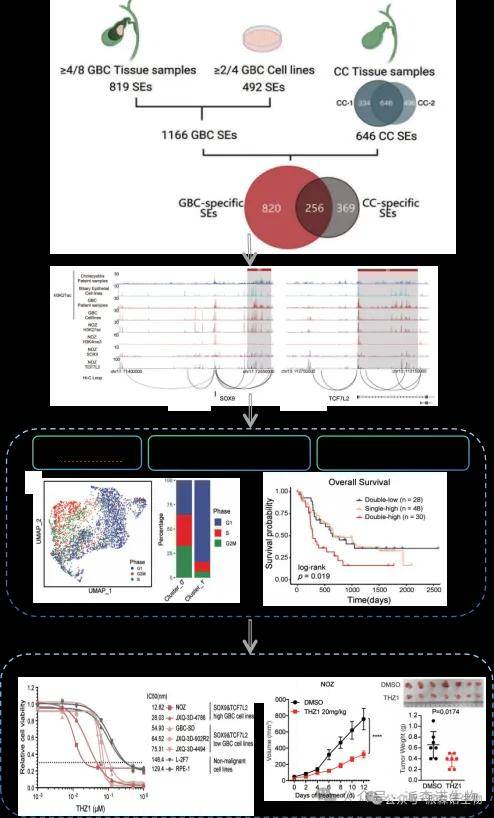
步骤一:为研究胆囊癌中的超级增强子,本文分析了多种胆囊癌组织和细胞系样本中H3K27ac的基因组分布,以建立超级增强子景观及其相关的核心调控网络。
步骤二:通过调控网络分析识别出的两个转录因子候选因子——胆道谱系因子SOX9和Wnt通路效应因子TCF7L2,CUT&Tag验证二者占据彼此的超级增强子区域,形成相互自我调节回路,从而驱动部分胆囊癌中的肿瘤发生性超级增强子的重编程。细胞学实验证明SOX9/TCF7L2双高表达的胆囊癌细胞对这两个转录因子高度依赖,并富含与stemness、ErbB和Wnt通路相关的超级增强子关联基因特征,并且此类胆囊癌细胞的患者预后显著较差。
步骤三:建立SOX9/TCF7L2双高表达的胆囊癌临床模型,在体外和体内对超级增强子靶向CDK7抑制疗法表现出敏感性。
研究内容
1.定义胆囊癌的超级增强子景观
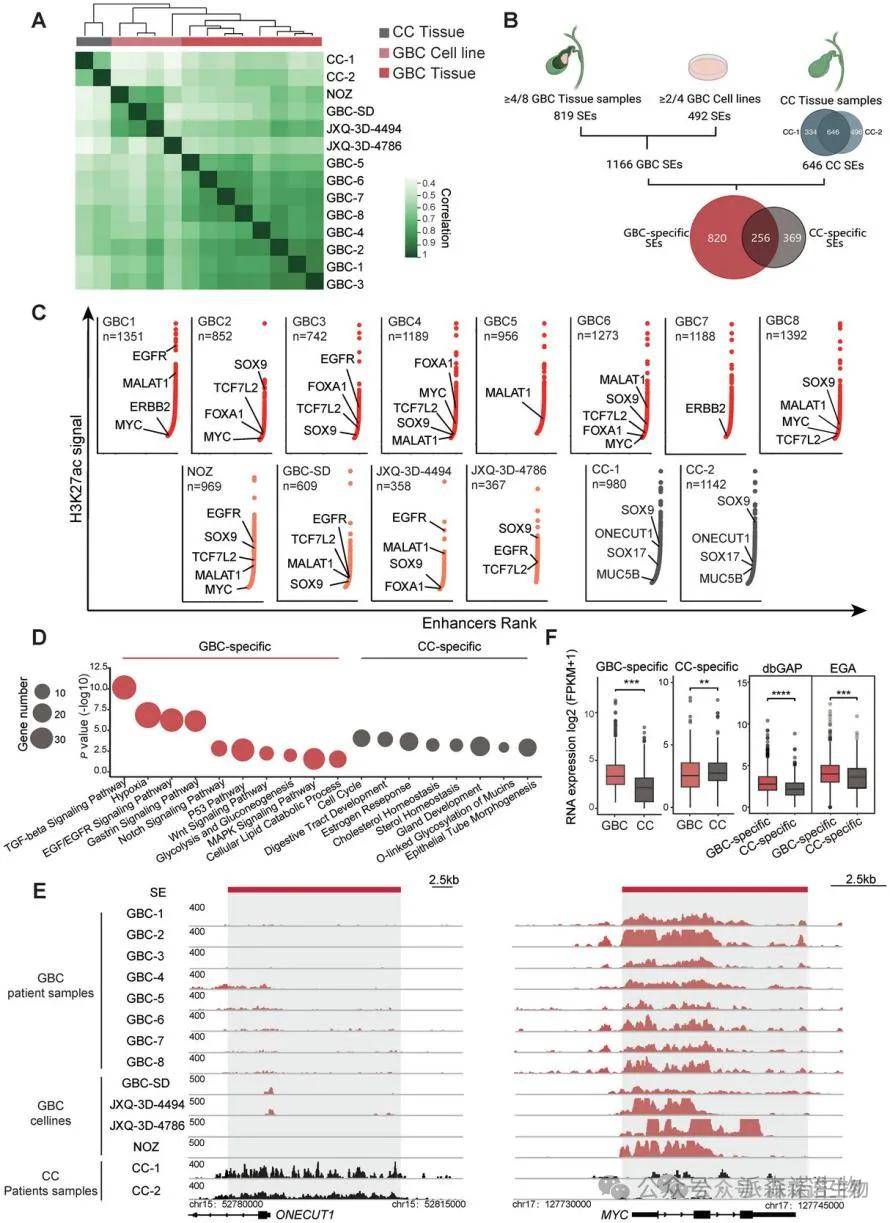
为建立胆囊癌基因组中活跃调控元件的景观,我们采用了CUT&Tag方法,检测了十个新鲜冷冻组织样本中活跃增强子标记H3K27ac的基因组分布。这些样本包括八个GBC原发肿瘤和两个慢性胆囊炎的良性胆囊样本。通过两种样本比较,识别出820个GBC特异性超级增强子,并发现与多条已知的胆囊恶性肿瘤信号通路相关。
2.识别胆囊癌中的超级增强子驱动核心调控网络
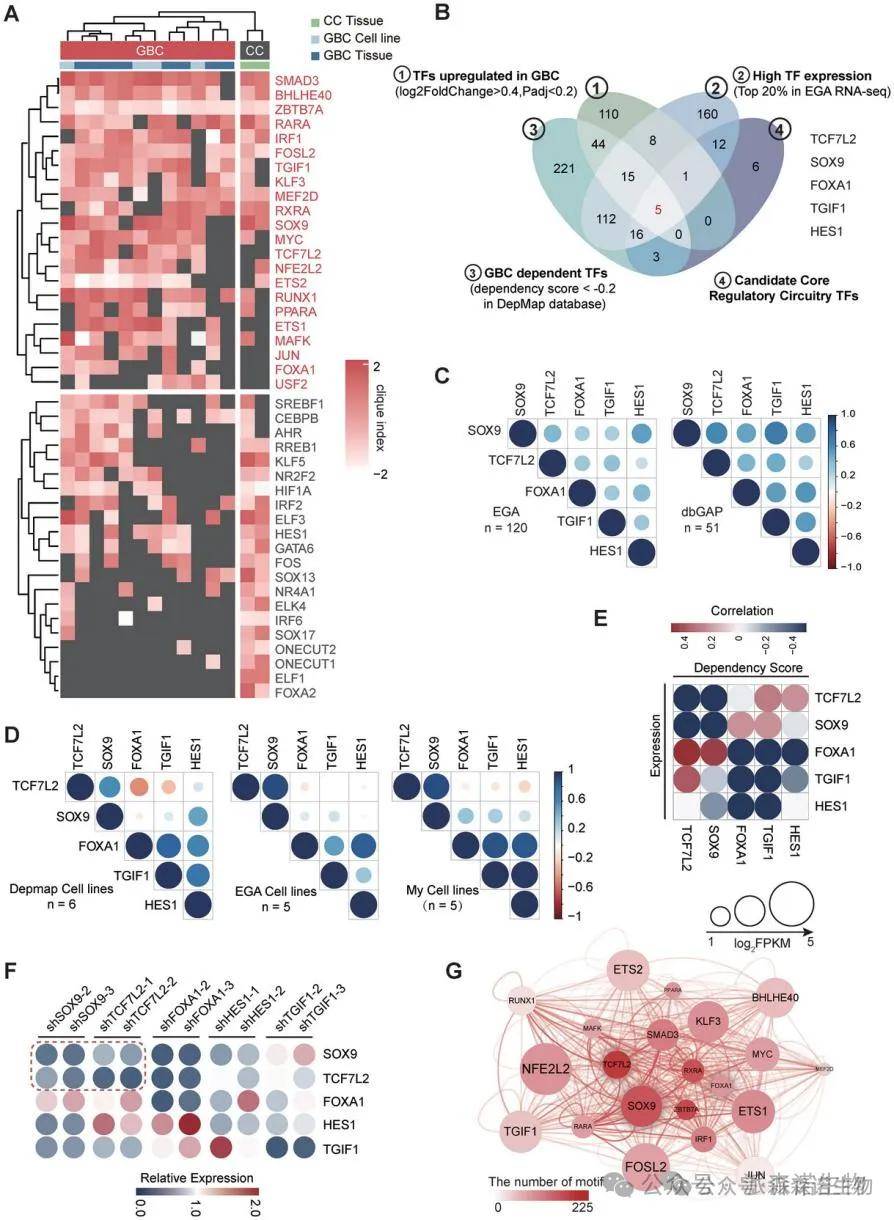
为了识别在胆囊癌中调控表观遗传重编程的核心调控因子,我们使用“Coltron”算法分析胆囊癌和对照样本的超级增强子特征,最终确定了43个胆囊癌候选核心转录因子,其中SOX9和TCF7L2表现出相互转录依赖性。SOX9和TCF7L2在胆囊癌中的表达水平与H3K27ac信号强度显著相关,表明它们可能构成胆囊癌中的关键超级增强子驱动胆囊癌的发生发展。
3.胆囊癌中SOX9和TCF7L2的超级增强子自我调控与相互调控机制
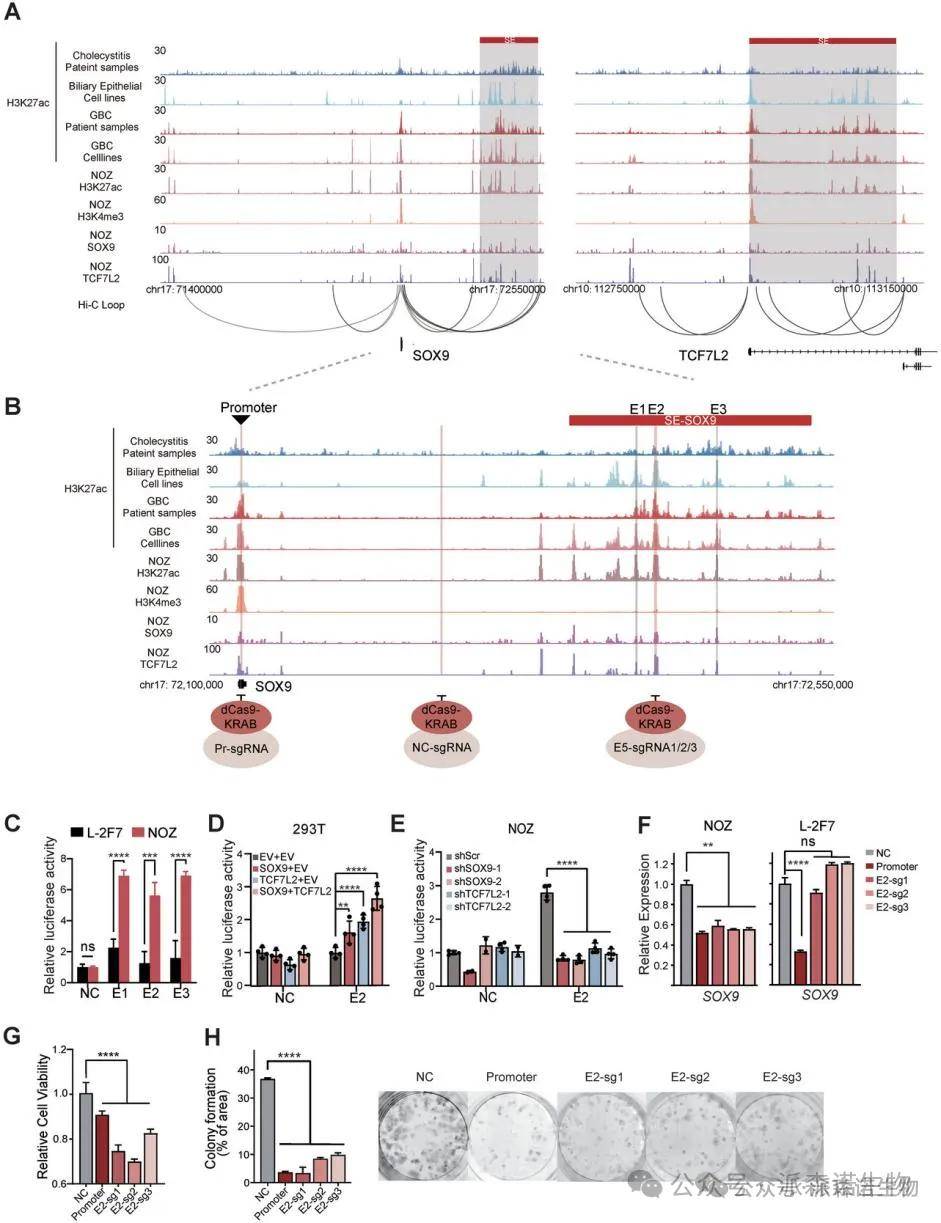
为阐明SOX9与TCF7L2之间的转录调控机制,我们采用了CUT&Tag技术以映射其在双高表达NOZ细胞中的基因组占据情况。结果显示,两者共同占据了各自的启动子及超级增强子,形成相互自我调控的环路。对SOX9和TCF7L2超级增强子区域的特征分析表明,SOX9的增强子E2在NOZ细胞中展现出显著的活性,且SOX9与TCF7L2的共同过表达进一步增强了该活性。使用CRISPR干扰系统靶向E2显著降低了SOX9的表达,并抑制了GBC细胞的增殖,而对SOX9启动子的靶向则在两种细胞系中均抑制了其转录。
4.SOX9与TCF7L2在胆囊癌中协同调控超级增强子驱动的转录失调
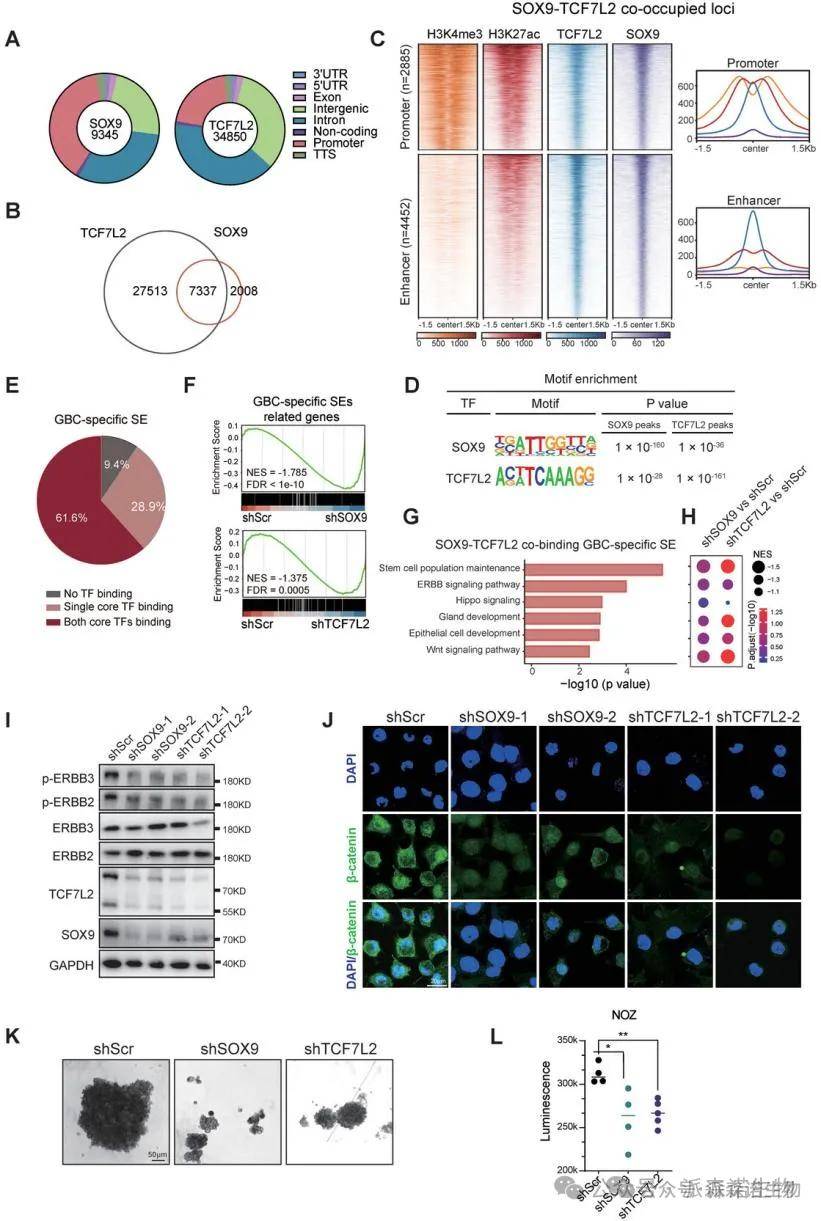
我们的研究表明,SOX9与TCF7L2形成的核心调控回路通过共同占据胆囊癌特异性超级增强子区域,驱动与发育谱系和恶性基因相关的转录失调。在NOZ细胞中,我们识别出大量SOX9和TCF7L2的结合位点,其中61.6%的超级增强子与两者重叠。抑制SOX9或TCF7L2显著降低了相关基因的转录水平,并影响了ErbB和Wnt信号通路及干细胞标记基因的表达。这些结果强调了SOX9和TCF7L2在GBC转录重编程中的重要作用。
5.SOX9和TCF7L2表达水平较高的肿瘤细胞亚群富含胆囊癌特异性超级增强子基因特征,并且与较差的预后显著相关
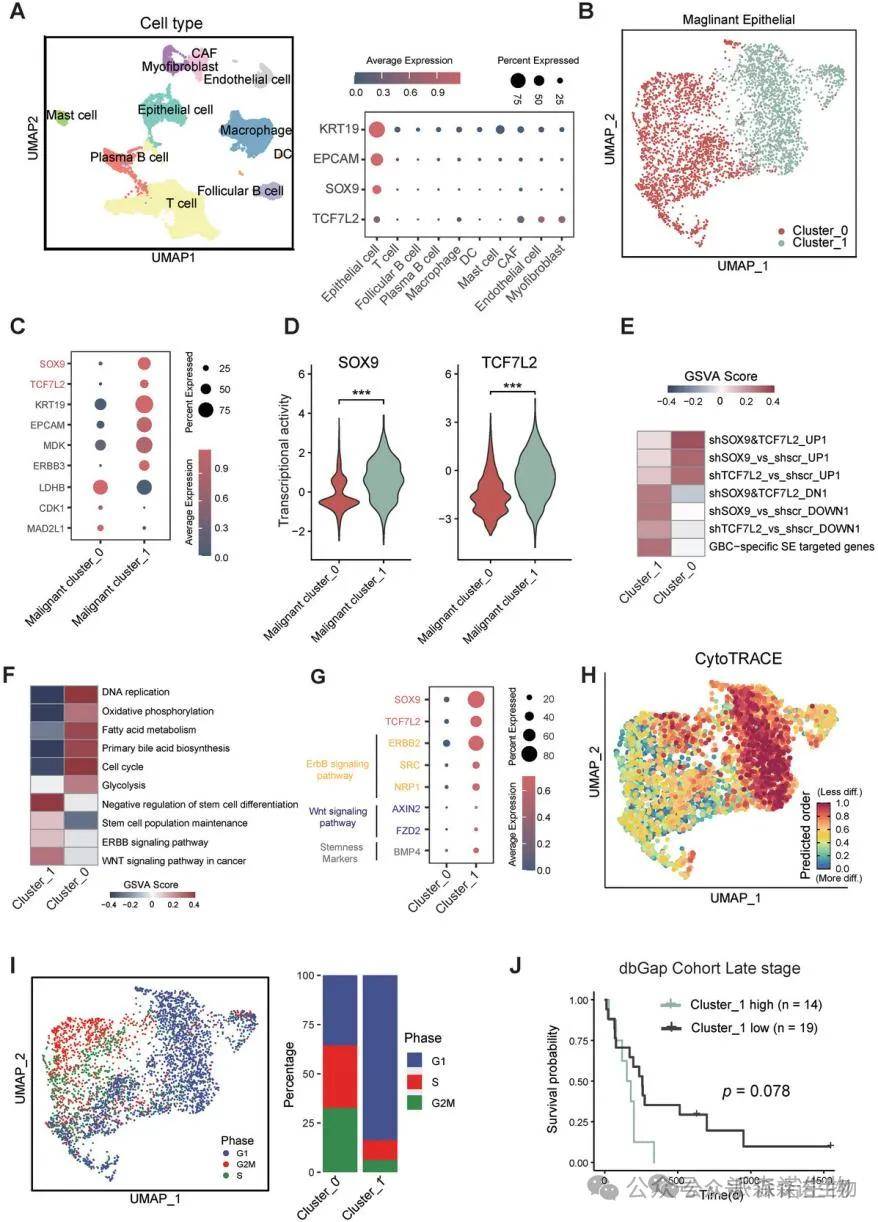
我们的单细胞转录组分析显示,SOX9和TCF7L2双高表达的肿瘤细胞富含胆囊癌特异性超级增强子基因特征,并与较差的预后相关。通过对单细胞RNA测序数据的再处理,我们识别出两种肿瘤细胞亚群,其中“Cluster_1”表现出更高的SOX9和TCF7L2表达水平,以及与干细胞维持、ErbB和Wnt信号通路相关的基因特征。这些结果强调了SOX9-TCF7L2双高细胞在胆囊癌中的致恶性作用。
6.SOX9和TCF7L2的表达与胆囊癌的预后相关
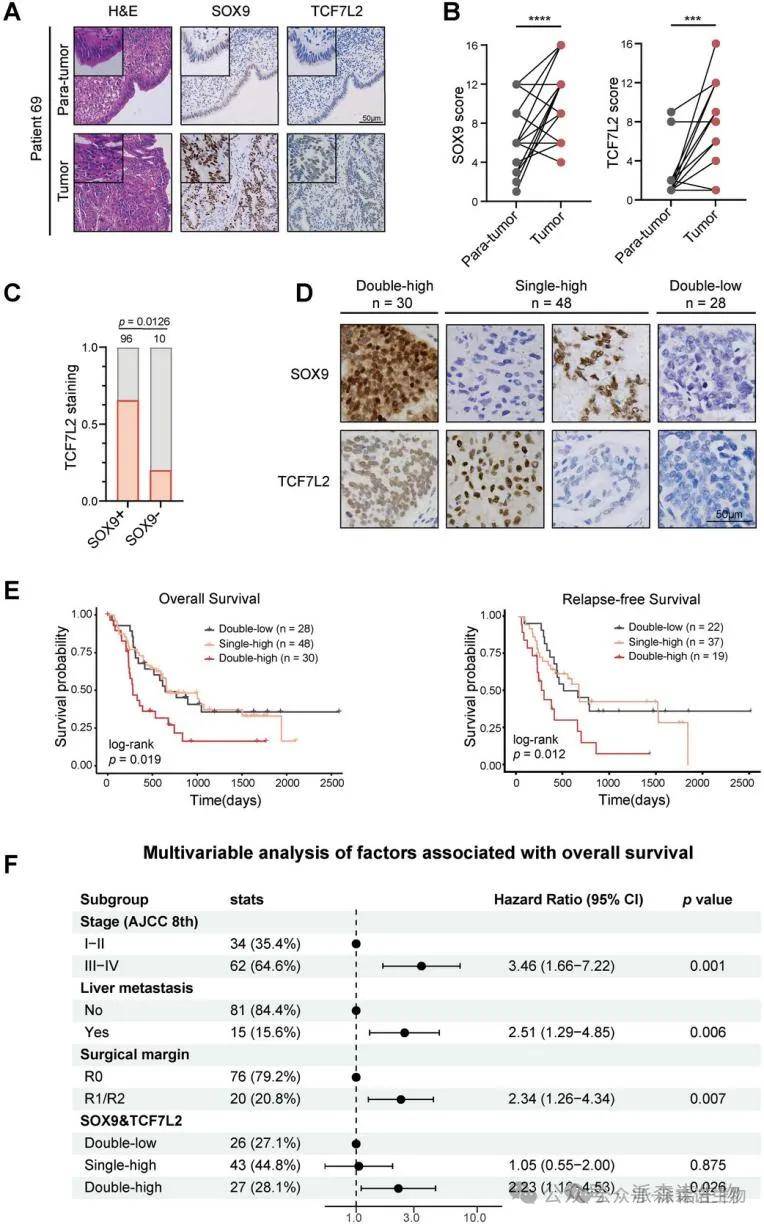
为了验证SOX9和TCF7L2在胆囊癌中的潜在预后作用,在扩展的临床队列中通过免疫组化分析评估了两个基因的表达。结果显示,这两个转录因子在肿瘤组织中的表达显著高于配对的肿瘤旁组织。尽管SOX9和TCF7L2的表达与其他临床病理因素未显示显著关联,但较高的表达水平与较差的总体生存和无复发生存显著相关。多变量分析进一步确认,SOX9和TCF7L2的表达独立地与总体生存期显著相关,强调了它们在临床分层中的重要性。
7.SOX9与TCF7L2双高表达的胆囊癌模型在体内和体外均对显示出对超级增强子的CDK7抑制治疗展现出显著的敏感性
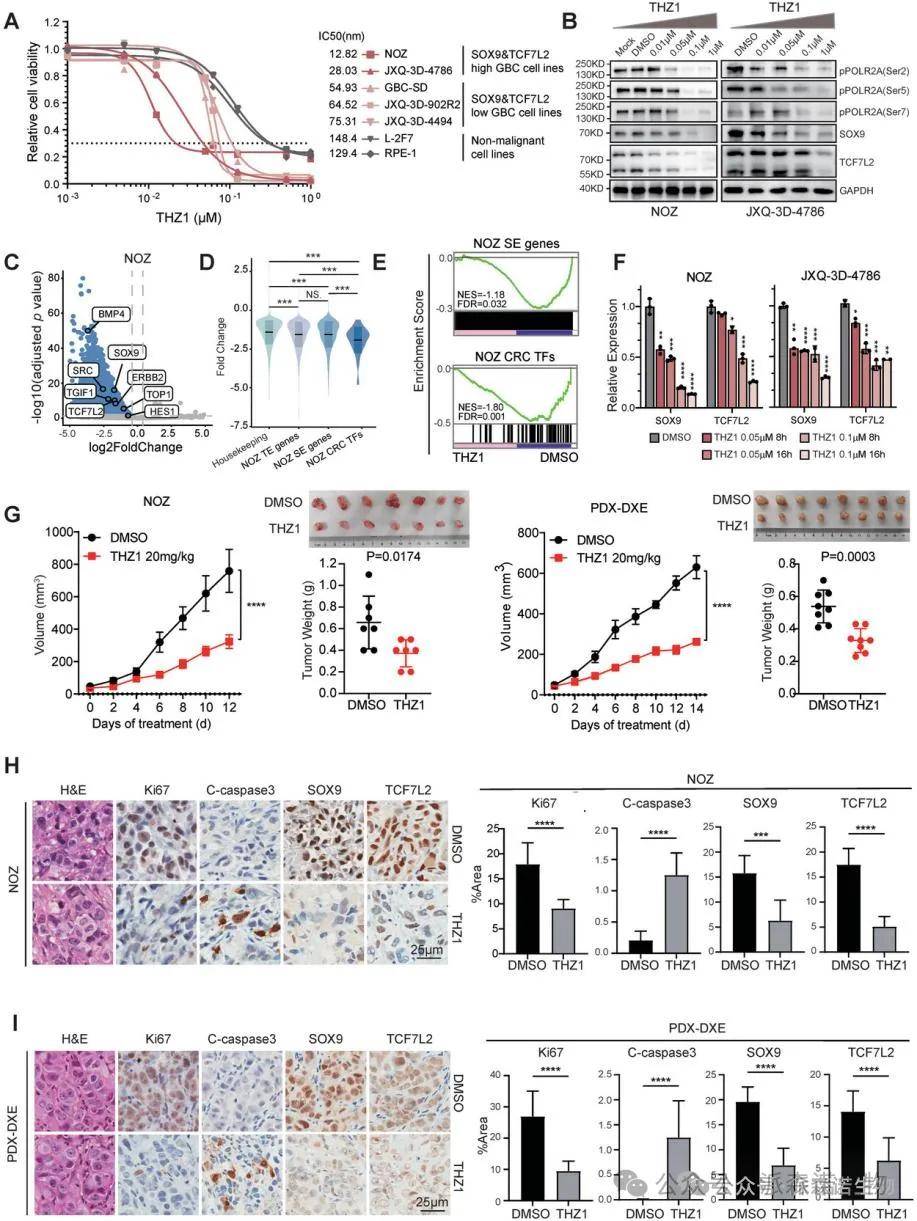
研究表明,SOX9与TCF7L2双高表达的胆囊癌模型在体内和体外对针对超级增强子的CDK7抑制治疗表现出显著敏感性。全基因组CRISPR筛选和体外药物敏感性测试结果均显示,CDK7抑制剂THZ1有效抑制了多种胆囊癌细胞系中的超级增强子驱动转录。进一步的体内实验验证了THZ1的治疗效果,显著降低了肿瘤负担。这些发现为治疗较为严重的胆囊癌提供了新的有效策略。
文章总结
本文分析了多种胆囊癌组织和细胞系样本中的H3K27ac分布,建立了超级增强子的全景图及其核心调控网络。研究发现,胆道谱系因子SOX9与Wnt通路效应因子TCF7L2共同占据对方的超级增强子区域,形成相互自我调控的环路,从而驱动胆囊癌中的肿瘤发生性超级增强子重编程。SOX9/TCF7L2双高表达的胆囊癌细胞对这两种转录因子高度依赖,富含与stemness、ErbB和Wnt通路相关的基因特征,且这类患者预后显著较差。此外,SOX9/TCF7L2双高表达的前临床模型在体内和体外对CDK7抑制治疗表现出敏感性。本研究为部分预后较差的胆囊癌的肿瘤发生机制提供了新见解,并为未来临床试验中的预后分层和治疗策略指明了方向。