
2025-06-17

文章题目:Proteogenomic characterization of non-functional pancreatic neuroendocrine tumors unravels clinically relevant subgroups
中文标题:多组学+类器官揭示无功能胰腺神经内分泌肿瘤的四类分子亚型及其靶向治疗策略
发表期刊:Cancer Cell
影响因子:48.8
发表时间:2025年
研究对象:人、小鼠
涉及组学:WES、RNA-seq、TMT蛋白组及TMT磷酸化蛋白组
样本类型:发现集:108份胰腺神经内分泌瘤/癌样本及其配对的正常组织
验证集:51份临床FFPE样本+小鼠类器官
研究背景
胰腺神经内分泌瘤(PanNETs)是胰腺第二大常见肿瘤,其发病率和患病率在过去四十年中显著增加,其中约有90%的患者为无功能性(NF-PanNETs)。这类肿瘤患者大约有一半在确诊时已发生转移(主要转移到肝脏),中位生存期仅为23个月。且根治术后,PanNET患者在胃肠胰神经内分泌瘤中最早复发,在临床上缺乏有效预测预后的分子标志物。目前,患者术后是否需要辅助治疗和随访周期不确定。此外,现有药物治疗方案,包括包括生长抑素类似物、酪氨酸激酶抑制剂、哺乳动物雷帕霉素靶蛋白抑制剂及化疗药物等,多数仅能改善无进展生存期,对总体生存期的改善有限。因此,迫切需要对NF-PanNETs的分子机制进行深入研究。
研究思路
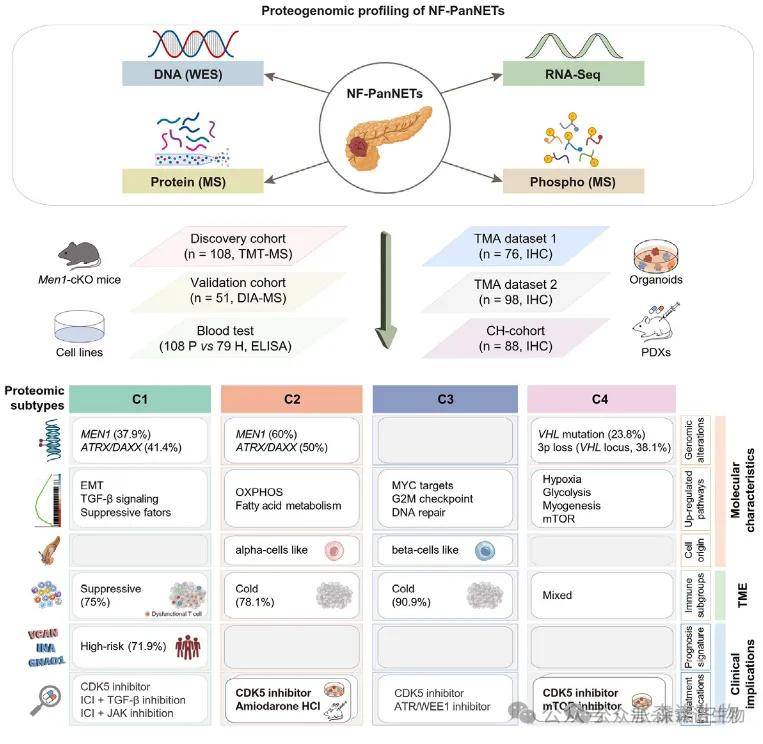
步骤一:研究收集108例中国的NF-PanNET病例作为发现队列,对肿瘤组织及配对癌旁组织进行了全面的多组学分析。一组独立的51例NF-PanNET病例被用作验证队列。
步骤二:蛋白质基因组学分析为NF-PanNETs的基因组驱动变异提供了功能学阐释,并利用Men1条件性基因敲除小鼠揭示了MEN1变异潜在的作用机制。
步骤三:基于机器学习的模型构建发现了一个三蛋白标志物可作为独立预后因子,并在独立外部队列中得到验证。
步骤四:基于蛋白质组和磷酸化蛋白质组的分层分析鉴定出四种亚型,各具独特分子特征、免疫微环境及临床病理学特性。
步骤五:通过患者来源肿瘤类器官药物筛选,发现细胞周期依赖性激酶(CDK)5和钙电压门控通道亚基α1D(CACNA1D)分别为广谱性和亚型特异性治疗靶点,且在小鼠异种移植模型中完成体内验证。
研究内容
01、中国NF-PanNET的蛋白质组-基因组图谱
研究收集了108例中国的NF-PanNET病例作为发现队列,对肿瘤组织及配对癌旁组织的进行了全面的多组学分析。一组独立的51例NF-PanNET病例被用作验证队列,单独进行蛋白质组分析(图A)。
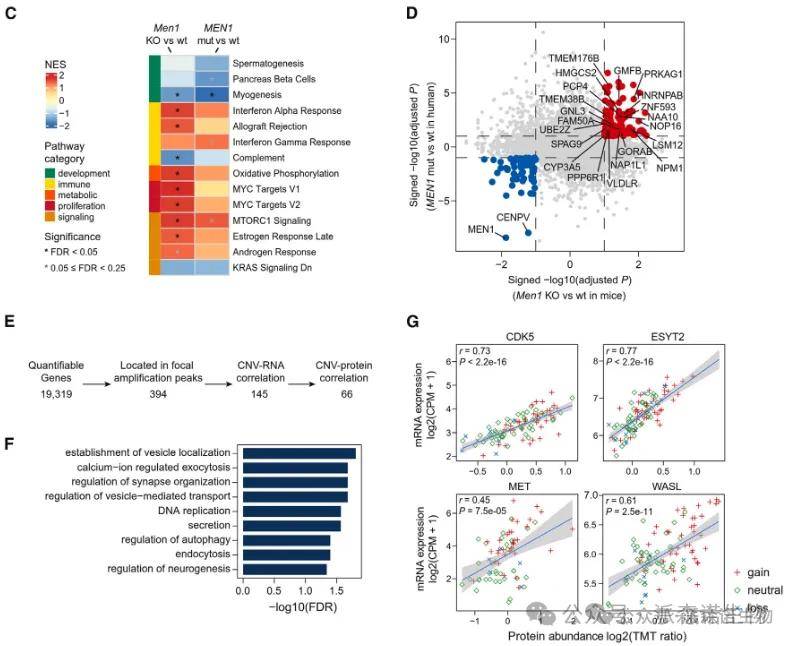
在发现队列中的WES数据中,MEN1、ATRX、DAXX和VHL基因突变频率较高,这与以前的基因组研究相似。除了这四个频繁突变的基因外,在mTOR通路的多个负调节因子中发现了非沉默突变,包括PTEN、TSC1和TSC2和染色质重塑基因(图B)。
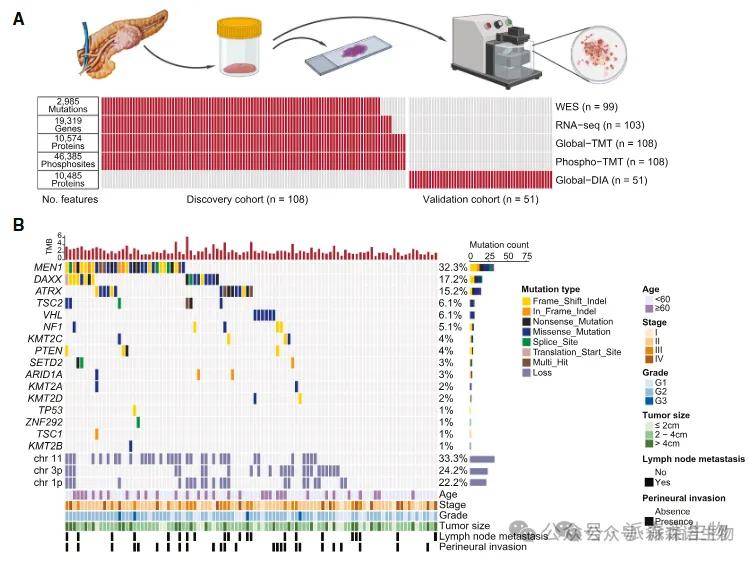
转录、蛋白联合分析发现,神经内分泌标志物,包括突触素(SYP)、嗜铬粒蛋白-A(CHGA)、γ-烯醇化酶(ENO2)和CD56(NCAM1)在肿瘤中显著升高(图C)。
GSEA分析也分别强调了肿瘤中上调途径活性的一致性,包括癌症相关途径和与内分泌功能相关的途径。其中参与缺氧、糖酵解和上皮-间质转化(EMT)的分组显示出最高的mRNA-蛋白质相关性(图E)。
02、PanNET体细胞驱动基因变异的蛋白质组-基因组效应
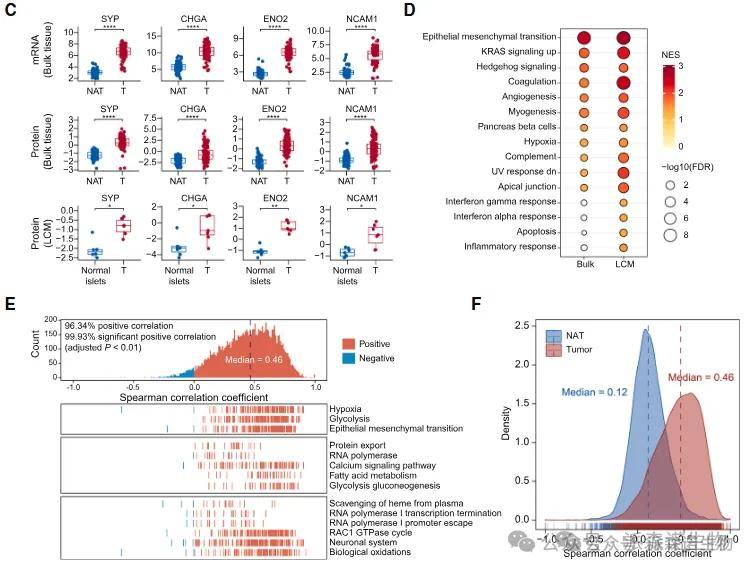
分析NF-PanNET中三种最常见的突变基因(MEN1、DAXX和ATRX,占总患者的51%)的体细胞简单突变对其对应mRNA、蛋白表达和磷酸化水平的影响(顺式效应),以及对与PanNET相关通路中其他基因的影响(反式效应)。
在mRNA/蛋白表达水平(图A)和磷酸化水平(图B)上均发现了显著的顺式与反式效应配对。
在反式效应方面,MEN1或DAXX/ATRX(任一)突变显著关联于多个mTOR信号通路中上下游基因的表达上调,例如上游的WNT4、WNT5、WNT7B,以及下游的PRKCA(图A),同时还伴随着染色质重塑相关基因(如CENPV和NPM2)表达的下调。
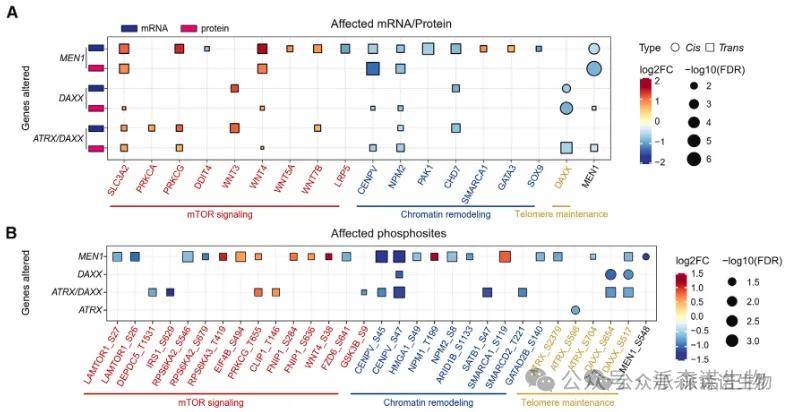
MEN1、DAXX和ATRX基因突变通过干扰染色质结构稳定性和激活mTOR通路驱动肿瘤恶性演进的机制,并通过MEN1基因条件性敲除小鼠模型验证了MEN1缺失触发代谢重编程和增殖信号交叉激活的恶性循环,从而导致染色体分离至关重要的CENPV蛋白下调。
随后通过SCNA的顺式、反式效应分析发现,WASL、CDK5等基因的拷贝数扩增被发现为NF-PanNET肿瘤生长的驱动因素,为靶向治疗提供了全新方向。
03、发现用于NF-PanNET预后预测的蛋白质组特征
基于蛋白质组数据,利用前期研发的预后分子特征平台筛选出GNAO1、INA、VCAN三个蛋白质,构建了预后标志物特征谱。
三蛋白模型在区分高风险与低风险患者方面表现优于任何单个蛋白。
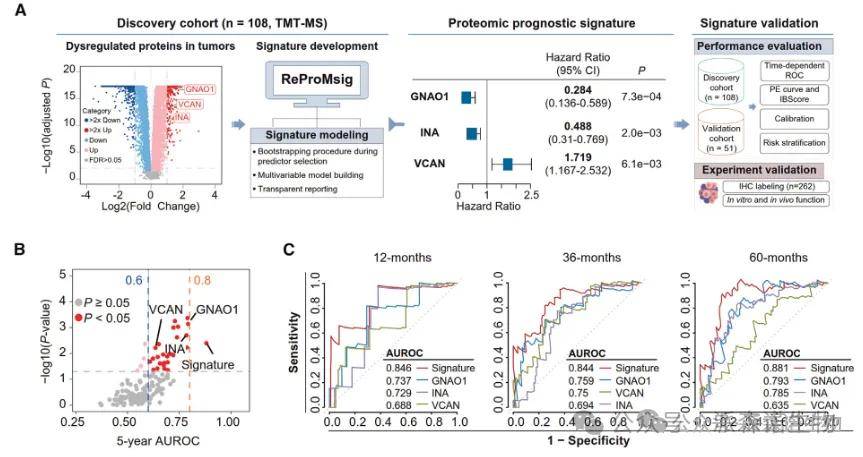
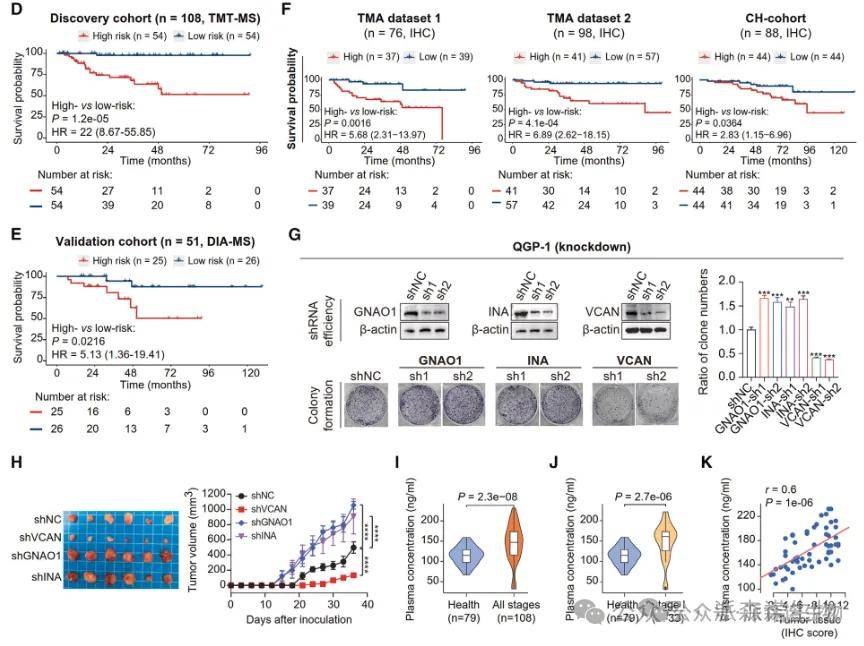
三蛋白模型在包含345例患者的四组独立队列中均展现出优良的预测效能和区分效果:高危患者五年生存率仅为51.4%,而低危组则高达97.8%。
此外,研究团队还证实分泌蛋白VCAN在患者血浆中的浓度与肿瘤进展显著相关,并在额外队列中通过ELISA加以证实,表明VCAN有作为NF-PanNETs的非侵入性生物标志物的潜力。
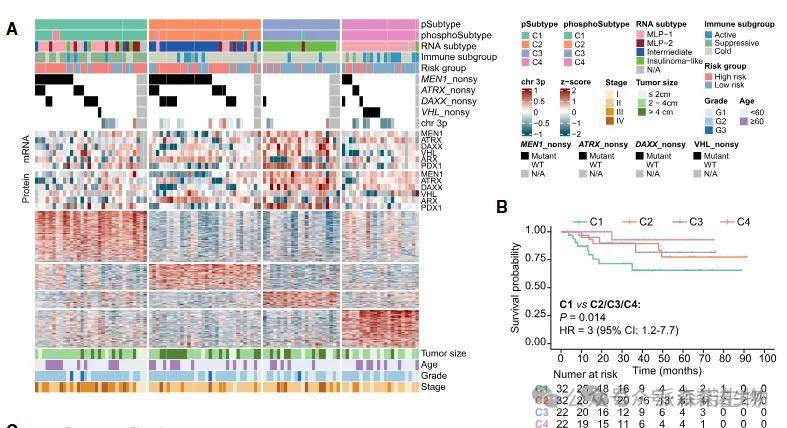
04、蛋白质组分子分型
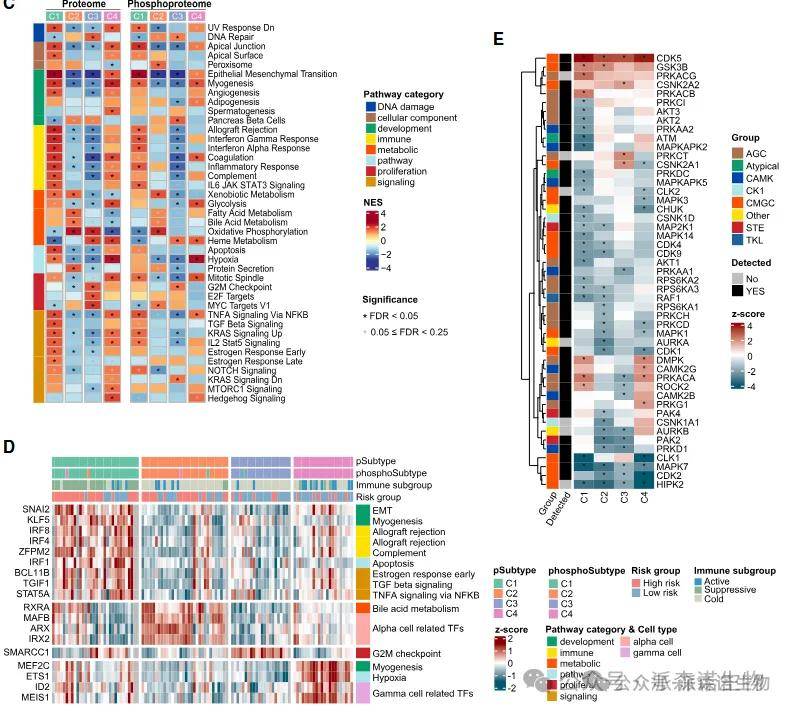
通过无监督聚类应用于蛋白质组图谱的发现队列,在108例NF-PanNETs患者中确定了四种蛋白质组学亚型。这些亚型与患者预后和免疫特征相关,
其中C1患者预后最差,其肿瘤特征是免疫抑制微环境和EMT通路激活;
C2亚型表现出异常活跃的氧化磷酸化活性;
C3亚型由MYC异常激活和失控的细胞周期信号主导;
C4亚型则在VHL突变驱动下形成独特的缺氧生态。
进一步通过蛋白质组、磷酸化蛋白质组数据进行激酶底物分析,根据各亚型特异激活的蛋白激酶和表达/活性上调蛋白,鉴定出普遍存在和亚型特异性激酶激活。
其中CDK5在所有亚型中均表现出显著激活,它被称为神经元发育的调节因子,而各个亚型中,C1显示蛋白激酶A的两个催化亚基(PRKACB和PRKACG)和ROCK2的独特激活,而C3显示CSNK2A1和CSNK2A2的特异性激活。C4表现出CAMK2G和RPKG1的独特激活。这些亚型相关的激酶激活为开发靶向治疗干预提供了潜在途径。
05、NF-PanNET免疫微环境特征分析
为进一步探索F-PanNETs的肿瘤微环境,通过使用代表免疫细胞浸润的基因特征进行了GSVA分析,根据其免疫评分区分了冷肿瘤组、热肿瘤组(进一步划分为免疫抑制亚组、免疫活性亚组)。
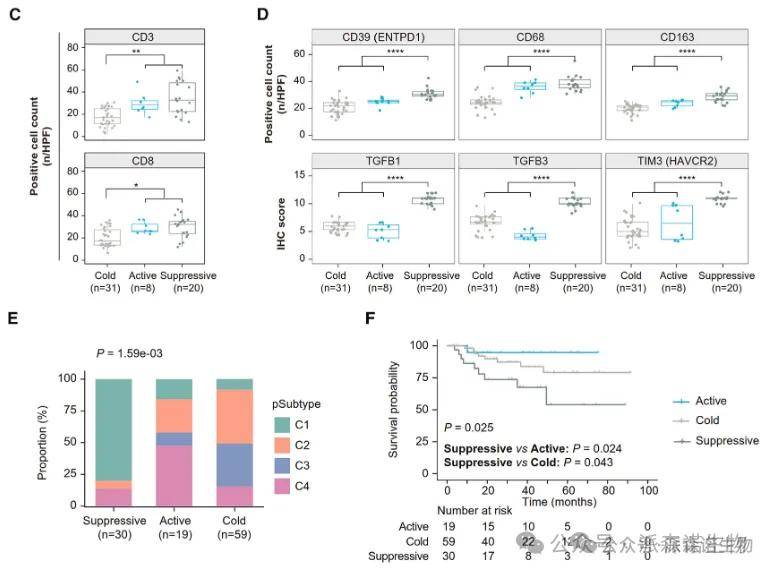
其中,热肿瘤中肿瘤浸润淋巴细胞的数量显著增加,IHC实验也证实了其T细胞浸润水平升高。
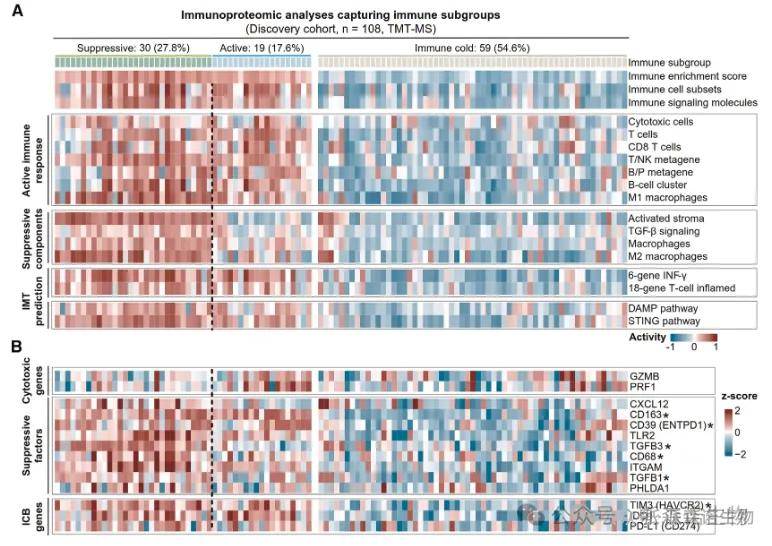
免疫亚型与四种蛋白质组学亚型和三种蛋白质特征定义的风险组显示出显著关联,如免疫抑制亚组富含高危患者和C1亚型。
不同免疫亚型之间存在显著的生存差异,其中免疫抑制亚组表现出更差的预后。
此外,抑制性免疫检查点,如PD-L1、IDO1和TIM3在免疫热肿瘤中显著升高,表明免疫疗法对该亚型的潜在益处。
06、与蛋白质组分子分型各亚型相关的分子失调的潜在治疗方案
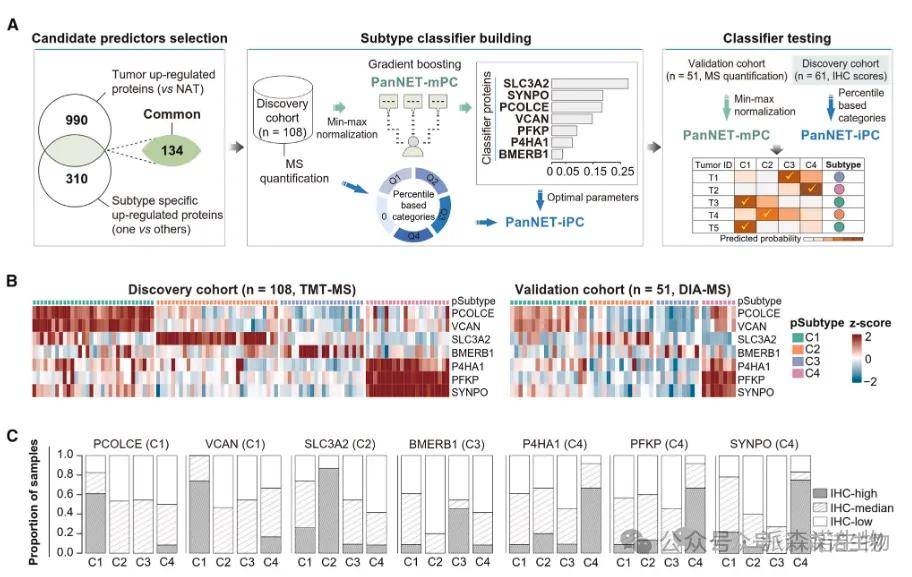
为了使蛋白质组亚型分析在临床中具有应用价值,研究团队开发并验证了两个多变量分类器,用于对新发NF-PanNET肿瘤进行精准分型,适应不同的分子检测平台:
PanNET-mPC模型:适用于基于质谱(MS)的蛋白质组分析;
PanNET-iPC模型:支持更贴近临床操作的IHC染色分析。
在发现队列(n=108)中筛选出7个关键分类蛋白。这些分类蛋白在肿瘤组织中相较于正常邻近组织均显著上调,且在不同亚型中表现出特异性表达模式,与此前定义的亚型特征一致:
C1亚型:上调EMT通路相关蛋白(VCAN和PCOLCE);
C2亚型:上调SLC3A2(与C2富集的MEN1突变相关);
C3亚型:上调BMERB1; C4亚型:上调糖酵解和缺氧相关蛋白(如PFKP)
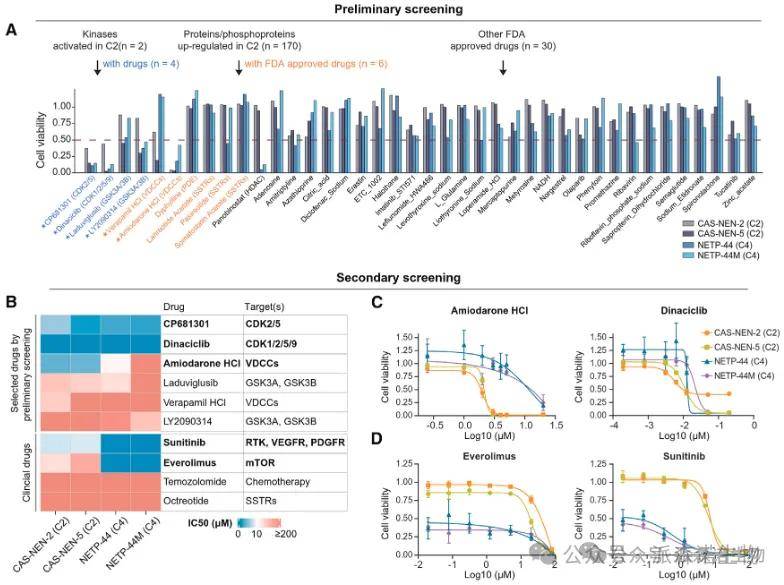
为验证前文提到的C1~4各个亚型中的特征激酶与潜在治疗靶点,研究团队利用患者来源类器官(PDO)开展了药物筛选并利用患者来源肿瘤异种移植模型(PDX)进行验证,证实CDK5抑制剂可抑制四种分子亚型的肿瘤生长;
钙离子通道阻滞剂(如心血管疾病经典药物盐酸胺碘酮)与CDK5抑制剂两药联用在C2亚型中表现出更好的抑瘤效果;
目前临床运用的mTOR抑制剂可较好抑制C4亚型肿瘤。
研究结果证明了靶向与蛋白质组学亚型相关的分子失调的潜力,有助于为NF-PanNETs患者开发精确有效的治疗方案。
研究结论
该研究对108例初治NF-PanNETs进行了全面的蛋白质基因组学分析,利用各种临床前模型进行功能研究,并在独立队列中进行验证。文章通过提出三蛋白预后特征并定义具有不同治疗意义的蛋白质组学亚型和免疫亚组,深入了解了频繁的基因组改变对NF-PanNETs表型变化和高级精准医学的影响。该文是国际上首次大规模对胰腺神经内分泌瘤临床队列开展的多组学综合分析,研究成果为无功能性胰腺神经内分泌瘤(NF-PanNET)的发病机制解析、预后预测、分子分型及个体化治疗提供了坚实的理论依据,有望推动胰腺神经内分泌瘤研究领域的加速发展。