
在癌症免疫治疗领域,错配修复缺陷 / 微卫星高度不稳定(dMMR/MSI-H)结直肠癌(CRC)对 PD-1 抑制剂(ICI)的响应机制一直是研究热点。《Cancer Cell》的一项研究通过单细胞 RNA 测序(scRNA-seq)技术,首次在单细胞分辨率下揭示了 PD-1 阻断后肿瘤微环境(TIME)的动态变化,为解析病理完全缓解(pCR)的机制提供了全新视角。

英文标题:Remodeling of the immune and stromal cell compartment by PD-1 blockade in mismatch repairdeficient colorectal cancer
中文题目:PD-1阻断对错配修复缺陷型结直肠癌免疫和基质细胞区室的重塑
期刊:Cancer Cell
影响因子:48.8
发表时间:2023-05-11
DOI号:10.1016/j.ccell.2023.04.011
Highlights
在PD-1阻断后,d-MMR/MSI-HCRC中会出现免疫和基质细胞的改变。
CD8+T细胞的细胞毒性及增殖程序的变化与反应相关。
ICI减少CD4+Treg并增加CD40+B细胞在完全反应性肿瘤中。
肿瘤促进性炎症的缓解与ICI反应相关。
研究思路
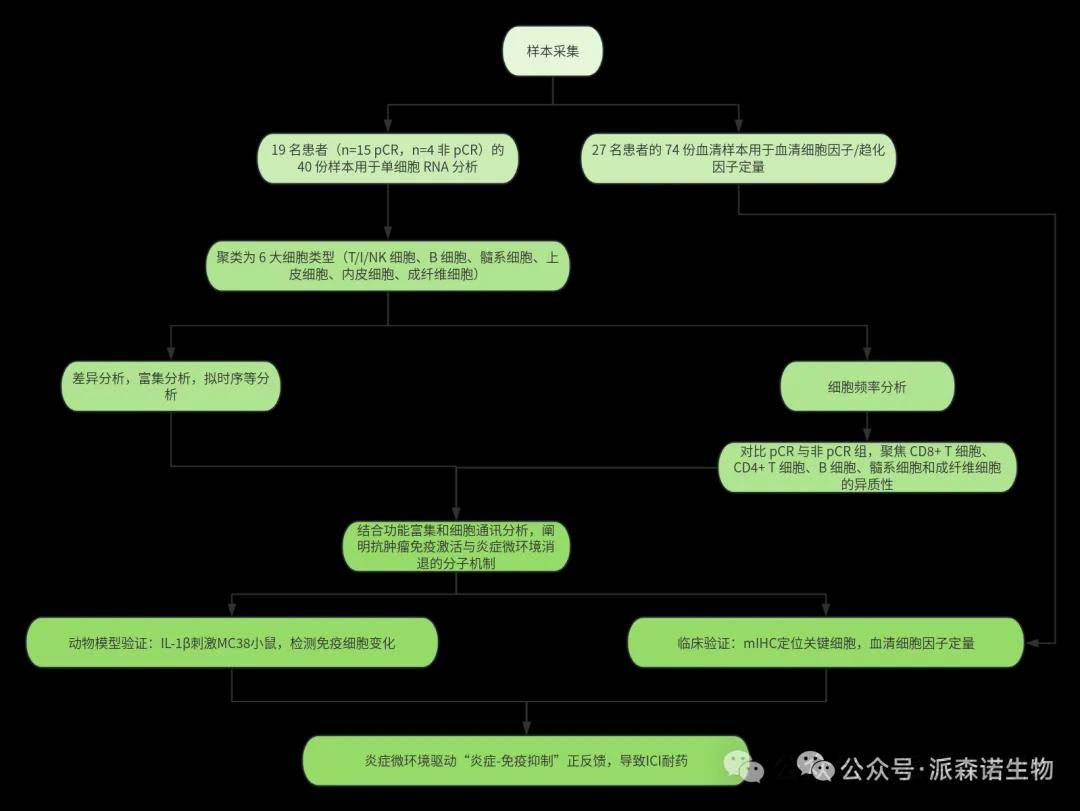
研究方法
1.样本采集
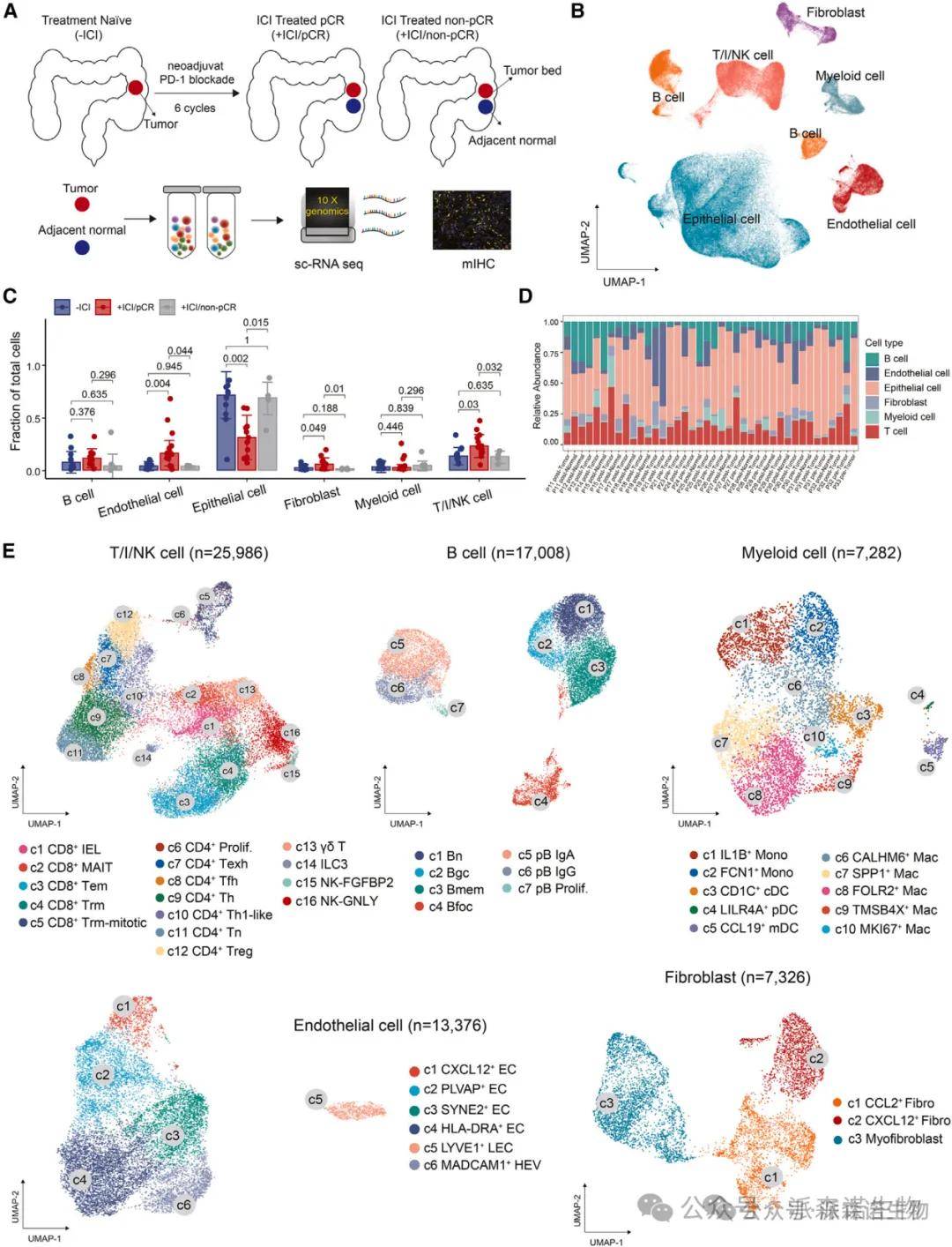
纳入 19 例接受新辅助 ICI 治疗的 dMMR/MSI-H CRC 患者,收集 40 份肿瘤及癌旁组织样本(治疗前 / 后)。临床终点:pCR 定义为术后无存活肿瘤细胞(n=15 pCR,n=4 非 pCR)。
2.单细胞测序
采用 10X Genomics 平台构建单细胞文库,测序后获得 155,397 个高质量细胞,聚类为 6 大细胞类型(T/I/NK 细胞、B 细胞、髓系细胞、上皮细胞、内皮细胞、成纤维细胞)。
3.多重免疫组化(mIHC)
验证关键细胞亚群(如 CD8+ T 细胞、IL1B + 单核细胞)的蛋白表达及空间分布。
4.功能分析
差异表达基因(DEG)分析、基因集富集分析(GSEA)、细胞间通讯分析(CellChat)、拟时序轨迹分析(Monocle2)。
5.小鼠模型验证
使用 MC38 荷瘤小鼠,通过 IL-1β 刺激模拟炎症微环境,分析免疫细胞变化。
结果与讨论
一、免疫与基质细胞群的全局重塑
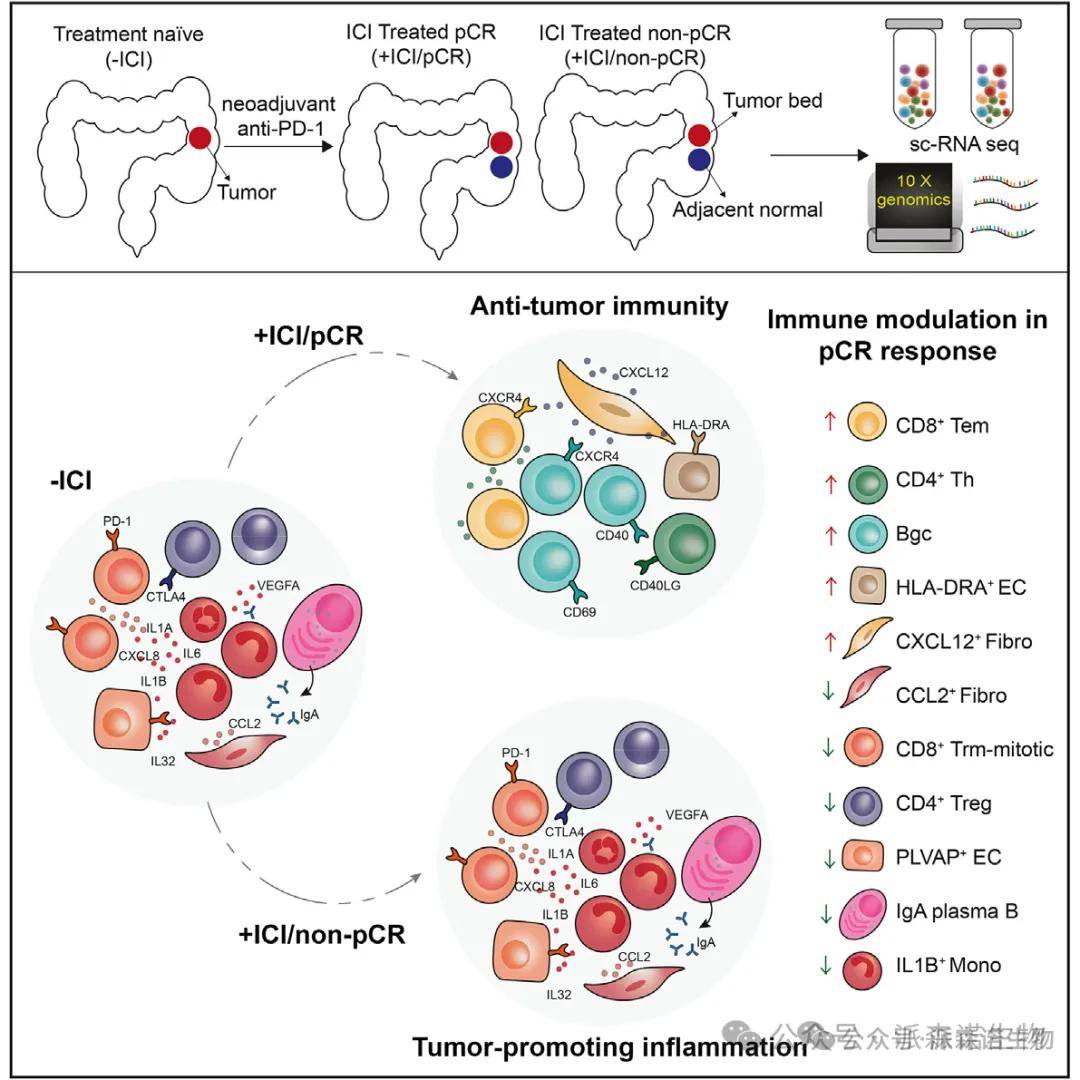
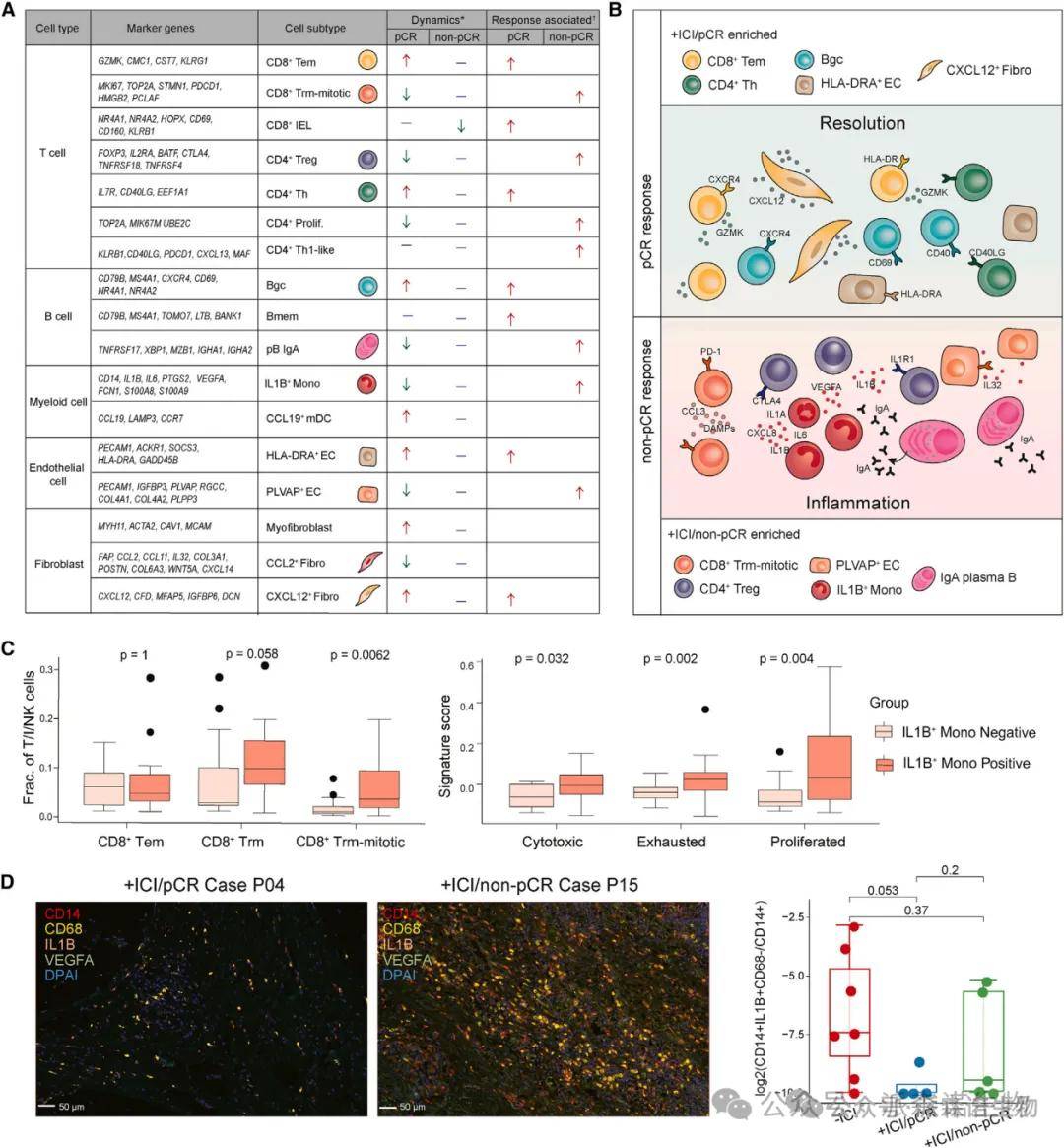
研究结果:对 19 例 dMMR/MSI-H CRC 患者的 40 份肿瘤及癌旁组织样本进行 scRNA-seq 分析,获得 155,397 个细胞的转录组图谱,鉴定出 6 大细胞类型:T/I/NK 细胞、B 细胞、髓系细胞、上皮细胞、内皮细胞和成纤维细胞。治疗后 pCR 组中,T/I/NK 细胞、成纤维细胞和内皮细胞比例显著增加(T/I/NK 细胞:p=0.030;成纤维细胞:p=0.049;内皮细胞:p=0.004),而非 pCR 组无明显变化。多重免疫组化(mIHC)验证了免疫细胞的密集浸润,与 scRNA-seq 结果一致。
结果说明:该图绘制了 ICI 治疗前后的细胞图谱,揭示 T 细胞和基质细胞在 pCR 中的关键作用。T/I/NK 细胞的增多提示抗肿瘤免疫激活,而成纤维细胞和内皮细胞的重塑可能为免疫细胞浸润提供结构支持和信号引导。非 pCR 组细胞比例无变化,暗示基质微环境的重塑是 pCR 的重要前提,为后续研究聚焦特定细胞亚群奠定基础。
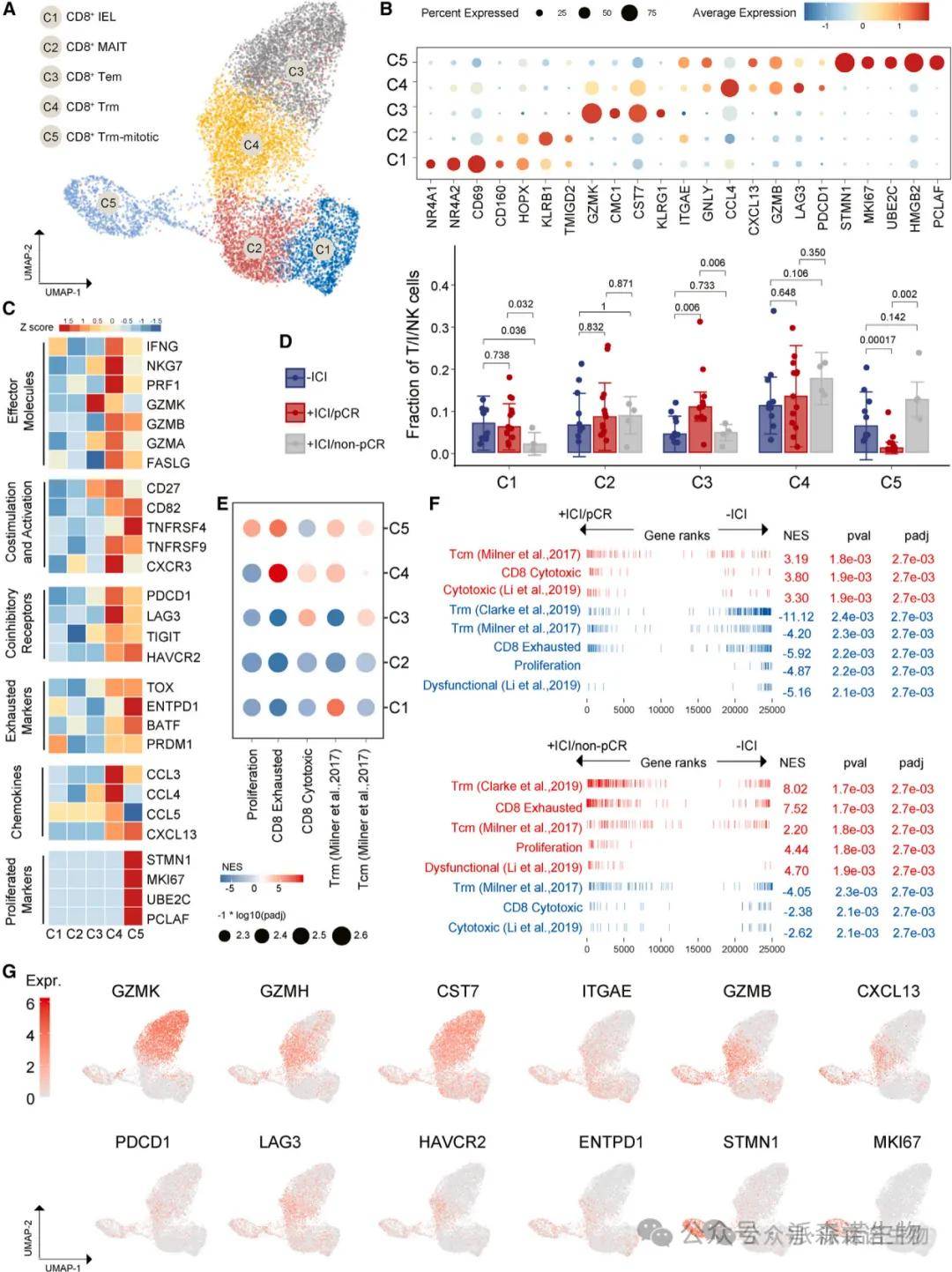
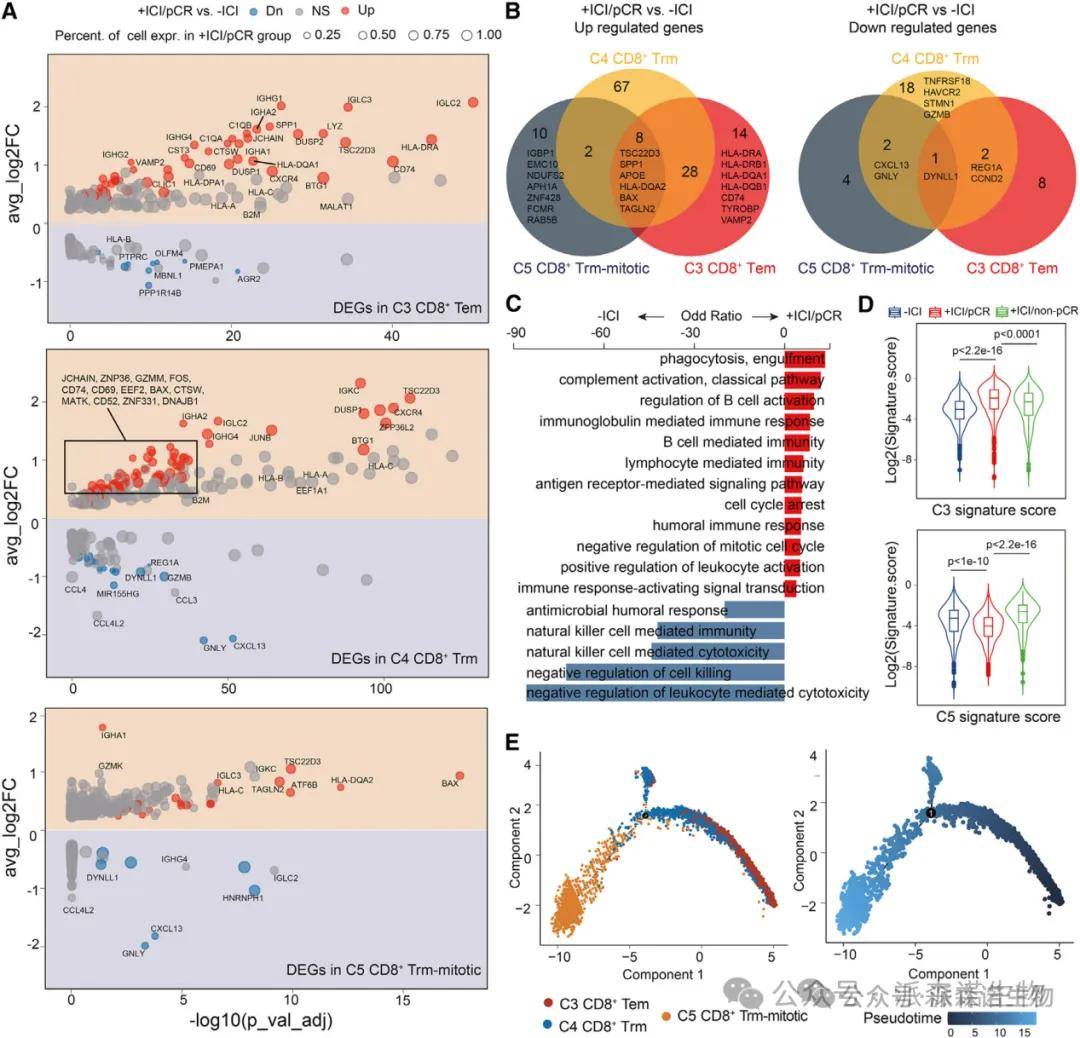
二、CD8+ T 细胞亚群的功能分化
研究结果:CD8+ T 细胞分为 5 个亚群:效应记忆 T 细胞(Tem)、组织驻留记忆 T 细胞(Trm)、增殖型 Trm(Trm-mitotic)、上皮内淋巴细胞(IEL)和黏膜相关 invariant T 细胞(MAIT)。pCR 组中 Tem 细胞比例显著增加(p=0.006),高表达细胞毒性基因(GZMB、IFNG、PRF1),富集 CD8 + 细胞毒性基因特征。非 pCR 组中 Trm-mitotic 细胞比例升高(p<0.001),高表达耗竭基因(PDCD1、TOX)和增殖基因(MKI67),富集 CD8 + 耗竭和增殖特征。
结果说明:该图揭示了 CD8+ T 细胞亚群的 “胜负手”:Tem 细胞作为 “攻击主力”,通过释放细胞毒性分子杀伤肿瘤细胞,其增多是 pCR 的关键标志;而 Trm-mitotic 细胞的增殖与耗竭状态可能导致免疫逃逸,是非 pCR 的重要机制。基因集富集分析(GSEA)显示,pCR 组 CD8+ T 细胞的细胞毒性程序激活,而非 pCR 组则偏向耗竭和增殖,直接解释了两组疗效差异的细胞基础。
三、CD8+ Trm 细胞的转录动态
研究结果:pCR 组中,CD8+ Trm 细胞(CD8-C4)的抗原呈递相关基因(HLA-DRA、HLA-DQA1)和 IFN-γ 响应基因(CD74)上调,提示其向 Tem 细胞转化。Trm-mitotic 细胞(CD8-C5)的增殖基因(MKI67、TOP2A)表达降低,且其耗竭特征(PDCD1、LAG3)高于 Trm 细胞。轨迹分析显示,CD8+ T 细胞亚群存在分化连续性,Tem 细胞可能由 Trm 细胞转化而来,而 Trm-mitotic 细胞是耗竭的终末状态。
结果说明:该图阐明了 ICI 诱导 CD8+ T 细胞功能重塑的机制:PD-1 阻断促进 Trm 细胞向 Tem 细胞转化,增强抗原呈递和细胞毒性;同时抑制 Trm-mitotic 细胞的增殖耗竭,恢复 T 细胞抗肿瘤功能。这一发现揭示了 CD8+ T 细胞亚群的动态平衡对 pCR 的重要性,为靶向 T 细胞分化提供了理论依据。
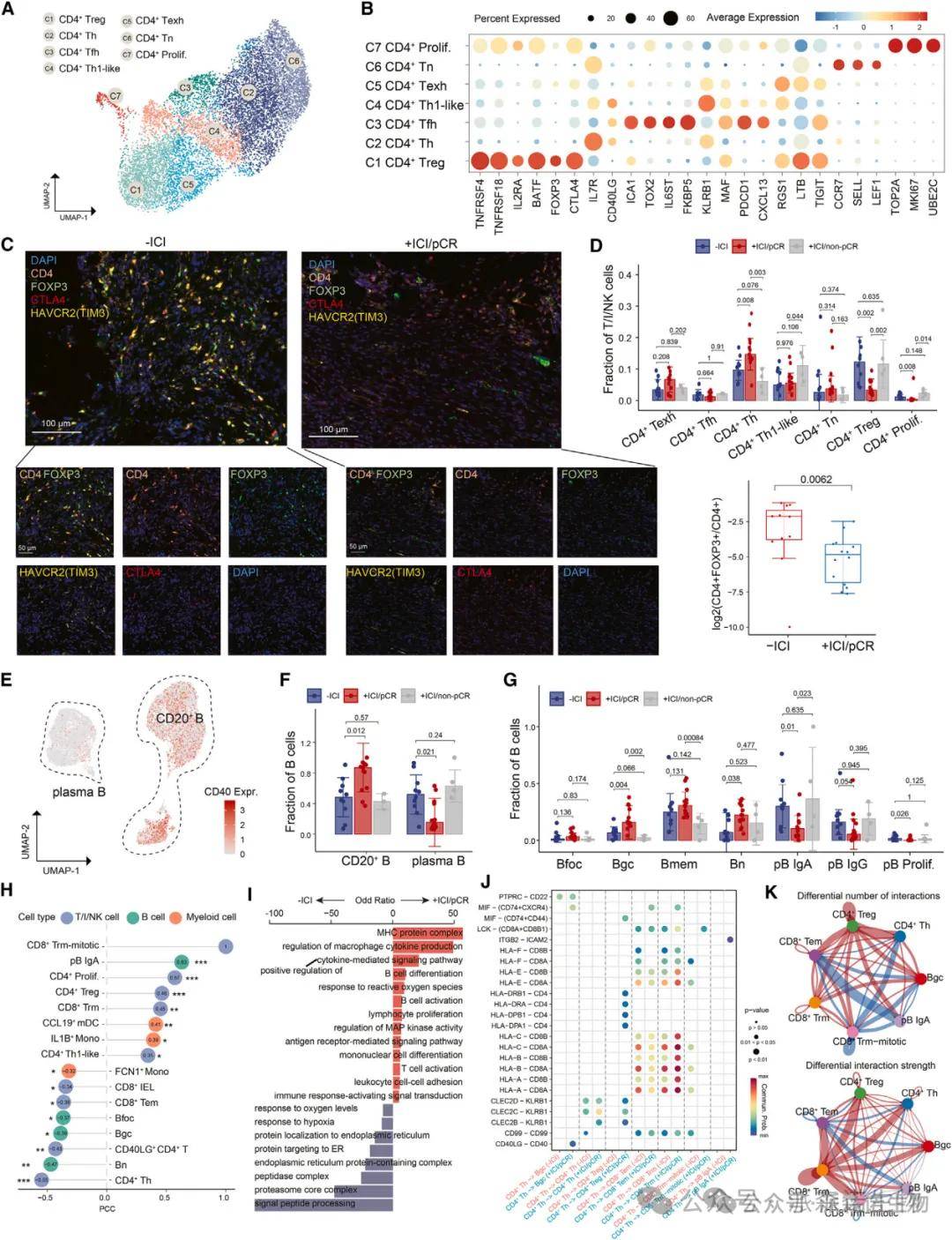
四、CD4+ T 与 B 细胞的协同激活
研究结果:pCR 组中,CD4 + 辅助性 T 细胞(Th)比例增加(p=0.008),调节性 T 细胞(Tregs)显著减少(p=0.002);Tregs 高表达免疫抑制受体(CTLA4、TIM3),其减少解除了免疫抑制。CD20+ B 细胞(尤其是生发中心 B 细胞 Bgc)比例显著升高(p=0.004),高表达 CD40,与 CD4+ Th 细胞的 CD40LG 形成信号轴。细胞互作分析显示,pCR 组中 CD40-CD40LG 信号强度显著增强,Bgc 细胞与 CD8+ T 细胞呈正相关。
结果说明:该图揭示了 pCR 中的 “免疫同盟” 机制:CD4+ Th 细胞通过 CD40LG 激活 B 细胞,促进抗体分泌和三级淋巴结构(TLS)成熟;Tregs 的减少解除抑制,共同构建抗肿瘤免疫微环境。这一协同效应在非 pCR 组中缺失,提示 CD40-CD40LG 轴是 ICI 响应的关键调控节点,可为联合治疗提供靶点。
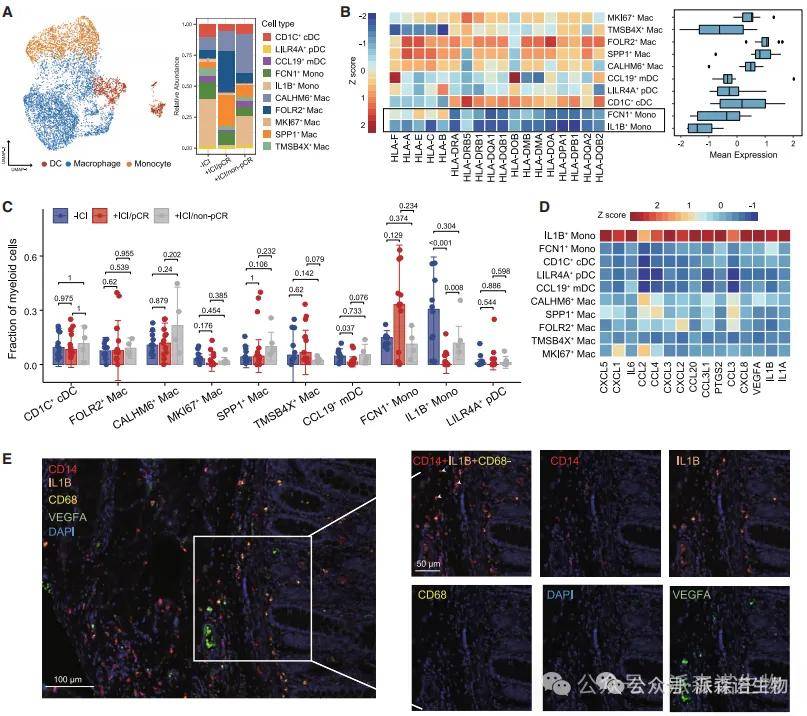
五、髓系细胞的促炎程序消退
研究结果:pCR 组中,促炎单核细胞(IL1B+ Mono)比例显著降低(p<0.001),其高表达的 IL1B、CXCL8 等促炎因子水平下降;非 pCR 组中 IL1B+ Mono 持续存在,富集促炎基因特征。mIHC 验证 IL1B+CD14 + 细胞在 pCR 组中减少,且血清促炎因子(IL1A、IL6、CCL20)水平降低。GSEA 显示,IL1B+ Mono 细胞的基因特征富集上皮 - 间质转化(EMT)通路,提示其促肿瘤作用。
结果说明:该图揭示了炎症微环境对 ICI 响应的双重影响:IL1B+ Mono 细胞的减少解除了 “促炎 - 免疫抑制” 正反馈,而其持续存在则通过炎症驱动肿瘤进展和免疫逃逸。这一发现解释了为何抗炎治疗可能增强 ICI 疗效,为靶向炎症通路(如 IL-1β)提供了机制支持。
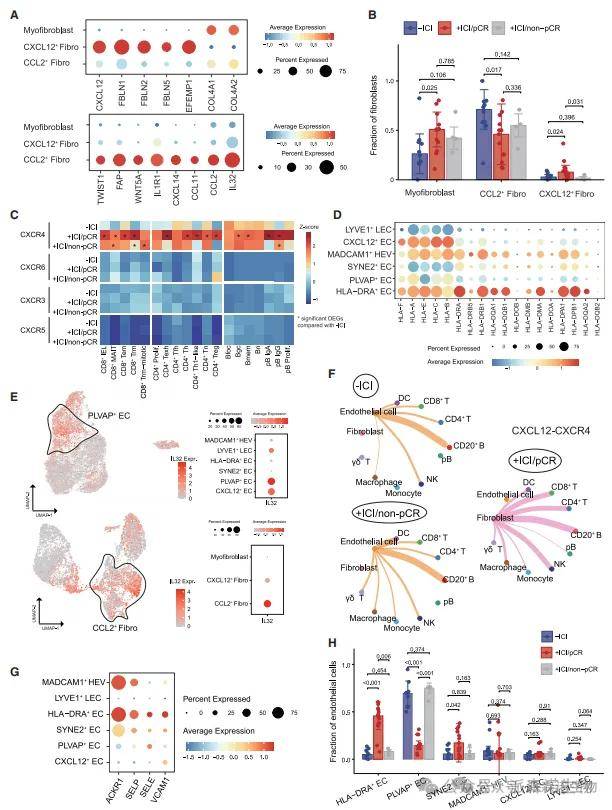
六、基质细胞的免疫导航作用
研究结果:pCR 组中,CXCL12 + 成纤维细胞和 HLA-DRA + 内皮细胞比例增加,分别高表达 CXCL12 和 MHC II 类分子;非 pCR 组中 PLVAP + 内皮细胞和 CCL2 + 成纤维细胞富集,高表达促炎因子 IL32。细胞互作分析显示,CXCL12 + 成纤维细胞通过 CXCL12-CXCR4 轴招募 T/B 细胞,HLA-DRA + 内皮细胞与 CD4+ T 细胞互作增强抗原呈递。基质细胞的基因特征与免疫细胞浸润程度呈正相关,提示其对 TIME 的塑造作用。
结果说明:该图阐明了基质细胞作为 “免疫导航员” 的功能:CXCL12 + 成纤维细胞引导免疫细胞迁移,HLA-DRA + 内皮细胞直接参与抗原呈递,共同构建 “免疫许可” 微环境。非 pCR 组中促炎基质细胞的富集,可能通过维持免疫抑制微环境导致耐药,为靶向基质 - 免疫互作提供了新思路。
七、炎症驱动的非 pCR 机制
研究结果:非 pCR 组中,IL1B+ Mono 细胞、CCL2 + 成纤维细胞、IgA 浆细胞和 Trm-mitotic 细胞显著富集,形成 “促炎 - 免疫抑制” 网络。这些细胞高表达 IL1B、CCL2、IL32 等促炎因子,与 CD8+ T 细胞耗竭和 Tregs 浸润呈正相关。小鼠模型中,IL-1β 刺激导致 CD8+ T 细胞和 CD40+ B 细胞减少,PD-1 + 耗竭 T 细胞增加,验证了炎症对免疫抑制的驱动作用。
结果说明:该图揭示了非 pCR 的核心机制:持续性炎症通过激活 IL1B+ Mono 和促炎基质细胞,抑制 T 细胞功能并维持免疫抑制微环境,导致 ICI 耐药。这一发现强调了 “抗炎 - 免疫激活” 联合策略的必要性,为克服 dMMR/MSI-H CRC 耐药提供了关键靶点。
八、机制总结与临床启示
(一)pCR 的核心机制
PD-1 阻断通过多维度重塑 TIME 诱导 pCR:T 细胞功能优化:促进 CD8+ Tem 细胞分化,增强细胞毒性;抑制 Trm-mitotic 细胞增殖耗竭。免疫调控网络重构:减少 Tregs 和促炎单核细胞,激活 CD40-CD40LG 介导的 B 细胞协同效应。基质微环境支持:CXCL12 + 成纤维细胞和 HLA-DRA + 内皮细胞招募并激活免疫细胞。
(二)临床转化方向
预测标志物:Tem/Trm-mitotic 比例、CD40+ B 细胞丰度、IL1B+ Mono 水平可作为 pCR 预测指标。
联合治疗策略:抗炎药物(如 IL-1β 抑制剂)与 ICI 联用,解除炎症抑制。激动剂激活 CD40-CD40LG 轴,促进 TLS 成熟。靶向 CXCL12-CXCR4 轴,增强免疫细胞迁移。
九、结语:单细胞时代的免疫治疗新范式
这项研究通过单细胞测序技术,如同 “细胞级 CT 扫描”,清晰勾勒出 ICI 诱导 pCR 的动态过程。从 CD8+ T 细胞的功能分化到基质细胞的免疫导航,每一个发现都为理解免疫治疗应答机制提供了钥匙。未来,基于单细胞图谱的精准治疗策略有望实现 “个体化免疫调控”,让 dMMR/MSI-H CRC 患者从 “敏感” 走向 “治愈”,为更多癌症类型的免疫治疗突破铺平道路。




















