
2025-06-23
文章题目:Wastewater-based analysis of antimicrobial resistance at UK airports: Evaluating the potential opportunities and challenges
期刊:Environment International
发表时间:2025年1月
研究背景
抗菌素耐药性(AMR)是重大全球公共卫生威胁,其细菌分布、丰度和多样性在地理区域之间存在显著差异,受到健康、社会经济和环境等一系列因素的影响,跨境旅行加速了 AMR 细菌全球传播,因此,迫切需要全面了解AMR病原体全球分布和国际传播的动力学。人类废水是 ARG 传播的环境库,不过各国 AMR 监测存在差异,实施有效全球监测有挑战。机场作为微生物群落聚集枢纽,基于废水的流行病学为全球 AMR 监测提供新方法。2024 年全球航空旅行或对 AMR 传播贡献重大,此前研究表明旅行者携带耐药细菌风险高,对飞机废水的研究显示其可反映不同地区 ARG 情况,还可能是 “外源性” AMR 细菌进入当地水循环的途径。目前对飞机废水的研究处于起步阶段,本研究旨在评估其在全球 AMR 监测中的效用,在英国三个国际机场多点采样,用高通量 qPCR 和宏基因组测序分析,这种双重方法既提供了已知抗性基因的靶向定量,又提供了对整个抗性组组成的更广泛视角。
研究思路
采样地点
在新冠肺炎大流行期间,对英国布里斯托尔机场、爱丁堡机场和伦敦希思罗机场的废水进行取样。研究期间,乘客入境英国不受限制,无论是否接种疫苗,未接种疫苗旅客抵达时也无需检测或隔离。现场废水取样由外部合作者与当地机场工作人员协调进行,希思罗机场、布里斯托尔机场、爱丁堡机场有限公司等三家机场公司授予采样授权。
样品采集和理化分析
2022 年 3 月 8 日至 31 日,从英国布里斯托尔、爱丁堡和伦敦希思罗机场共收集 158 个样本,同时测量废水电导率、pH 值、浊度、铵和正磷酸盐浓度。
布里斯托尔机场:从到达航站楼下水道检修口(BRS-A)、机场整体下水道检修口(BRS-WA)及入境飞机服务的真空卡车存放地检修口(BRS-IA)取样,自动取样器在每次废水排放事件采集单个样本,每个样本为 4-7 个入境航班废水混合物;
爱丁堡机场:从国际航站楼下水道检修口(EDI-T)、真空卡车存放地泵站(PS)及机场污水处理厂取样;
伦敦希思罗机场:从中央航站区下水道检修口(LHR-CT)及采样当天收集 10 架飞机废水的真空卡车(LHA-IA)取样。
废水DNA提取
废水样本在收集后储存在-80℃下,提取时解冻。使用改良的FastDNA™SPIN土壤试剂盒(MP Biomedicals,Santa Ana,CA)从颗粒中提取DNA。然后将100μl DNA提取物储存在-20℃下,备用。
高通量qPCR
HT qPCR检测共使用了96组引物,靶向ARG(76个基因)、移动遗传元件(MGE,10个基因)、病原体(5个基因)和5个其他基因,包括那些重金属抗性的基因和用于标准化的16S rRNA基因。这些靶点是根据威尔士公共卫生部专业抗菌化疗部门的建议选择的,包括广泛的临床相关ARG。将DNA提取物使用SmartChip™实时PCR系统进行基因定量。
宏基因组文库的构建和测序
对来自LHR-IA、LHR-CT和BRS-IA的30个废水样本的子集(表1)进行了宏基因组分析。
表1:布里斯托尔(BRS)、爱丁堡(EDI)和伦敦希思罗(LHR)机场废水取样情况。
序列数据的生物信息学分析
统计分析
研究结果展示
ARG的相对丰度
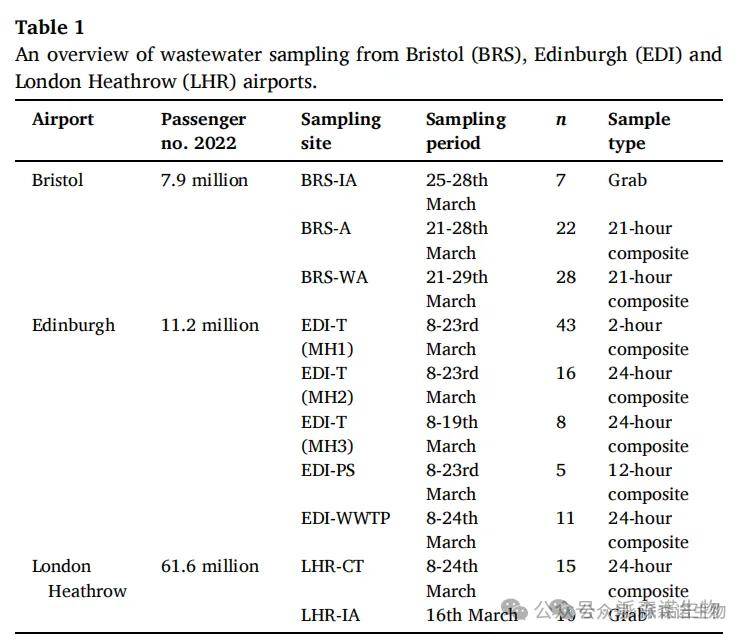
对于每个样本中的16S rRNA基因, 通过HT-qPCR技术对样本中ARG丰度定量发现(图1.A):
机场间差异:布里斯托尔机场(BRS)ARG平均总相对丰度显著高于爱丁堡(EDI)和伦敦希思罗机场(LHR)(单因素方差分析,p<0.01)。
样本类型差异:希思罗机场飞机废水样本(LHR-IA)ARG相对丰度显著高于航站楼样本(Welch t检验,p<0.05),布里斯托尔机场不同来源样本无显著差异;爱丁堡污水处理厂ARG相对丰度显著低于机场样本(Welch t检验,p<0.05)。
HT-qPCR分析
航站楼废水:大环内酯类、林可酰胺类和链菌素(MLS)抗性基因丰度高(图1.B)(与爱丁堡污水处理厂水平相近),布里斯托尔机场不同航站楼样本中,ermB(BRS-WA)和 mrsE(BRS-A)基因丰度差异显著(Welch t 检验,p<0.01)。
飞机废水:布里斯托尔和希思罗机场飞机废水样本中四环素抗性基因 tetM 丰度显著高于航站楼(Welch t 检验,p<0.01),MLS 抗性基因丰度更低(Welch t 检验,p<0.01);爱丁堡机场样本(EDI-PS)未呈现类似差异,其 qacF 基因(编码多药外排泵)丰度相对较高。
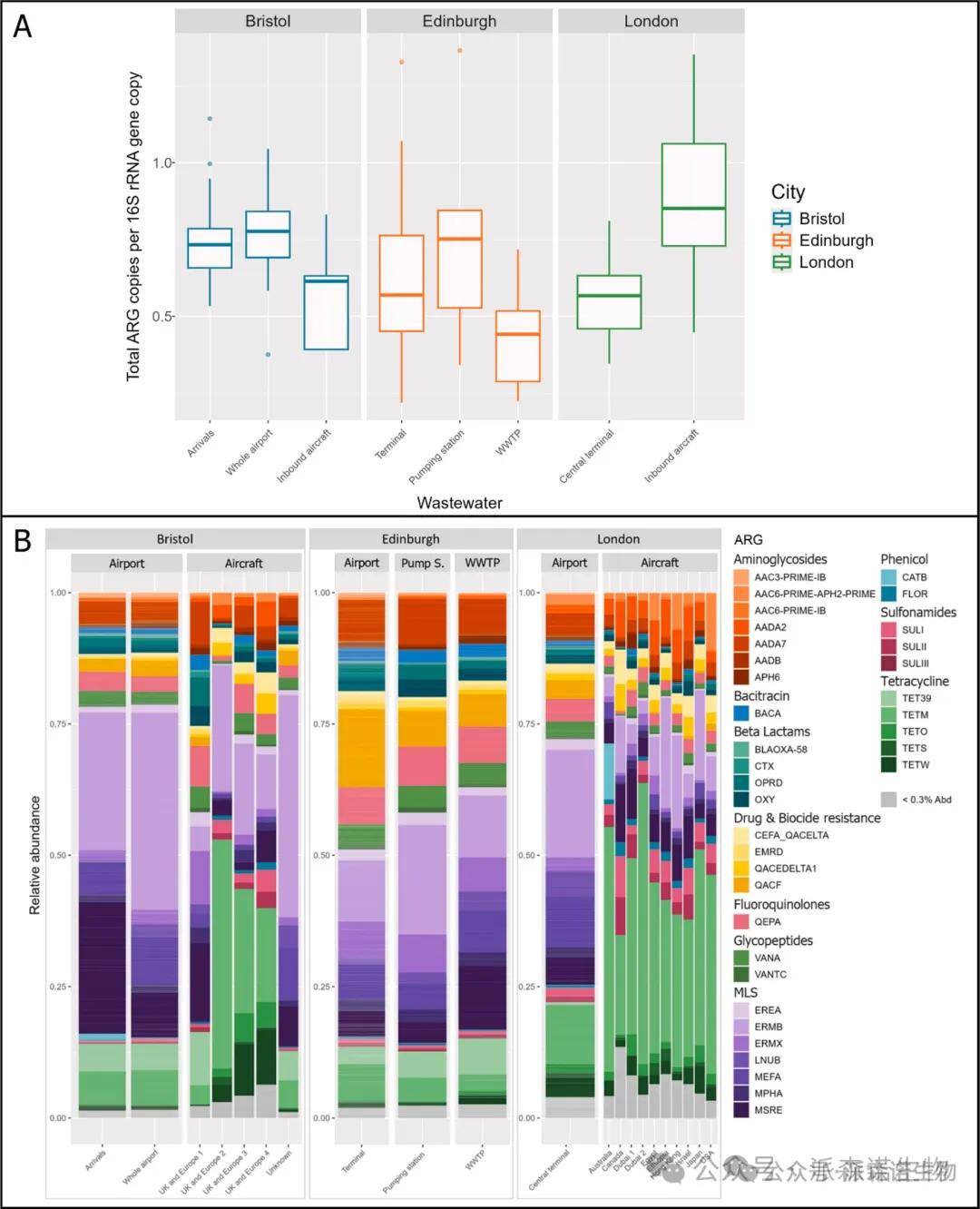
图1. (A) 显示相对于16S rRNA基因的ARG总丰度的箱形图。(B) 堆叠条形图显示了飞机和机场相关废水样本中HT-qPCR靶抗菌药物耐药基因(ARG)的相对丰度。除入境飞机外,相对丰度是每个废水源所有样本的平均值。
宏基因组分析结果
数据特征:样本平均输出 204122个reads,86% 具有抗微生物能力;希思罗航站楼样本(LHR-CT)ARG 曲线与 HT-qPCR 结果一致,飞机样本(LHR-IA)抗性谱差异较大。
基因聚类与差异表达:分层聚类显示 LHR-CT 和 LHR-IA 抗性体形成不同簇,ALDEx2 分析证实 mefA 和 tet16A 在航站楼样本中更丰富,tetM 和 ermT 在飞机废水样本中更高;飞机样本抗性簇与地理无强关联(图2)。
副抗性组差异:LHR-CT 样本中附件抵抗体占比(19±6.0%)显著高于 LHR-IA(11±3.7%,Welch t 检验,p<0.01),LHR-IA 样本中苯尼考抗性基因相对丰度极高。
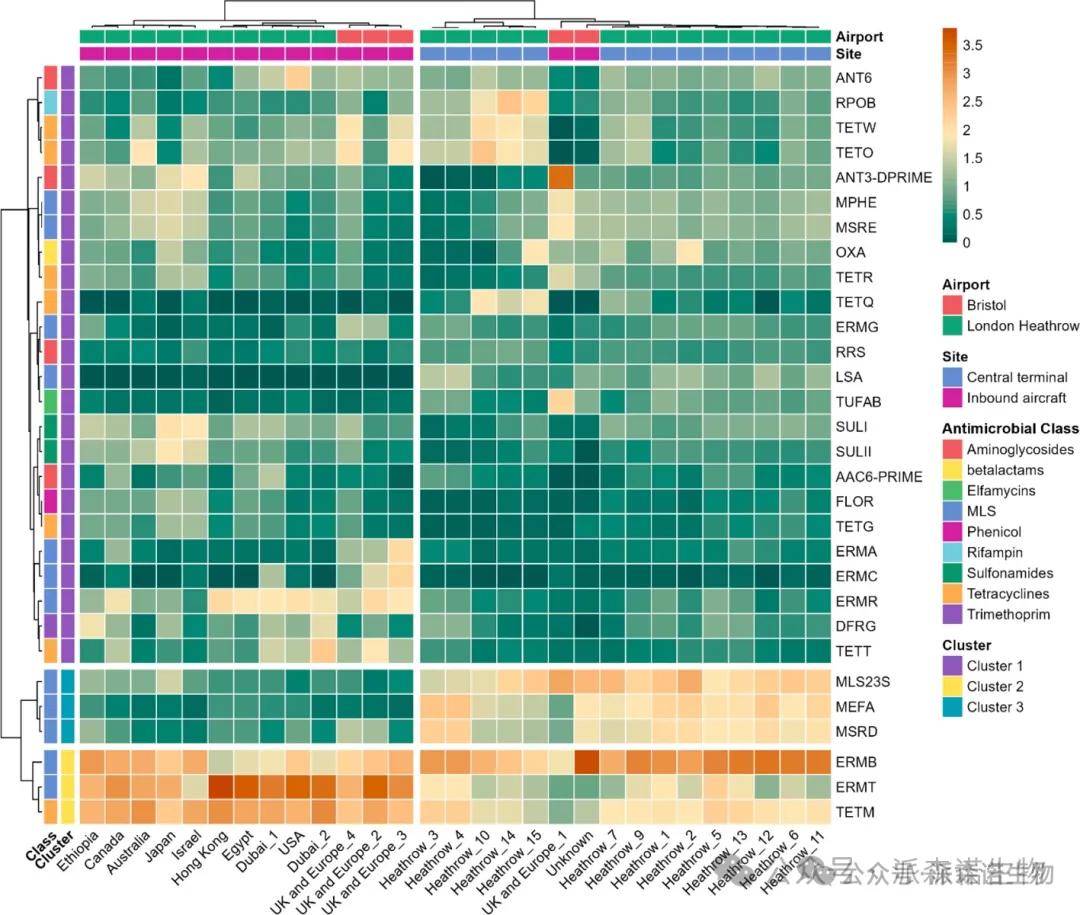
图2. 集群抗性组热图显示了宏基因组废水样本子集中50个最丰富的抗菌药物抗性基因(ARG)的对数转换丰度。
ARG的Alpha多样性
HT-qPCR 检测覆盖度:
在废水抗性体中平均检测到 79 个靶 ARG 中的 66 个,仅 blaOXA-23 和 VEB 在所有样本中均未检出。
宏基因组分析的 ARG 数量与多样性:
飞机样本对比:伦敦希思罗机场飞机废水(LHR-IA)中检测到的 ARG 数量显著高于布里斯托尔机场飞机废水(BRS-IA)(Welch's t 检验,p<0.01),但两者的 Shannon 多样性指数无显著差异(p=0.1979)。
地区航班差异:来自非洲和亚洲的航班携带的 ARG 数量高于北美和欧洲航班,其中亚洲与欧洲航班的差异显著(Welch t 检验,p<0.01)(图3)。
航站楼样本(LHR-CT)与飞机样本(LHR-IA)的 ARG 多样性(观察指数和 Shannon 指数)无显著差异(p=0.8306 和 0.7785),但 LHR-IA 中独特 ARG 总数更高(202 个 vs. LHR-CT 的 182 个)。
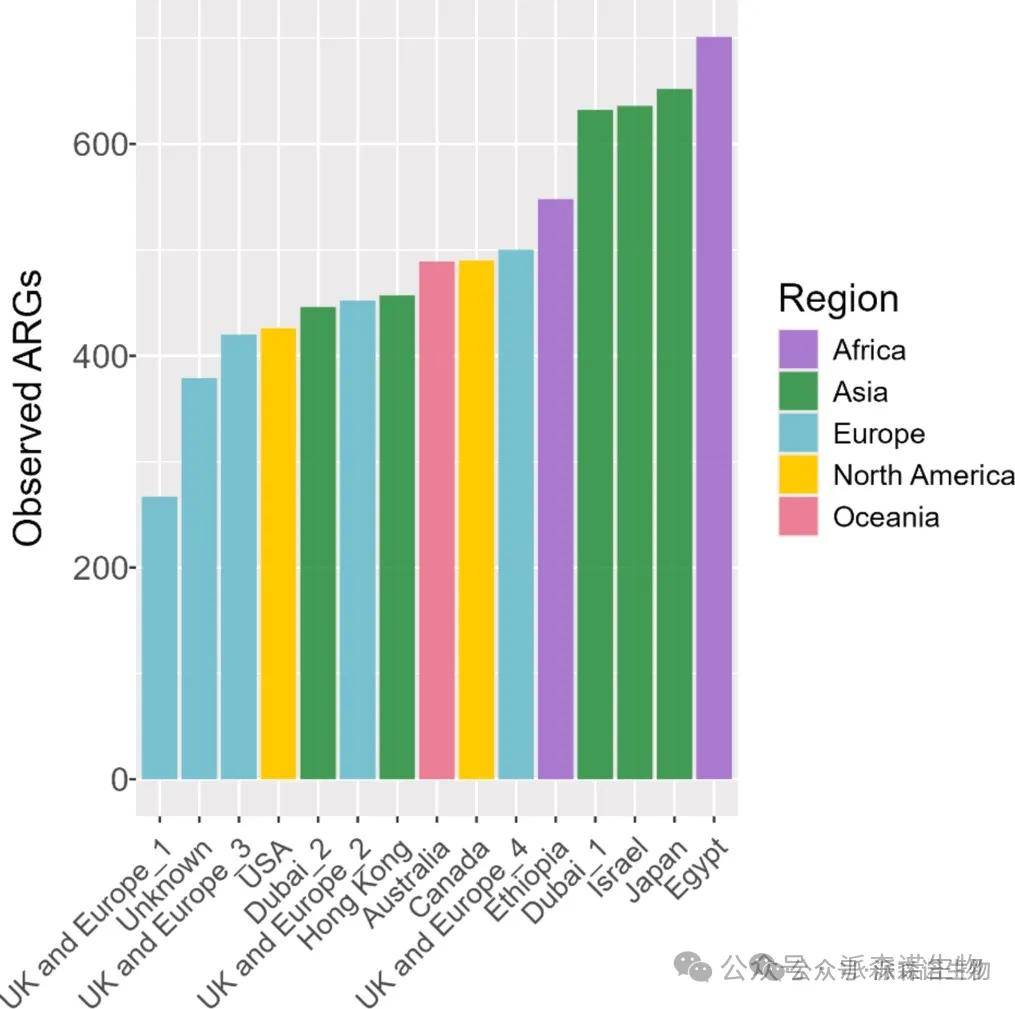
图3. 全球区域对入境飞机废水宏基因组分析中发现的抗菌药物耐药基因(ARG)总数的影响。
ARG的Beta多样性
不同机场废水抗性体聚类特征:
布里斯托尔与伦敦机场:废水抗性体按来源呈现显著聚集(PERMANOVA,p<0.01),其中伦敦样本经宏基因组分析也显示按来源聚类明确(图4.A、C)。
布里斯托尔机场:与航站楼样本(BRS-A、BRS-WA)相比,飞机废水样本(BRS-IA)的抗性组异质性更高(图4.A)。
爱丁堡机场:废水抗性体未观察到明显的来源聚类(PERMANOVA,p>0.05)(图 4.B),其泵站样本(EDI-PS)抗性特征与布里斯托尔、伦敦的飞机废水差异显著(p>0.01)。
跨机场对比:
1.航站楼来源的废水抗性体均按来源显著聚集(PERMANOVA,p<0.01)。
2.伦敦与布里斯托尔的飞机废水抗性体未按来源聚类(PERMANOVA,p=0.06),且与爱丁堡泵站样本的抗性特征无显著关联。
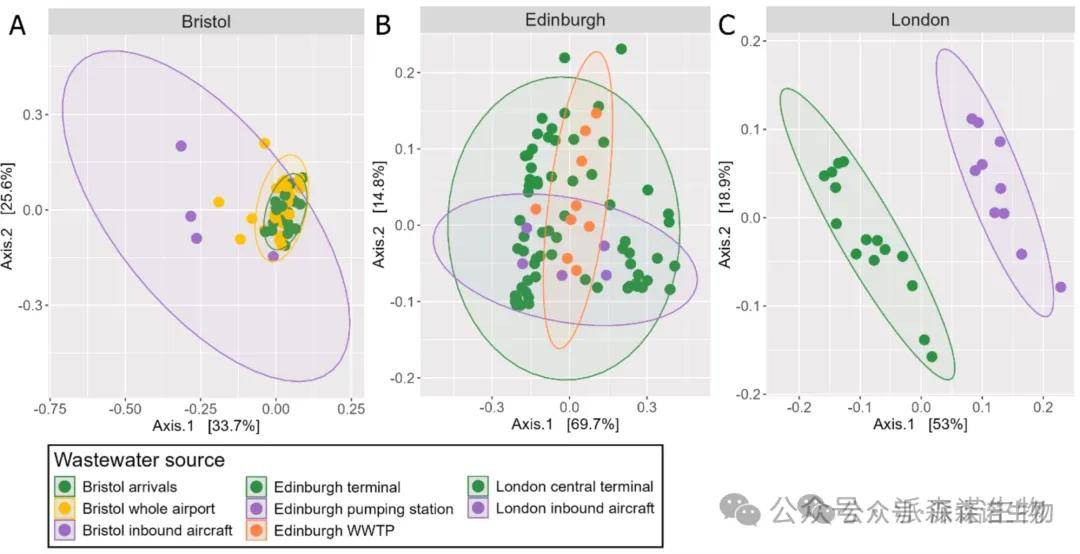
图4. 基于Hellinger转换的ARG相对丰度的Bray-Curtis相异矩阵的PcoA排序图,显示了(A)布里斯托尔、(B)爱丁堡和(C)伦敦希思罗国际机场废水样本之间的抗菌药物抗性基因(ARG)组成差异。
ARGs与潜在影响因素的相关性
整体说明作用:基于距离的冗余分析(RDA)显示,废水物理化学性质对废水抗性体组成具有显著总体说明作用(调整后R²=0.38,p<0.01)(图5),其中铵浓度影响最大。
不同机场铵含量差异显著:爱丁堡机场样本(如EDI-T)铵含量最低(44.7 mg N·L⁻¹),伦敦希思罗航站楼(LHR-CT)和布里斯托尔机场到达航站楼(BRS-A)样本铵含量最高(分别为127.9 mg N·L⁻¹和122.3 mg N·L⁻¹)。
样本来源间的变量差异:希思罗机场飞机废水样本(LHR-IA)的 pH 值、电导率、正磷酸盐浓度和浊度显著高于航站楼样本(LHR-CT)(Welch t 检验,所有比较p<0.01),显示不同来源样本的理化性质存在明显区分。
ARGs基因与理化性质、可移动遗传元件和HT-qPCR目标病原体的关联
整合酶基因相关性:整合酶基因intI3和intI1与抗生素抗性基因(ARGs)存在强显著正相关(ρ>0.7,p<0.01),表明可移动遗传元件对 ARG 传播可能有重要影响。
病原体与理化性质关联弱:ARGs 与病原体或其他理化性质(除铵浓度外)的直接关联较弱,未发现显著强相关性(图 S6)。
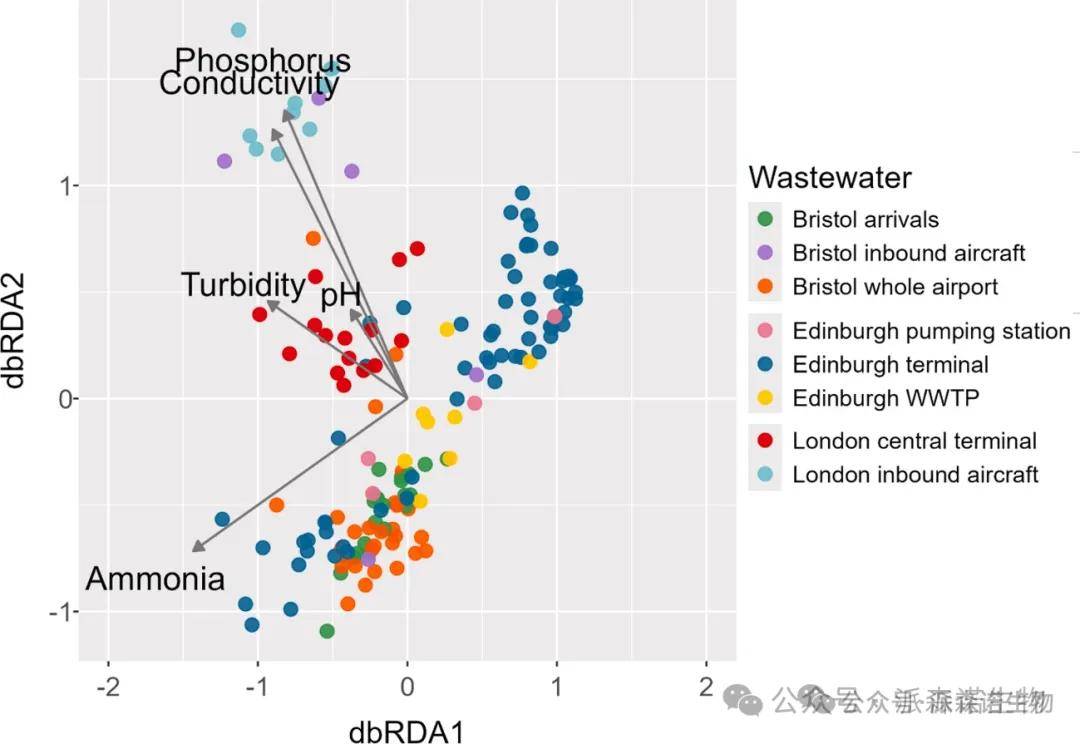
图5. 基于距离的冗余分析(dbRDA)显示了环境变量对机场相关废水样本中抗菌药物耐药基因(ARG)谱的影响。
微生物群落与病原分析
微生物群落组成与多样性
分类与优势菌群:
宏基因组 Kraken 分析显示,每个样本平均输出39990814个分类单元,96% 归类为细菌。在LHR样本之间的微生物群落多样性方面没有观察到显著差异(观察到:p=0.5,Shannon-p=0.5),所有样本均以厚壁菌门为主(主要属于肠球菌科)(图6.A)。希思罗机场(LHR)样本的微生物群落组成按来源显著聚集(PERMANOVA p<0.01)(图6.B),航站楼废水(LHR-CT)中变形杆菌门更丰富,这是由于 Comamonadaceae 科及低丰度家族丰度明显更高(Welch t 检验,p<0.01)。
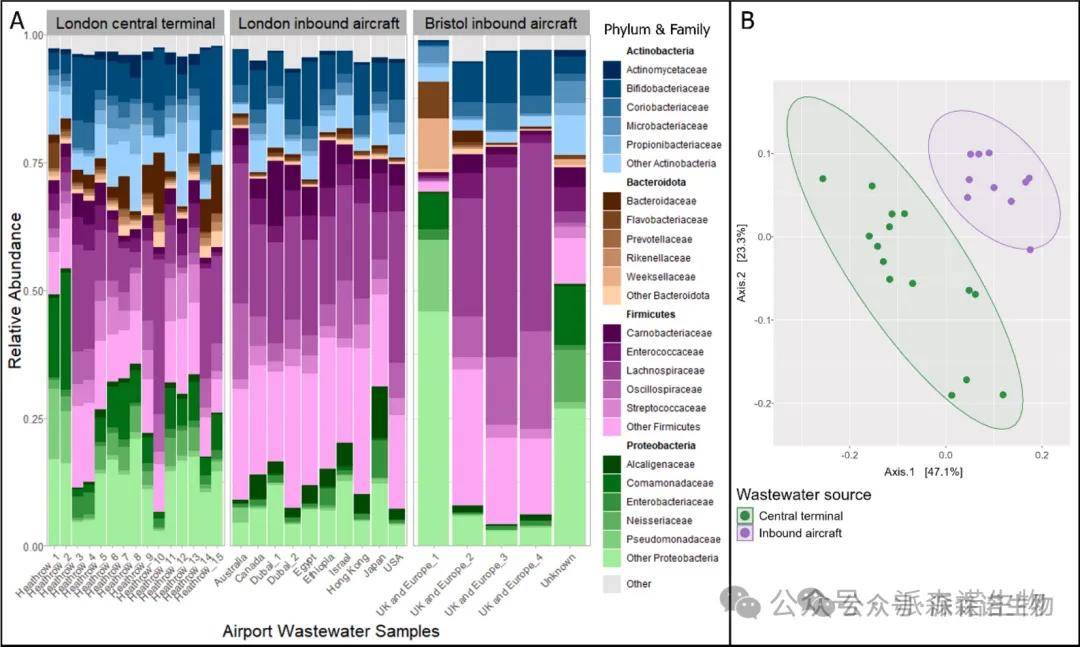
图6.(A) 堆叠条形图显示了宏基因组废水样本子集(B)中分类群的相对丰度。基于Hellinger转换的分类群相对丰度,Bray-Curtis相异性矩阵的PcoA排序图显示了伦敦希思罗废水样本之间的分类组成差异。
机会病原体检测结果
检出率与分布差异:金黄色葡萄球菌在所有样本中均未检出,其余四种目标病原体(鲍曼不动杆菌、肺炎克雷伯菌、铜绿假单胞菌、肠球菌)均有检出,其中鲍曼不动杆菌检出率最高(141/180)。
机场间差异:鲍曼不动杆菌在布里斯托尔机场(BRS)样本中相对丰度最高,肺炎克雷伯菌在希思罗机场(LHR)样本中最高(单因素方差分析均p<0.01)。铜绿假单胞菌丰度在机场航站楼间无显著差异(单因素方差分析p=0.06,f=2.794;图7)),但在飞机样本中显著高于航站楼(Welch t 检验,p<0.05),肠球菌仅在EDI样本中检测到。
样本类型差异:鲍曼不动杆菌在机场(航站楼 、污水处理厂)废水中的相对丰度显著高于飞机样本(Welch t 检验,p<0.05)。肠球菌仅在爱丁堡机场(EDI)样本中检测到,且在泵站样本(EDI-PS)中的丰度显著低于国际航站楼(EDI-T)和污水处理厂(EDI-WWTP)样本(单因素方差分析p<0.01,f=9.122)。
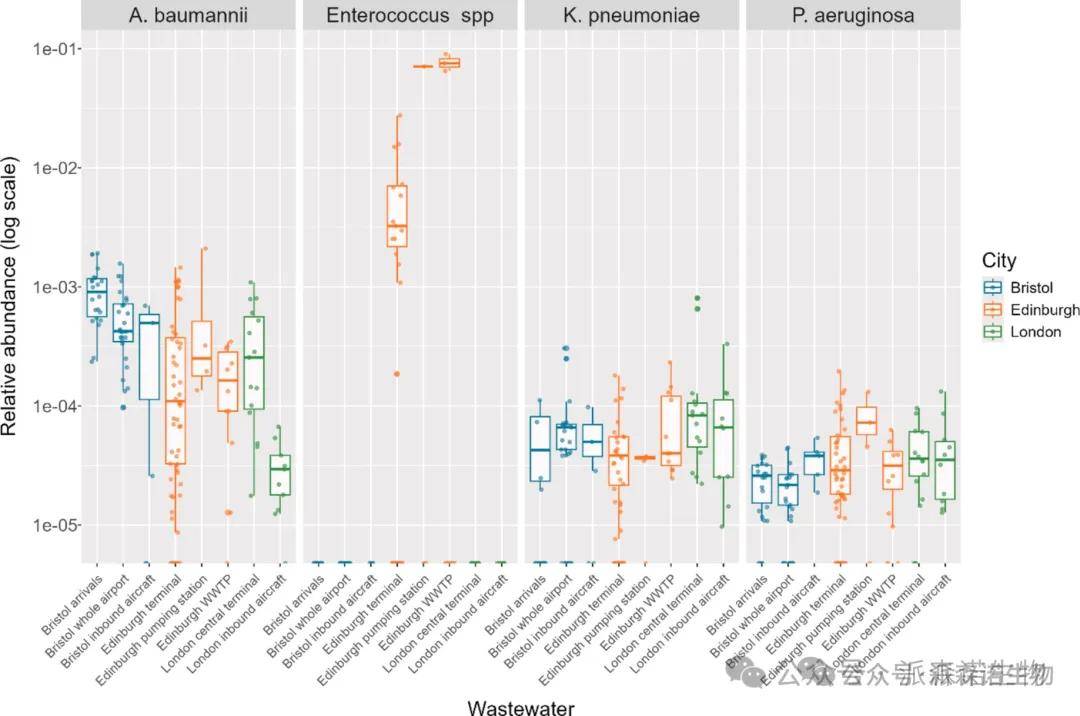
图7. 箱形图显示了飞机和机场相关废水样本中HT-qPCR靶病原体的相对丰度。
潜在ARG主机的网络分析
基于强(ρ>0.7)和显著(p<0.01)相关性)网络分析,探讨了40个最丰富的ARG和细菌属之间的共现模式(图8)。甲氧苄啶ARG、dfrF和几种四环素ARG-tetW、tetO和tet40-与多种细菌属相关,包括共生肠道菌群,如粪杆菌、Dorea和Ruminococcus。多个分类群与编码对不同类别(如sul1、catB、ermT、tetG和flor)的各种抗菌药物的耐药性的高度丰富的ARG相关,其中葡萄球菌的数量最多。
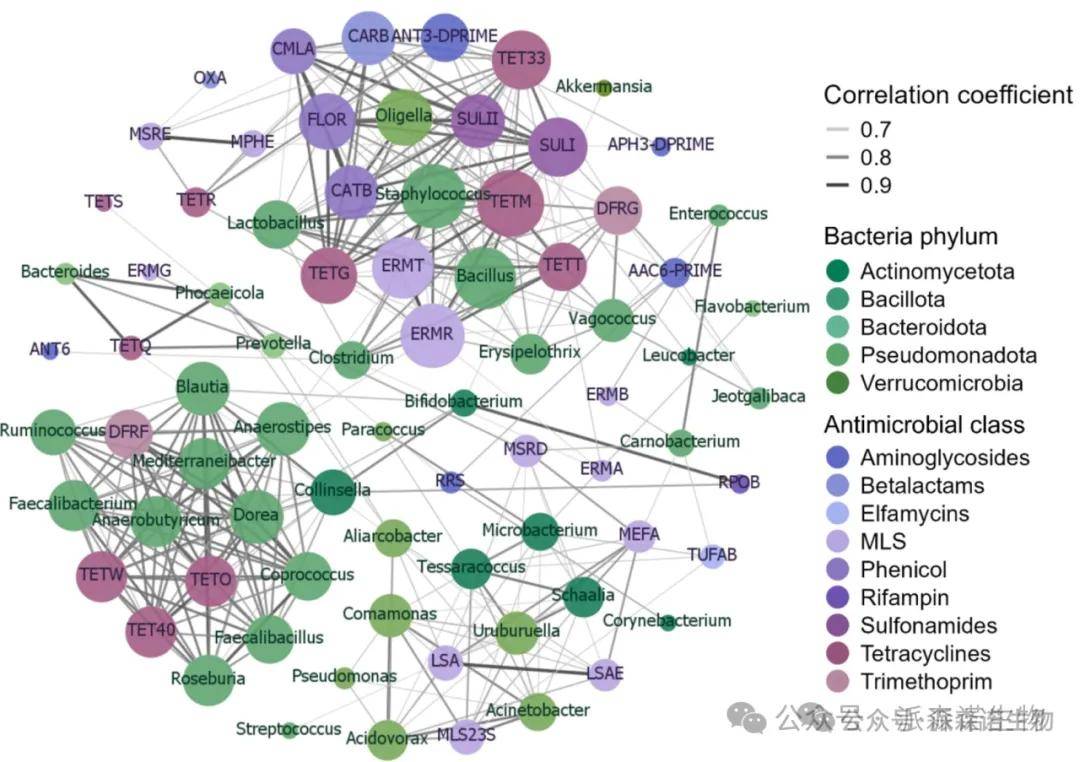
图8. 网络分析显示了飞机废水样本宏基因组亚群中40个最丰富的抗菌药物耐药基因(ARG)与细菌属之间的关系。连接表示强而显著的相关性(斯皮尔曼相关系数ρ>0.7,p<0.01)。
总 结
本研究首次全面同时调查了多个国际机场飞机和航站楼废水中AMR的丰度和多样性。研究结果表明,飞机乘客废水可能在将来自全球不同人群的AMR细菌迅速引入当地水循环中发挥作用。飞机废水监测为全球 AMR 防控提供了独特的跨区域视角,但其应用需突破样本偏差、技术标准化及伦理治理等多重挑战。未来需通过多学科协作,构建兼顾科学性与伦理合规性的监测体系,为应对抗生素耐药性危机提供创新解决方案。