2025-06-24
文章题目: Integration of epigenomic and transcriptomic profiling uncovers EZH2 target genes linked to cysteine metabolism in hepatocellular carcinoma
中文标题: 表观组与转录组联合分析揭示EZH2调控半胱氨酸代谢的靶基因并助力肝癌治疗
发表期刊: Cell Death and Disease
影响因子: 9.6
发表时间: 2024年
研究对象: 肝癌细胞系
涉及组学: scRNA-Seq、bulk RNA-Seq、CUT&Tag、ATAC-seq等

研究背景
肝细胞癌(HCC)是全球范围内主要的癌症死亡原因之一,其发病机制复杂,涉及细胞突变、表观遗传修饰异常以及代谢紊乱。EZH2是PRC2复合体的核心催化亚基,通过H3K27me3修饰抑制基因表达,在多种癌症中过表达,并与HCC的恶性进展、免疫逃逸和药物耐受性相关。尽管EZH2抑制剂Tazemetostat已在其他肿瘤中获批应用,但其在HCC中的靶基因及作用机制尚不明确。此外,半胱氨酸代谢和铁死亡在HCC中扮演重要角色,但EZH2如何通过表观遗传调控影响这些过程尚不清楚。因此,本研究旨在通过整合表观组学和转录组学分析,揭示EZH2在HCC中的靶基因,特别是那些与半胱氨酸代谢和铁死亡相关的基因,为HCC的表观遗传治疗提供新的理论依据。
研究路线

步骤1
EZH2功能干预实验设计
研究团队采用两种方式下调EZH2功能:其一是利用FDA已批准的EZH2小分子抑制剂Tazemetostat处理HCC细胞系;其二是通过siRNA介导的EZH2沉默,从而系统地干预EZH2催化的H3K27me3修饰水平,验证其对转录组的影响。
步骤2
多组学联合测序分析
在EZH2干预处理后,对HepG2等肝癌细胞系开展RNA-seq用于获得差异表达基因,同时进行CUT&Tag测定EZH2介导的H3K27me3分布变化,并辅以ATAC-seq检测染色质可及性变化,解析染色质状态与转录激活之间的关系。
步骤3
整合分析锁定关键靶点基因
研究通过交叉比对转录组差异上调基因、CUT&Tag中H3K27me3降低的区域以及ATAC-seq中染色质开放区域,筛选出16个EZH2调控的关键靶点基因,重点关注与硫氨基酸代谢相关的BHMT和CDO1,并辅以HNF4α结合位点的ChIP-seq数据验证其调控关系。
步骤4
功能实验验证机制可靠性
通过细胞活力检测和脂质过氧化物(ROS)积累测定,验证EZH2抑制对铁死亡通路的影响;此外,通过敲低BHMT/CDO1等基因观察脂质ROS的变化,进一步确定EZH2通过代谢调控影响细胞死亡机制。
分析内容
1.EZH2高表达预示肝癌患者不良预后
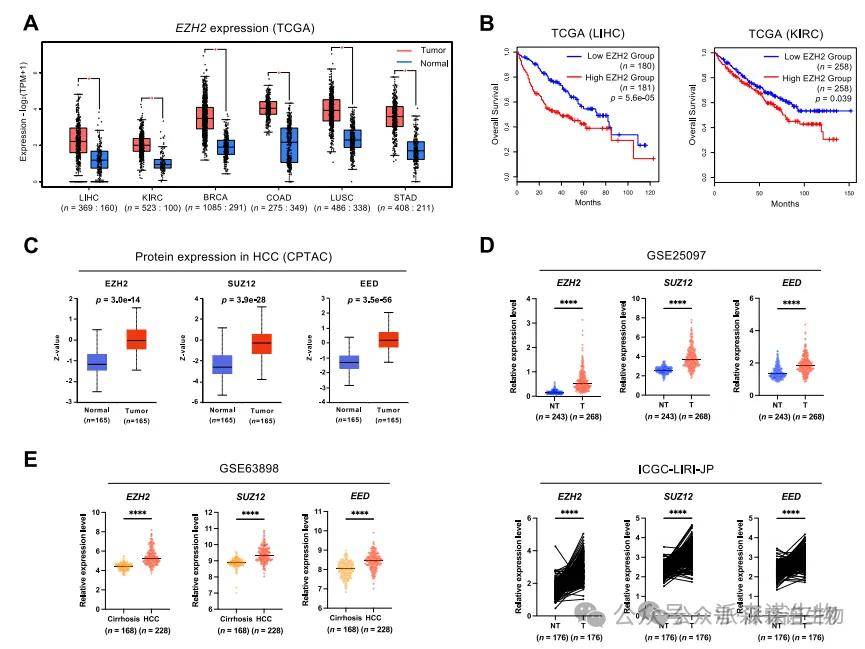
在TCGA和GEO多个HCC队列中,研究发现EZH2的mRNA和蛋白在肿瘤组织中显著升高,尤其在LIHC患者中表现出高度表达,并与更短的总生存期(OS)和无病生存期(DFS)显著相关。进一步分析其PRC2复合物的关键亚基SUZ12和EED也呈现相似趋势,显示出EZH2通路的广泛激活状态。通过蛋白组数据和基因表达数据库进一步证实其临床重要性,提示EZH2可能为预后评估与靶向治疗的潜在标志物。
2.EZH2抑制逆转HCC恶性基因表达谱
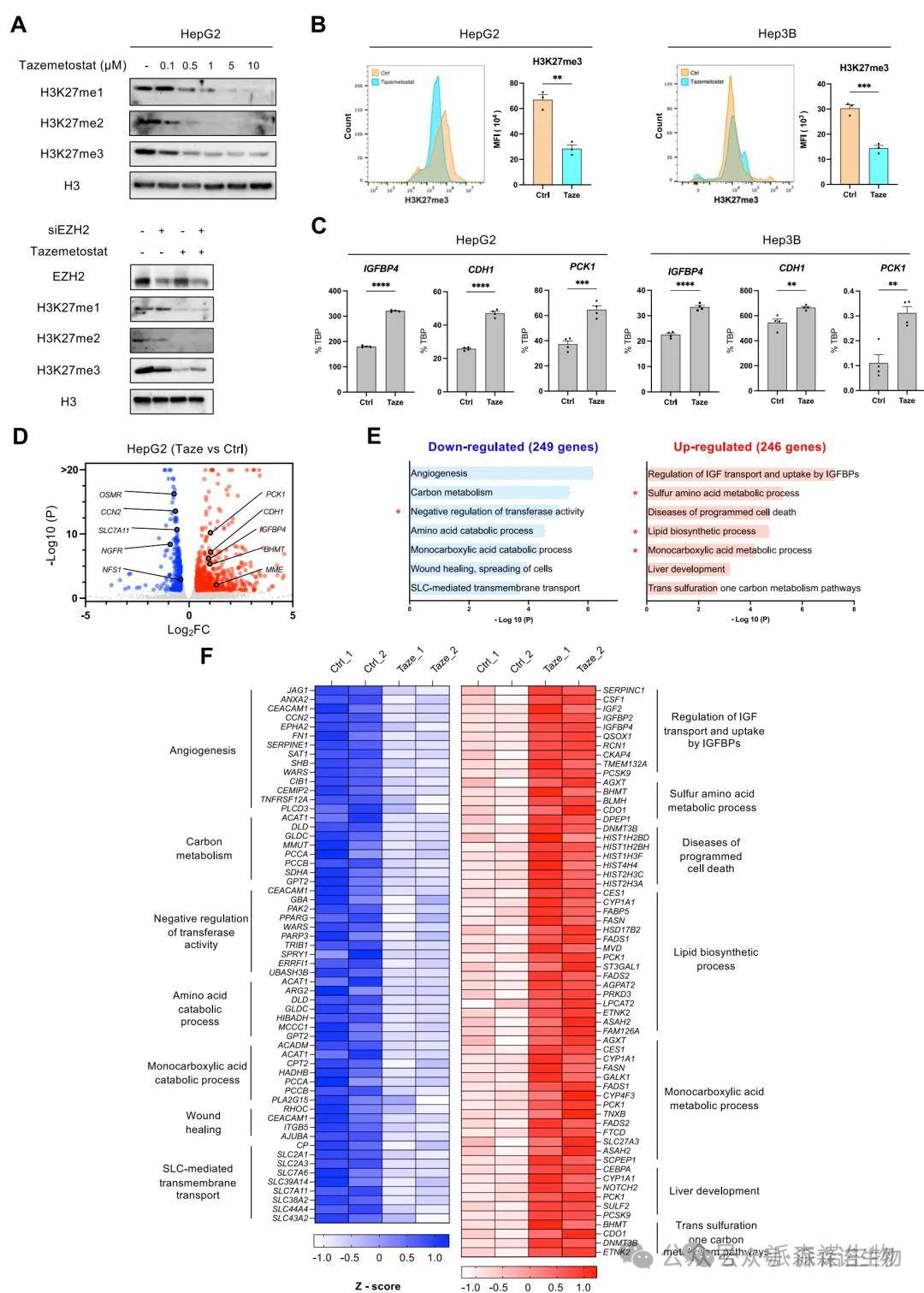
利用Tazemetostat或siRNA处理肝癌细胞后,RNA-seq结果显示EZH2抑制可显著恢复多个被沉默的抗癌基因(如IGFBP4、CDH1、PCK1)的表达。同时,GO富集分析显示EZH2抑制上调了一系列代谢相关通路,如脂质合成、硫氨基酸代谢和氧化还原平衡,而下调了肿瘤进展相关的血管生成、伤口愈合、细胞周期等通路。这些数据表明EZH2通过表观机制广泛重编程HCC细胞的转录谱,参与肿瘤代谢适应与恶性行为调控。
3.CUT&Tag揭示EZH2调控的关键表观位点
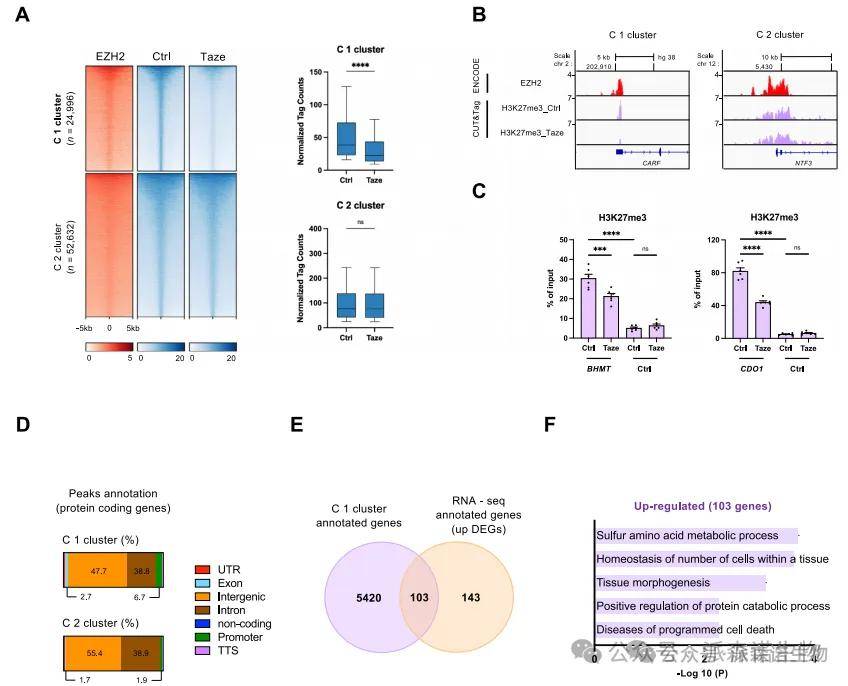
CUT&Tag实验揭示EZH2通过H3K27me3在基因启动子区域介导转录抑制,尤其是BHMT和CDO1等代谢关键基因。在EZH2抑制后,这些基因的H3K27me3富集显著减少,提示表观层面的“释放”作用。共识分析发现EZH2主要靶向半胱氨酸代谢、单羧酸代谢和蛋白质代谢等路径,为理解其介导肝癌代谢重塑提供了新线索。该发现也为靶向EZH2以恢复代谢稳态提供了理论依据。
4.染色质可及性变化促进转录激活
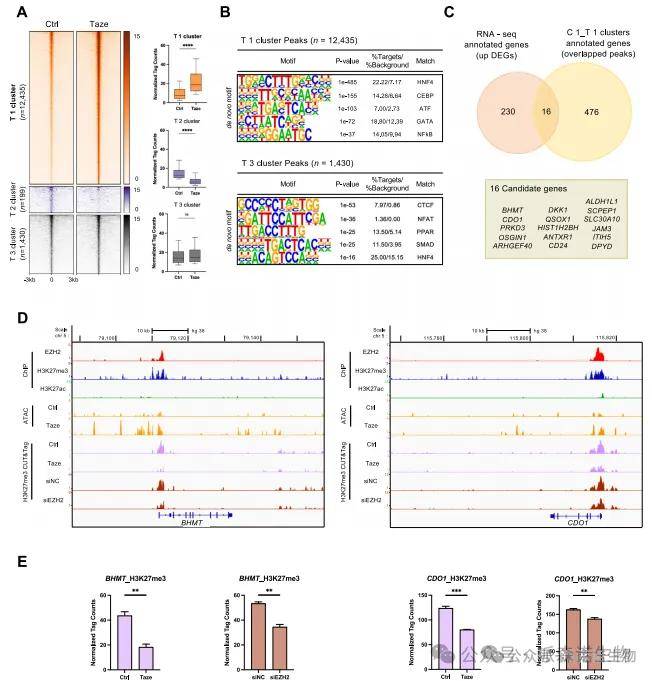
ATAC-seq显示EZH2抑制使多个调控区域染色质开放性显著上升,特别是在HNF4α、CEBP和ATF等肝细胞核心转录因子的结合位点。这种开放结构与CUT&Tag中H3K27me3下降区域高度重合,进一步说明EZH2通过表观压制调控染色质结构。综合多组学数据,研究筛选出16个EZH2调控的核心靶基因,其中BHMT和CDO1最为显著,验证了EZH2通过染色质构象重塑调控代谢相关基因表达的机制。
5.BHMT与CDO1在肝细胞中特异表达并受EZH2抑制
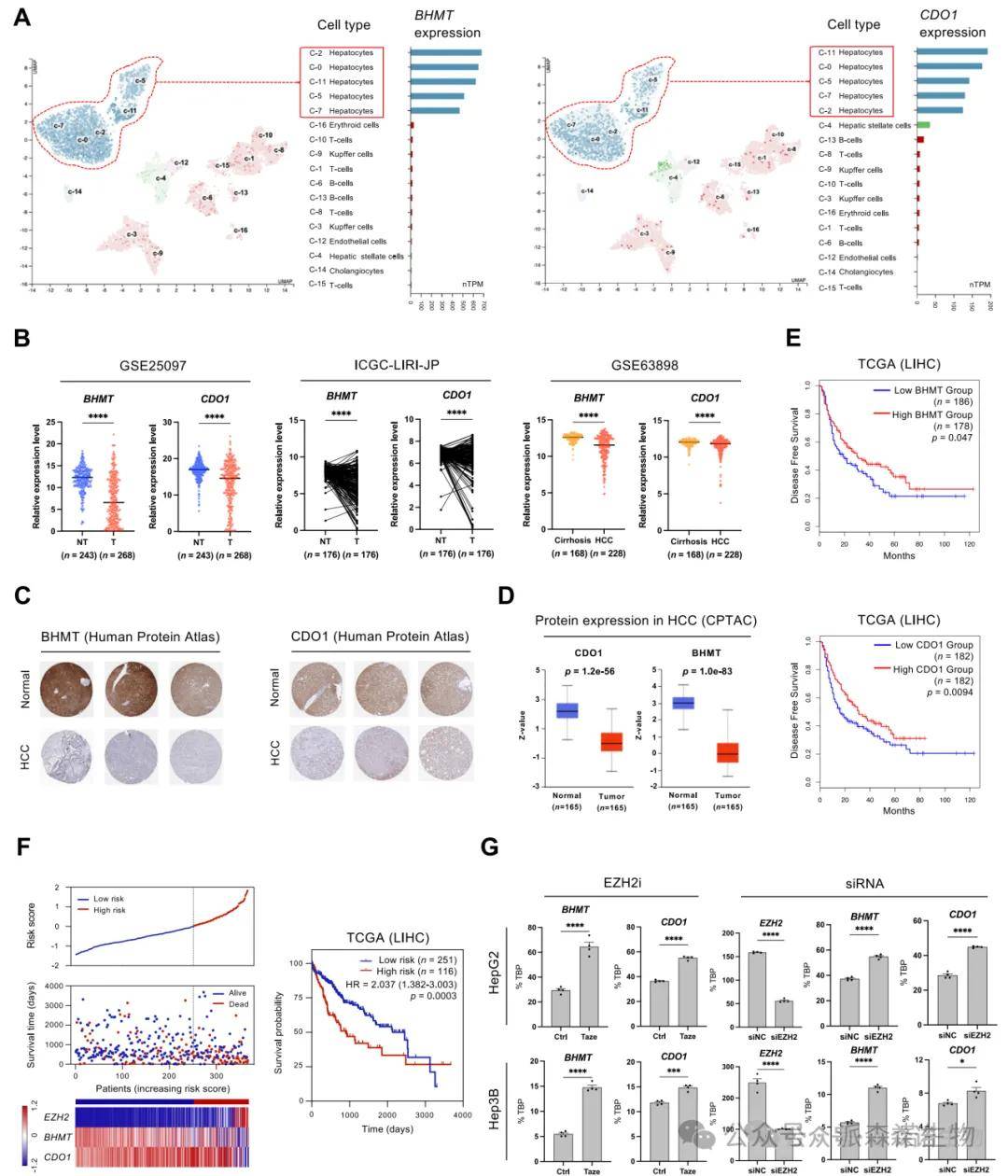
单细胞转录组数据揭示BHMT和CDO1在正常肝细胞中高度表达,而在肝癌组织中几乎沉默。多个HCC人群队列验证了这两个基因在癌组织中的显著下调。蛋白组数据也证实其在肿瘤组织中表达量下降。进一步的生存分析表明,BHMT与CDO1表达低的患者群体预后显著较差。研究还构建了基于EZH2、BHMT和CDO1的风险评分模型,有效区分高危与低危患者群体,提示其联合作为预后评分工具的潜力。
6.EZH2抑制激活铁死亡通路,诱导ROS积累
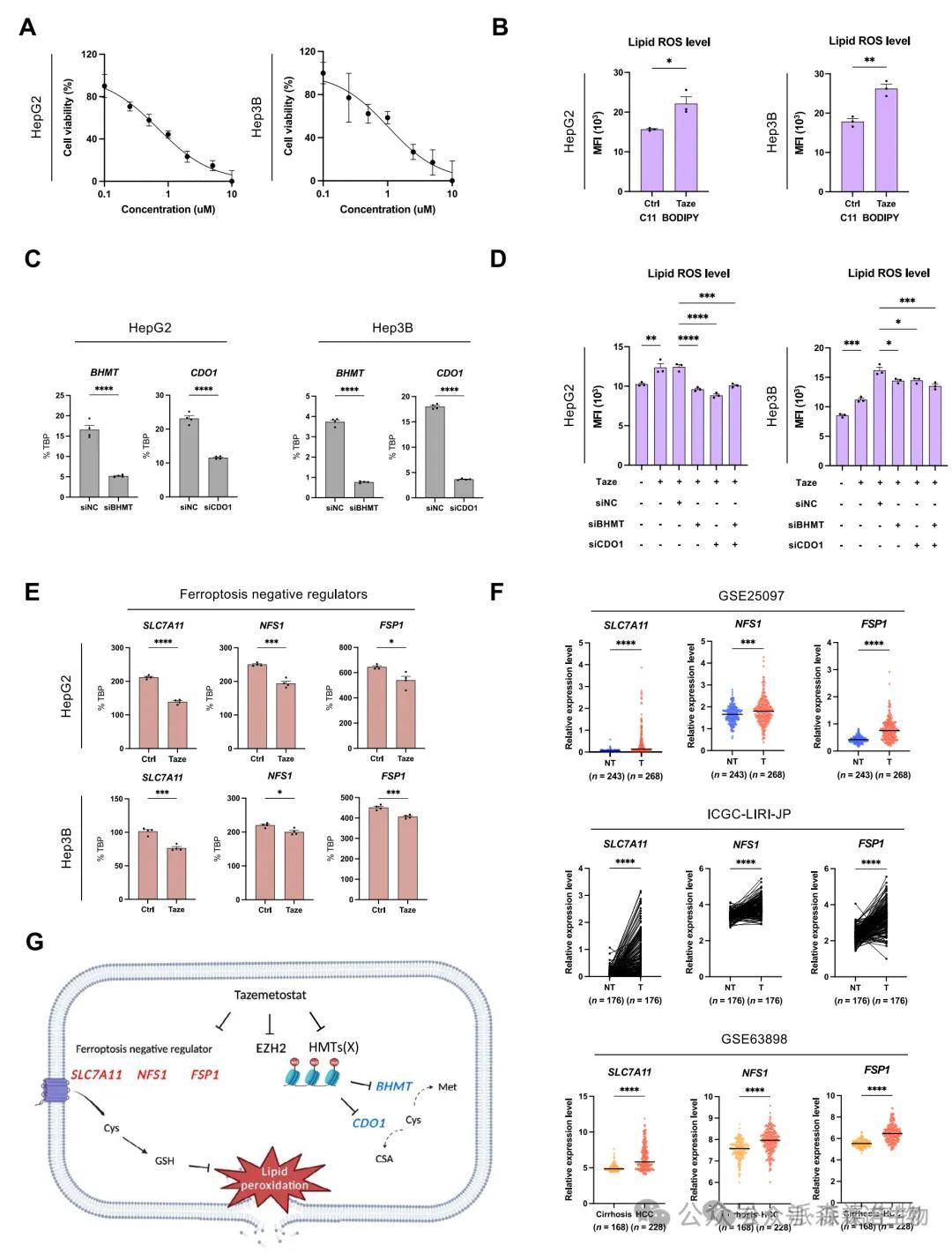
EZH2抑制剂Tazemetostat显著抑制肝癌细胞活力,并导致脂质ROS积累增强。进一步的机制分析发现,该效应主要通过恢复BHMT和CDO1表达,引发细胞内半胱氨酸耗竭,从而激活铁死亡程序。同时,EZH2抑制还下调了多个铁死亡负调控因子(SLC7A11、FSP1、NFS1),形成协同放大效应。虽然敲低BHMT和CDO1可部分减轻ROS积累,但不能逆转细胞死亡,提示多通路协同作用。此研究为靶向EZH2以激活铁死亡提供了全新策略。
研究总结
本研究系统整合表观组、转录组和染色质可及性数据,明确了EZH2在HCC中通过抑制BHMT和CDO1介导的半胱氨酸代谢,促进肿瘤细胞逃避铁死亡。同时验证其作为潜在靶点的治疗意义。该研究为HCC精准治疗提供了新机制支持,也强调了多组学联合分析在复杂疾病机制研究中的应用价值。


