
2025-07-01
文章题目:The landscape of N6-methyladenosine in localized primary prostate cancer
中文标题:局限性前列腺癌的m6A全景观图谱
发表期刊:nature genetics
影响因子:29
发表时间:2025年
研究对象:前列腺癌组织
涉及组学:m6A meRIP, WGS, RNA-seq, Proteomics等

一、研究背景
前列腺癌是全球男性中最常见的恶性肿瘤之一,其高度异质性和复杂微环境对精准诊疗构成了重大挑战。N6-甲基腺苷(m6A)是RNA最常见的修饰,参与RNA稳定性、RNA剪切以及代谢等多个环节。已有报道显示m6A在多种癌症中可能发挥促癌或抑癌作用,但其在前列腺癌中的全局分布、遗传调控机制及临床意义仍不明晰。前列腺癌的高度异质性使得现有基因组和转录组研究难以全面解释其临床表型特征,表观转录组研究或许能够为前列腺癌的研究提供新见解。
二、研究思路
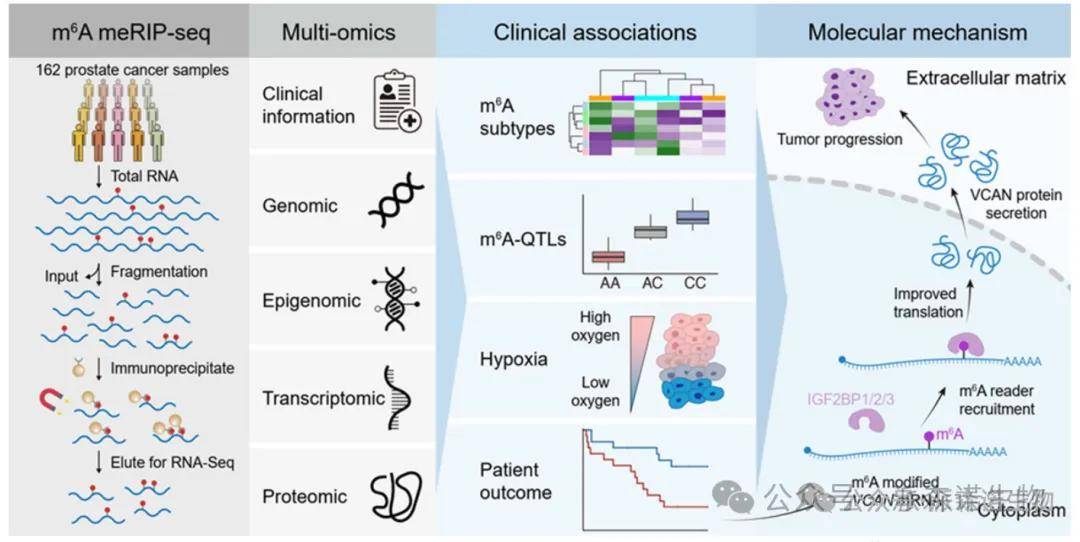
步骤一:绘制前列腺癌m6A全景图谱
研究通过meRIP-seq对148例高质量局限性前列腺癌组织样本进行分析,识别出32,051个高置信度m6A峰,广泛分布于癌基因(如MYC、AR)及非典型肿瘤抑制基因中,并与RNA表达、CNV、甲基化等组学特征高度相关,构建出系统的前列腺癌表观转录组图谱。
步骤二:构建m6A亚型并探索其临床关联
通过共识聚类,定义了五种m6A亚型(P1–P5),并揭示其与病理T分级、IDC/CA亚型、基因组不稳定性和术后复发显著相关。进一步发现这些亚型与mRNA表达型、CNV亚型具有交叉关系,并且m6A调控因子如YTHDF1的扩增与亚型特征密切相关。
步骤三:解析种系遗传变异对m6A的调控作用
整合WGS数据,识别出14,775个m6A-QTL,涵盖1,017个基因,包括多个驱动基因(如TP53、FOXA1)。特定SNP(如rs4951018)不仅影响m6A丰度,还同时调控目标基因的RNA和蛋白表达,揭示遗传变异通过m6A修饰参与癌症发生。
步骤四:探讨缺氧对m6A修饰的调控机制
通过患者肿瘤样本与细胞系(V16A、PC-3)在缺氧状态下的m6A谱对比,识别出2,280个缺氧相关的m6A峰,显示缺氧可广泛下调关键调控基因的m6A水平,并影响m6A酶的表达,揭示微环境压力与m6A修饰间的广泛关联。
步骤五:系统评估m6A作为预后标志物的临床价值
在6个独立前列腺癌患者队列中,系统评估m6A调控因子的CNA与患者预后的关系,发现VIRMA与YTHDF3的扩增显著预测术后复发。进一步发现TP53与NKX3-1等关键基因的m6A水平可单独或协同预测患者复发风险,支持m6A作为表观生物标志物的潜力。
步骤六:功能验证VCAN的m6A修饰促进前列腺癌进展
筛选并验证关键m6A修饰靶点VCAN,发现其m6A修饰增强mRNA稳定性和蛋白翻译效率,依赖IGF2BP蛋白复合物。VCAN高表达与不良预后、肿瘤侵袭性显著相关。shRNA敲低实验进一步证实VCAN促进肿瘤细胞增殖与转移,是潜在的治疗靶点。
三、研究内容
1、局限性前列腺癌的m6A图谱
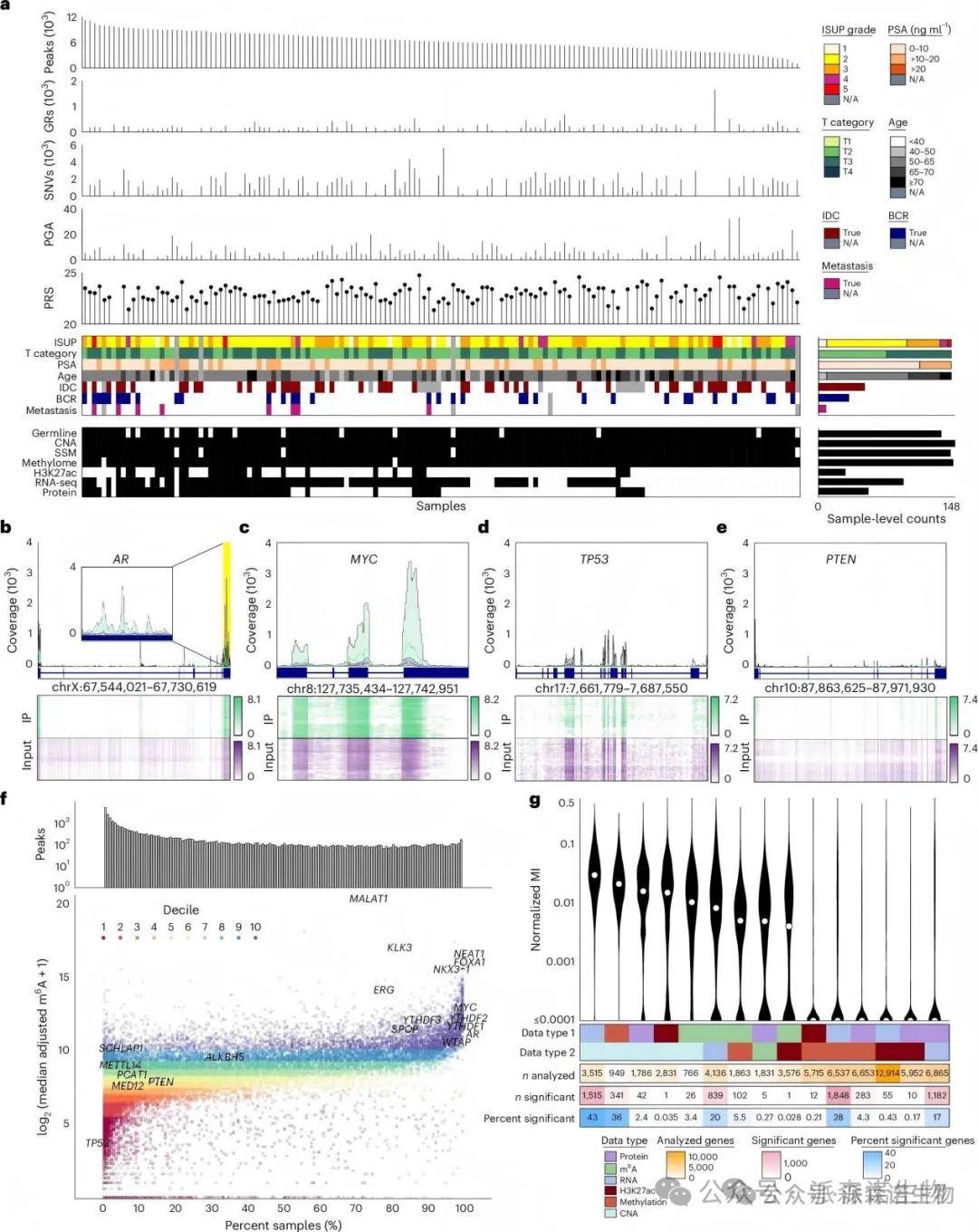
本研究系统分析了162例原发性局部前列腺癌样本的m6A表观转录组,采用meRIP-seq技术,识别出32,051个高置信度的m6A峰,广泛分布于关键癌基因中。m6A丰度与RNA丰度、拷贝数变化、DNA甲基化及组蛋白修饰等其他组学特征存在显著相关性,这些为前列腺癌中m6A调控机制及其与其他组学的交互作用提供了新视角。
2、局部前列腺癌中m6A亚型及其临床相关性研究
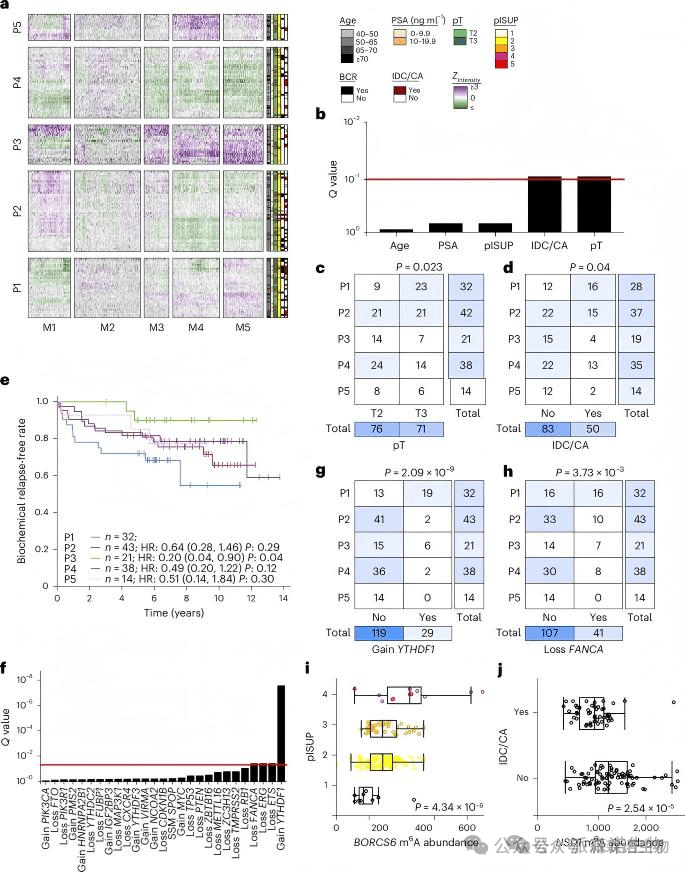
局部前列腺癌患者的五个m6A亚型与肿瘤大小、病理T分级、基因组不稳定性及手术后复发率显著相关。m6A亚型与已知信使RNA及拷贝数变化亚型存在关联,其特征体现在m6A相关的“writer”、“reader”和“eraser”的体细胞CNA模式中。此外,特定m6A峰与临床特征,如年龄、分级及IDC/CA的存在相关。在IDC/CA阳性病例中,m6A峰数量显著增加,同时观察到FANCA和TP53等肿瘤抑制基因的缺失。因此,m6A亚型及其特定位点模式为理解前列腺癌的临床特征提供了新的视角。
3、遗传性对m6A调控的影响
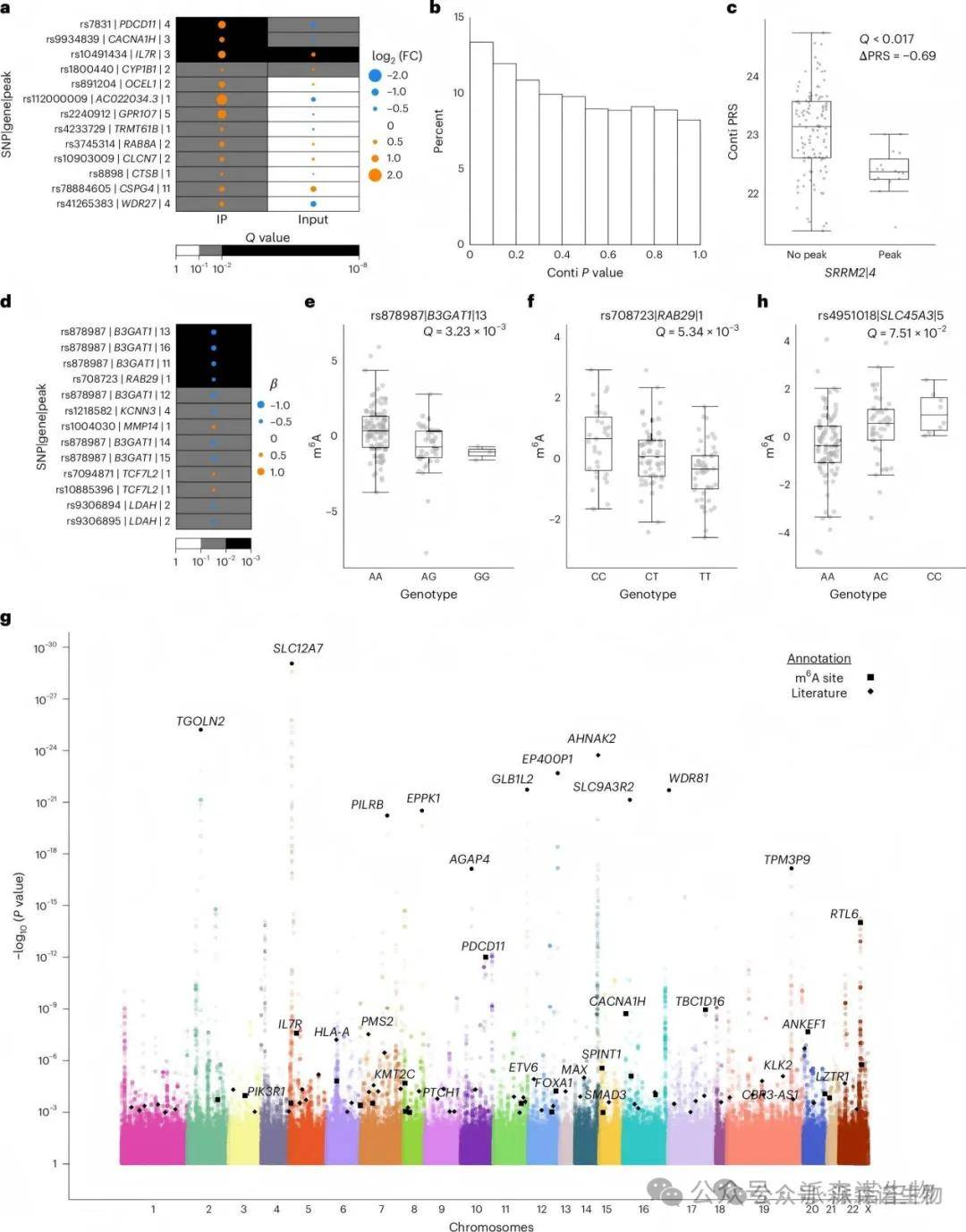
一些单核苷酸多态性与m6A位点存在重叠关系,显示A等位基因在活跃位点频率显著高于非A等位基因。分析发现多个SNP与m6A位点的等位基因不平衡相关,并与临床特征相关。识别出14,775个显著的m6A-QTLs,影响1,017个基因,包括60个癌症驱动基因。这些结果表明,种系遗传因素在m6A调控中发挥关键作用,影响前列腺癌的发生和发展。
4、缺氧引起的m6A广泛失调
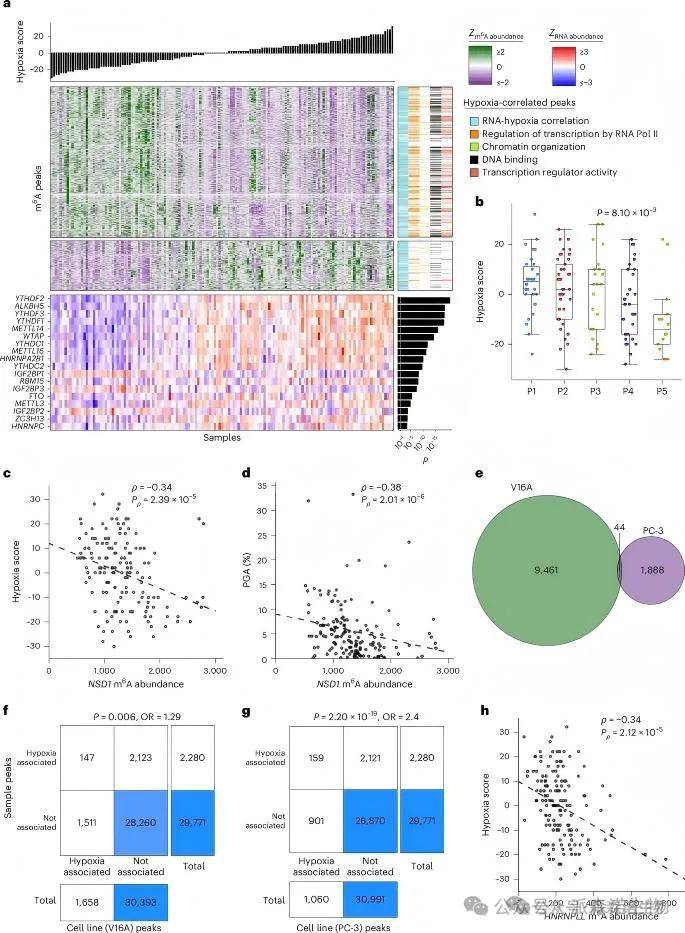
缺氧是局部前列腺癌的重要不良预后特征,关联肿瘤分级、侵袭性导管内癌及疾病复发。本研究识别出2,280个与缺氧相关的m6A峰,这些峰在缺氧肿瘤中丰度显著降低,主要集中于基因表达调控基因上。m6A调控因子的RNA丰度与缺氧状态呈相关性。此外,m6A患者亚型与缺氧关联,其中突变较少的P5群体为最规范氧群体。通过将V16A和PC-3细胞系暴露于0.2% O2 24小时,验证了缺氧相关的m6A峰,这些峰与原发患者的缺氧响应m6A峰显著重叠,进一步支持了缺氧与m6A分布之间的密切关联。
5、m6A作为前列腺癌患者预后的生物标志物
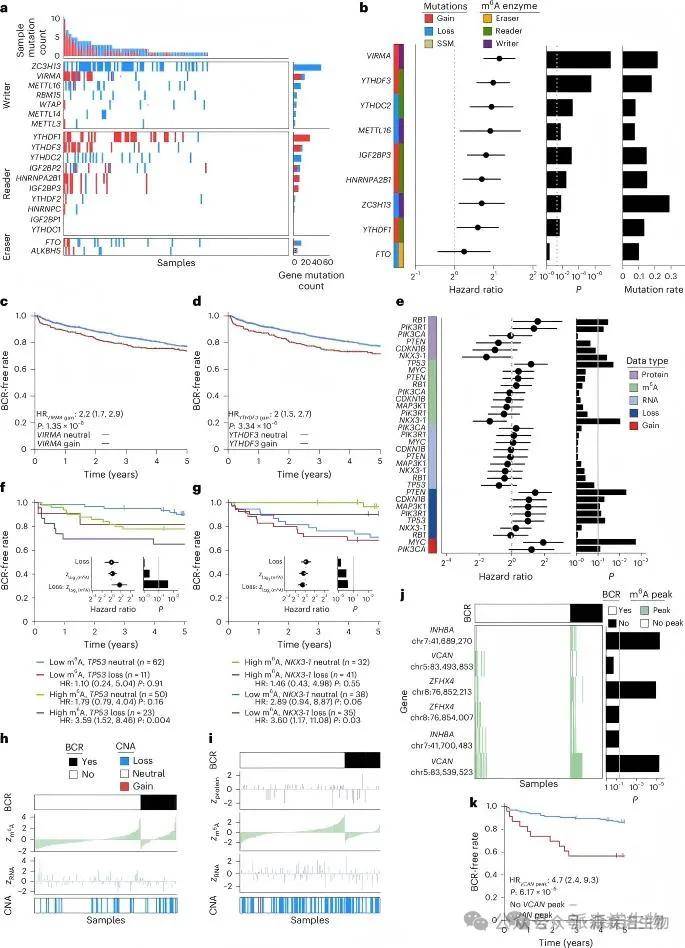
大多数肿瘤中m6A酶因体细胞突变而改变,且基因拷贝数丧失与RNA和蛋白丰度降低相关,这些变化在TCGA前列腺腺癌队列中得到了验证。分析1,239名患者的六个独立队列,发现拷贝数变化显著预测疾病复发。超过一半的m6A峰(3,432个)与前列腺癌驱动基因相关,富集于细胞组织和核酸代谢功能。生存分析显示,TP53和NKX3-1的m6A丰度与生化复发风险相关。此外,20,334个m6A峰的分析揭示,特定转录本上的峰与不良预后显著相关。
6、m6A修饰VCAN与前列腺癌进展显著相关
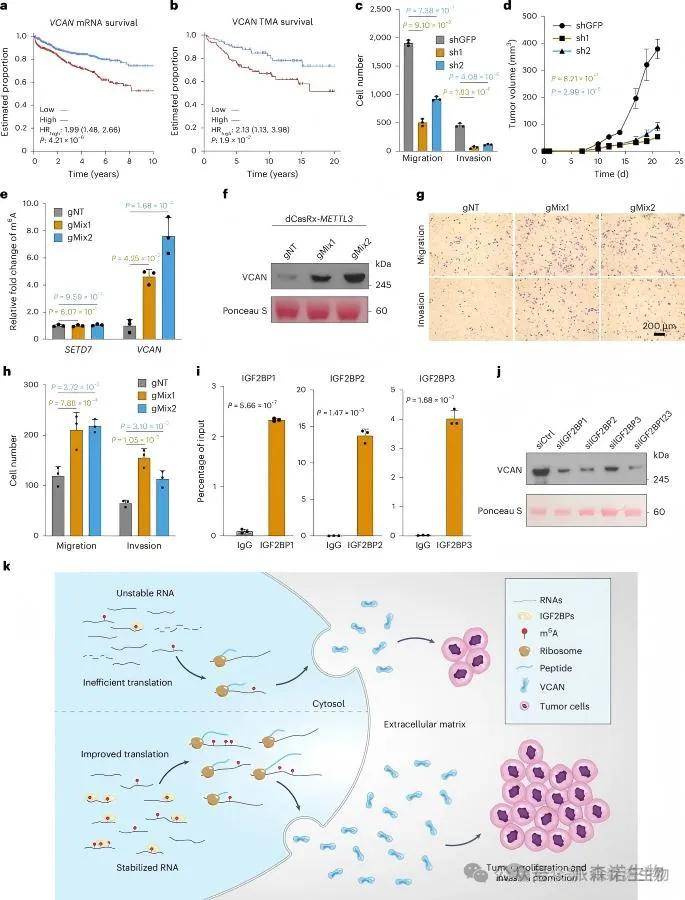
VCAN、INHBA和ZFHX4的RNA丰度在两个大型患者队列中显著相关,约15%的肿瘤中检测到VCAN m6A峰。VCAN作为细胞外基质的关键成分,其mRNA丰度在具有m6A峰的肿瘤中显著高于无m6A峰肿瘤,且与981名患者的预后显著相关。VCAN敲低显著抑制细胞增殖和迁移。研究发现m6A修饰通过稳定VCAN mRNA并促进其翻译,依赖于IGF2BP蛋白,增强前列腺癌细胞的侵袭性。
四、文章总结
本研究构建了前列腺癌m6A修饰的系统性图谱,涵盖162例局限性原发前列腺癌样本,结合meRIP-seq、WGS、RNA-seq和蛋白组等多组学数据,揭示了m6A修饰在肿瘤发生发展中的多层级调控机制。研究发现m6A修饰在不同患者中具有显著异质性,可划分出5个m6A亚型,与肿瘤分级、体积、IDC/CA分型、基因组不稳定性及术后复发密切相关。研究进一步识别出大量m6A-QTL,揭示种系遗传变异对m6A水平的调控,并发现缺氧可广泛影响m6A图谱。功能验证表明,VCAN等基因的m6A修饰可增强mRNA稳定性和翻译效率,促进细胞增殖与迁移,且与患者不良预后显著相关。整体而言,该研究揭示了m6A修饰与遗传背景、微环境因素及肿瘤表型之间的复杂交互,为前列腺癌的精准诊疗提供了新的靶点和生物标志物。