
2025-07-22

文章题目:SETD1B-mediated broad H3K4me3 controls proper temporal patterns of gene expression critical for spermatid development
中文标题:SETD1B介导的广泛H3K4me3修饰在精子细胞发育过程中对基因表达时序模式发挥关键调控作用
发表期刊:Cell Research
影响因子:25.9
发表时间:2025年3月
研究对象:小鼠发育过程中的精子
组学策略:ChIP-seq, RNA-seq, NOMe-seq

研究背景
生殖系在传递完整基因组和表观遗传信息中具有重要作用,雄性生殖细胞的发育过程称为精子发生,涉及复杂的分化阶段。此过程中的基因表达受到遗传和表观遗传因素的严格调控,尤其是染色质状态与转录调控的关系。研究发现,组蛋白H3K4me3在调控转录中起重要作用,特别是广泛的H3K4me3区域与精子细胞特异性基因相关。通过系统绘制11个精子发生阶段的染色质状态,我们发现广泛的H3K4me3区域在精子发生中始终存在,并与RNA聚合酶II的分布及基因表达的时序密切相关。Setd1b的缺失导致广泛H3K4me3的消失,进而影响阶段特异性基因的表达和精子发生。此外,抑制性组蛋白标记在减数分裂过程中的相互独立分布与转录输出及基因沉默相关,强调了表观遗传调控在精子发生中的重要性。
研究思路
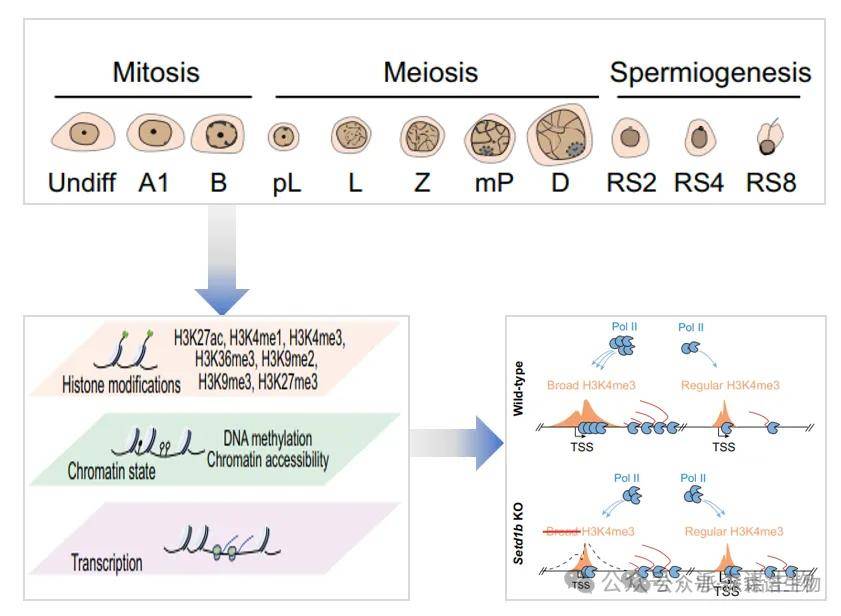
步骤1:染色质表观基因组分析
采用染色质免疫沉淀测序(ChIP-seq)分析11个发育阶段的雄性生殖细胞,揭示不同阶段的组蛋白修饰和非转录区域(NDRs)显著变化,特别是在减数分裂前细丝期精母细胞中NDRs数量最低。使用ChromHMM对基因组进行注释,显示阶段特异性基因在相关细胞阶段的活跃表观基因组特征。
步骤2:异染色质修饰重排分析
研究异染色质修饰的动态变化,发现H3K9me2在B型精原细胞阶段显著增加,而H3K27me3在mP阶段迅速重新建立。采用转录组分析,揭示关键基因的表达模式与这些修饰的关联,表明它们在精子发生中的重要调控作用。
步骤3:SETD1B对H3K4me3区域形成的调控
利用CRISPR/Cas9技术生成Setd1b基因敲除小鼠,评估其对广泛H3K4me3区域的影响。ChIP-seq分析显示SETD1B缺失导致Pol II和TAF3的重新分布,影响精子细胞的转录活性,最终导致男性不育和精子发生异常。
研究内容
1.小鼠精子发生过程中染色质表观基因组分析揭示发育阶段的染色质特征
为深入理解精子发生中的表观遗传动态,研究者收集了11个连续发育阶段的雄性生殖细胞,并系统分析了表观基因组修饰。染色质免疫沉淀测序检测了多种组蛋白修饰,结果表明不同阶段的组蛋白修饰和NDRs发生显著变化。进入减数分裂的前细丝期精母细胞具有最低的NDRs数量和DNA甲基化水平。
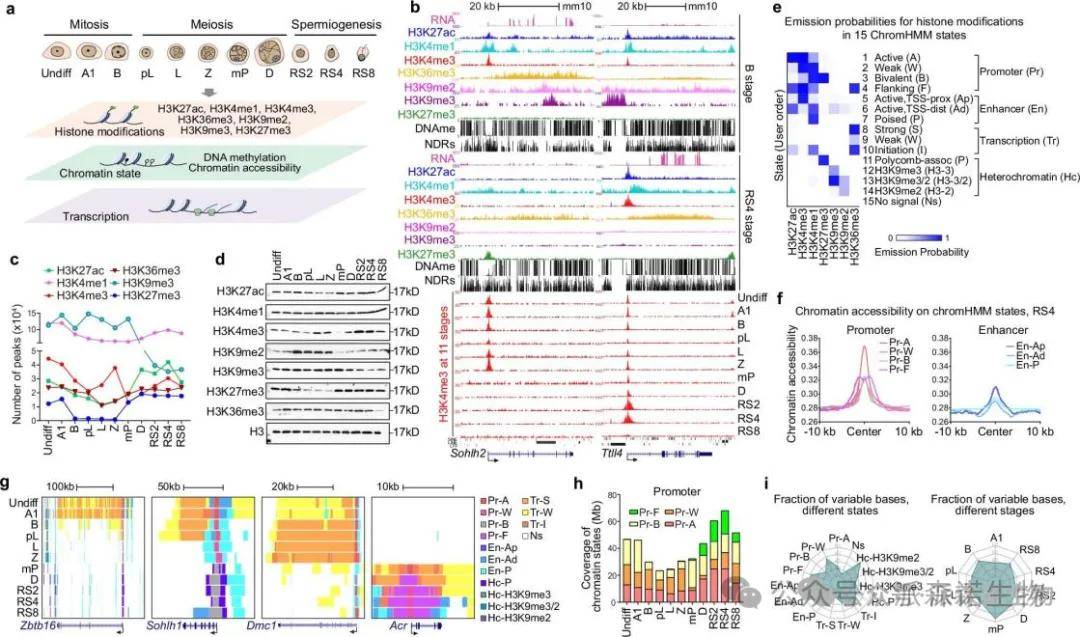
小鼠精子发生过程中染色质表观基因组图谱
为了追踪表观基因组动态,研究采用ChromHMM定义了15状态模型以注释精子发生过程中的基因组。启动子展现出最高的可及性和最低的DNA甲基化水平,阶段特异性表达的基因在相关细胞阶段展现活跃标记。约1.6%的基因组在相邻发育阶段间表现出染色质状态差异。研究发现,类型B精原细胞和中期粗线期精母细胞经历了最广泛的染色质状态变化,转录组数据显示这些阶段的基因表达模式显著变化。
2.有丝分裂到减数分裂过渡及减数重组和联会完成期间的异染色质修饰重排
男性生殖细胞发育中的异染色质修饰会发生重排。第一阶段始于B型精原细胞,H3K9me2显著增加,而H3K27me3明显减少,H3K9me3保持稳定。新产生的H3K9me2峰与H3K9me3峰不重叠,后者主要富集于LINE和LTR元素。减数分裂阶段的H3K9me2主要集中于抑制性基因,提示该修饰可能与减数分裂基因的抑制相关。
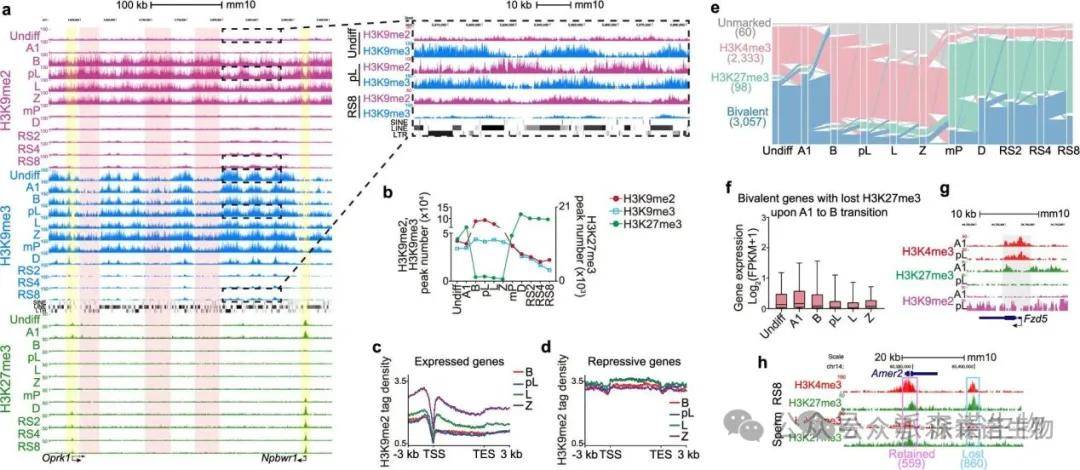
小鼠精子形成过程中抑制性组蛋白修饰的动态变化特征
第二阶段重排发生在mP阶段,H3K9me2和H3K9me3普遍减少,伴随转录激活。缺乏H3K9me2去甲基化酶Kdm3的精子细胞与多个精子发生关键基因下调有关。H3K27me3在mP阶段迅速重新建立,主要标记此后被沉默的基因,显示其在精子发生中的关键作用。两种抑制标记的切换与相关染色质修饰酶的表达变化密切相关。
3.精子保守且广泛H3K4me3和H3K27ac区域及超级增强子特征的建立
我们研究了精子形成过程中活性组蛋白标记的变化,发现H3K4me3和H3K27ac的广泛变化显著大于H3K4me1和H3K36me3。在细丝期/合子期和圆形精子细胞阶段,出现了两波H3K4me3的显著上升。第二波的H3K4me3上升与高水平的Pr-F状态相关,超过5136个启动子和增强子受到了广泛且强大的H3K4me3区域的修饰。这些区域不仅位于转录起始位点,还分布在数千个远端增强子区域,并在人的精子细胞中保守。
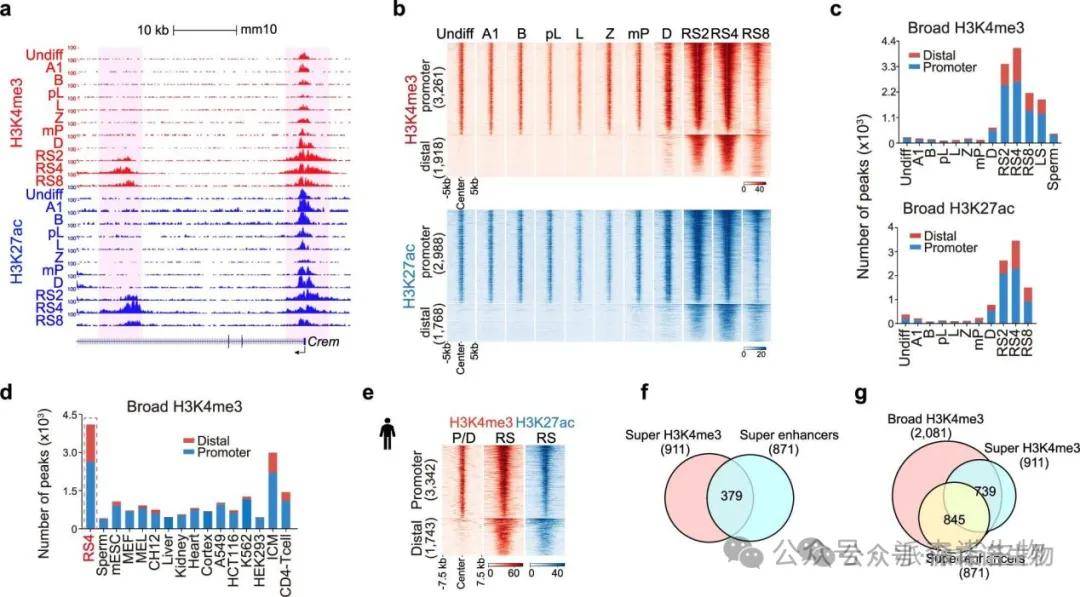
精子形成过程H3K4me3和H3K27ac区域的动态变化
尽管H3K4me3标记的增强子在大多数系统中呈现较弱信号,本研究发现精子细胞中的广泛H3K4me3区域无论与TSSs还是远端区域均显示出相似的信号强度。通过ROSE分析识别出911个超级H3K4me3区域,其中41.6%与超级增强子重叠,突显这些区域在精子中作为最活跃增强子的潜力。
4.精子中H3K4me3区域与与精子特异性相关高表达基因密切相关
精子中广泛H3K4me3区域与精子细胞特性相关的高表达基因密切相关,并与超级增强子显著重叠,显示出广泛的基因组覆盖。这些区域可能在精子细胞发育过程中发挥转录激活作用。
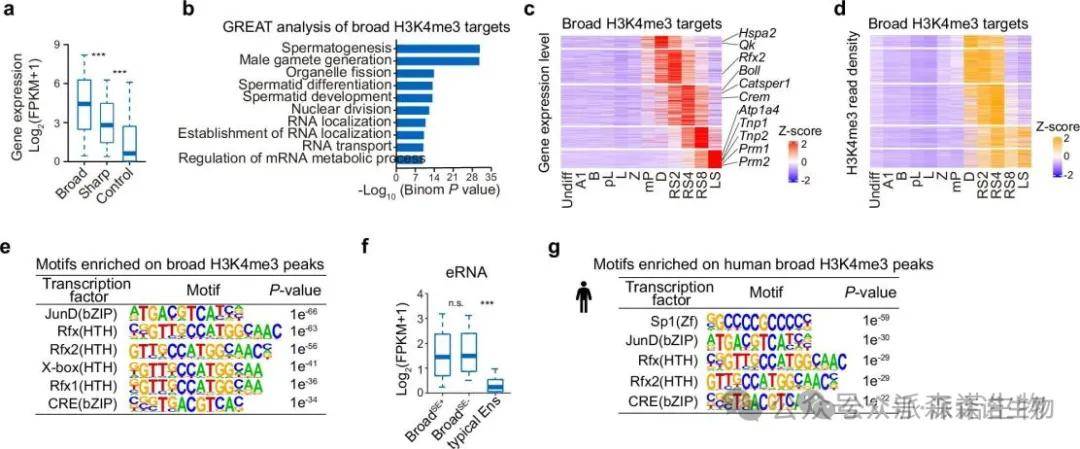
精子特异性H3K4me3区域与精子发生关键基因转录潜能密切相关
人类精细胞中,H3K4me3修饰区域的基因显示高转录水平,GO分析中表现出精子发生的功能富集。这些结果表明广泛H3K4me3区域与关键精子发生基因相关,并展现出阶段特异性表达模式。
5.SETD1B甲基转移酶对于精细胞广泛H3K4me3区域形成是必需的
在已知的六种KMT2甲基转移酶中,只有Setd1b的表达与广泛H3K4me3区域的形成相符,RNA-seq和单细胞RNA-seq数据进一步支持了这一发现。
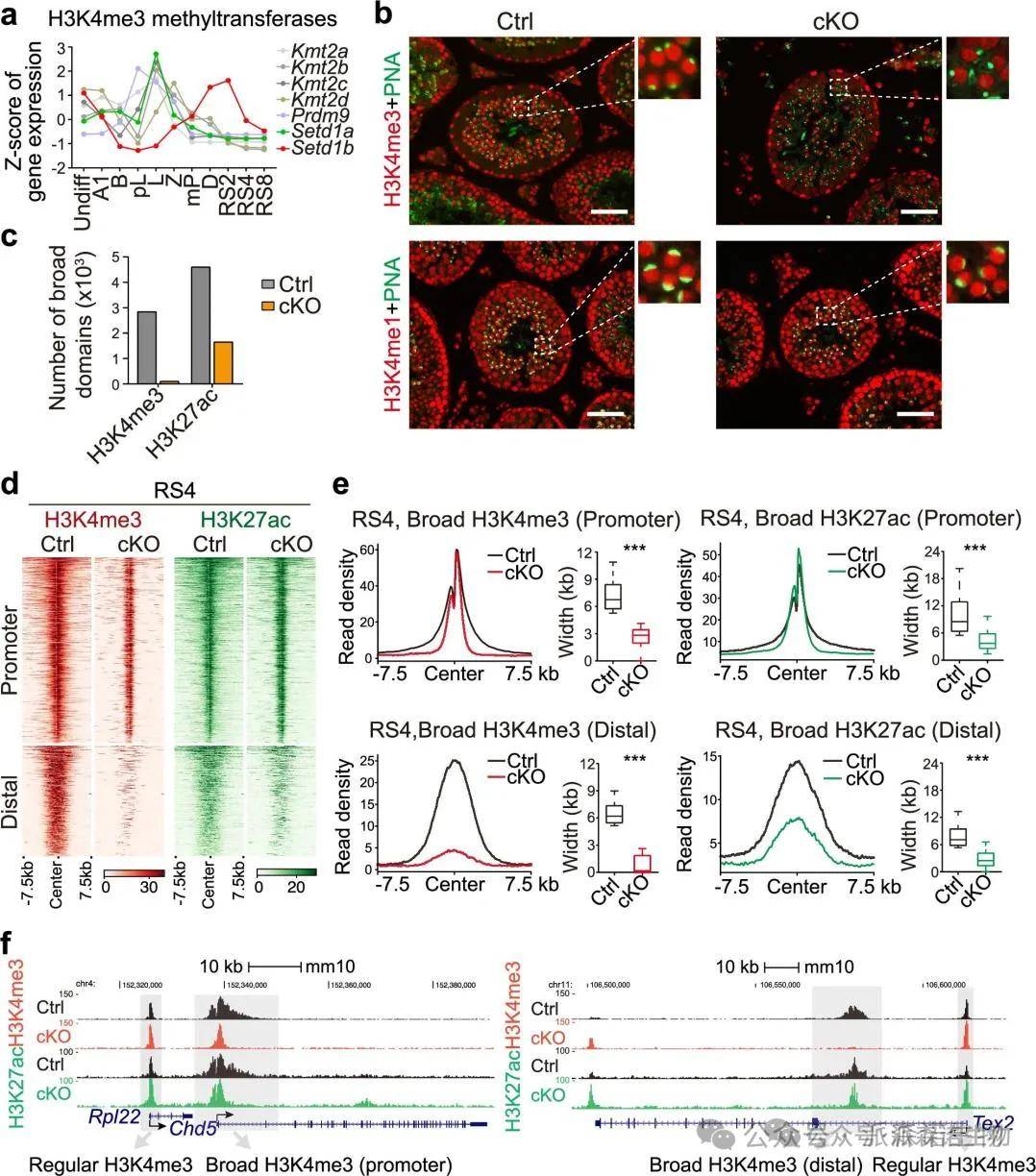
在精子发生过程中SETD1B负责建立广泛的H3K4me3区域
为了确认Setd1b在广泛H3K4me3区域形成中的作用,本文利用CRISPR/Cas9技术生成了Setd1b基因敲除小鼠。结果显示,Setd1b-KO小鼠的精子细胞中广泛H3K4me3信号显著降低,而常规H3K4me3信号未受影响。此外,远端增强子的H3K27ac显著减少,表明广泛H3K4me3区域的生成主要依赖于SETD1B。综合结果表明,SETD1B是精子细胞广泛H3K4me3区域的主要甲基转移酶。
6.SETD1B调控H3K4me3区域中的聚合酶II分布激活精细胞发育基因
H3K4me3与基因激活的关联已被确认,特别是通过TAF3与H3K4me3的相互作用及转录起始复合物(PIC)的组装。我们研究了SETD1B介导的广泛H3K4me3区域对发育中的精子细胞转录和Pol II占据的影响。在对照组和Setd1b-KO小鼠的精子细胞中,ChIP-seq分析显示,广泛H3K4me3区域的基因启动子处的Pol II和TAF3占据显著高于常规H3K4me3基因。随着精子发生细胞的发育,广泛H3K4me3启动子的核小体占据减少,并在50%的此类区域中发现了DNA低甲基化。
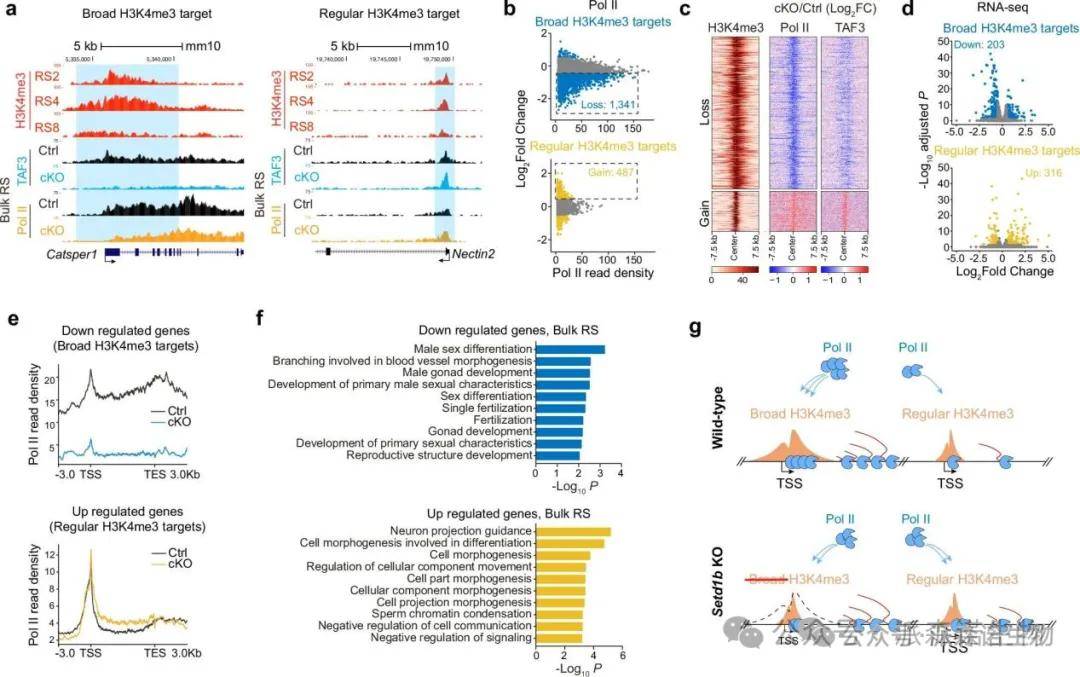
SETD1B缺失导致聚合酶II的重新分布和转录失调
Setd1b缺失导致H3K4me3覆盖的启动子、基因和增强子上信号降低,涉及1341个位点。常规H3K4me3位点的TAF3和Pol II占据增加,显示Pol II从广泛H3K4me3区域重新分布。RNA-seq数据支持这一发现,203个广泛H3K4me3靶基因的表达水平降低,而316个常规H3K4me3靶基因的转录水平增加。GO分析显示,下调的广泛H3K4me3基因富集于精子细胞发育相关功能,上调基因则与形态发生相关。
7.SETD1B通过RFX2介导H3K4me3调控精子发生中的阶段特异性基因表达,其缺失导致男性不育和精子发生异常
大规模的RS数据强调了SETD1B介导的广泛H3K4me3区域在促进PIC结合和基因激活中的关键作用。尽管Setd1b缺失对转录组中基因数量的影响不明显,但研究发现广泛H3K4me3相关基因在精子细胞发育中展现独特的时间表达模式。Setd1b-KO导致RS4中647个基因和LS中1125个基因下调,同时也出现874个基因在RS4和334个基因在LS中的上调。这表明SETD1B不仅促进转录输出,还决定阶段特异性基因的准确表达时机。
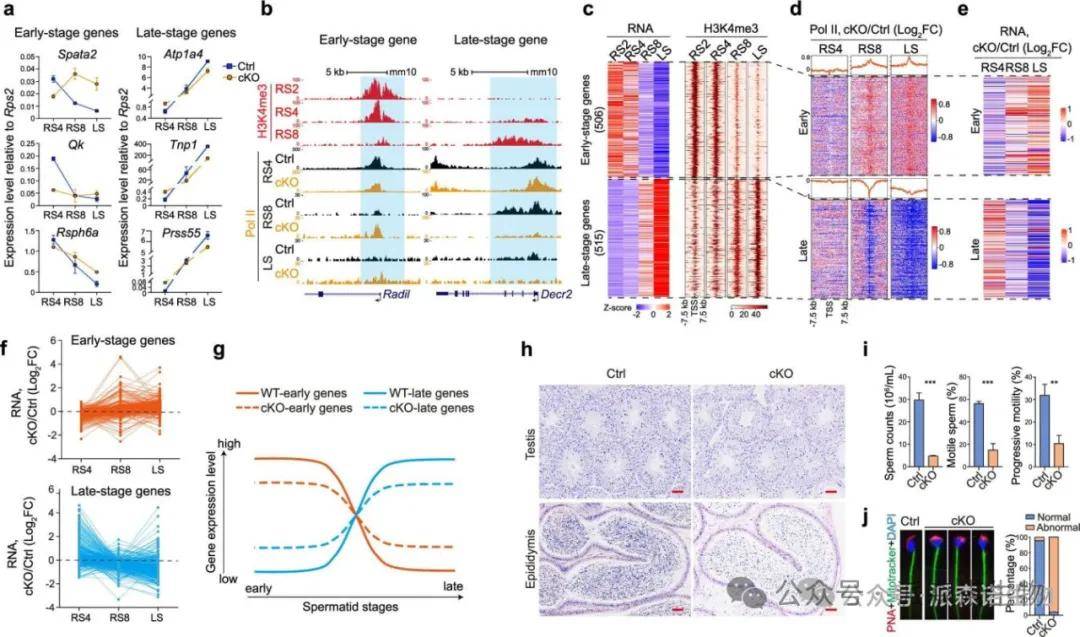
SETD1B介导H3K4me3确保了特异性基因的准确表达及精子细胞正常发育
SETD1B缺失导致Pol II分布的变化,造成精子细胞中“早期基因晚调,晚期基因早调”的现象。RFX2与SETD1B相互作用以建立广泛H3K4me3,且ChIP-seq数据显示RFX2缺失导致广泛H3K4me3的显著减少。Setd1b-KO小鼠表现出不育和精子发生异常,睾丸显著缩小,精子细胞发育受损,精子数量和活力降低。这些发现表明SETD1B介导的广泛H3K4me3在男性生育和正常精子发生中发挥着关键作用。