
2025-08-08

文章题目:Genome-wide DNA methylation-analysis of blastic plasmacytoid dendritic cell neoplasm identifies distinct molecular features
中文标题:全基因组DNA甲基化分析揭示浆细胞样树突状细胞肿瘤独特的分子特征
发表期刊:Leukemia
影响因子:12.8
发表时间:2024年
研究对象:FFPE组织切片
组学策略:WES, RNAseq、ATAC-seq

研究背景
浆细胞样树突状细胞肿瘤(BPDCN)是一种罕见且高度侵袭性的恶性肿瘤,起源于浆细胞样树突状细胞(pDCs),主要表现为皮肤受累,随后扩散至骨髓及其他器官。作者对45例BPDCN患者进行了全基因组DNA甲基化分析,并结合全外显子组测序(WES)、RNA测序及特定病例的ATAC-seq分析。结果显示,BPDCN的DNA甲基化特征在从早期和成熟树突状细胞向恶性转化过程中显著丧失。DNA甲基化特征能够有效区分BPDCN与急性髓系白血病(AML)、慢性髓系白血病(CMML)和T细胞急性淋巴细胞白血病(T-ALL),其中BPDCN表现出最明显的全局去甲基化、细胞分裂应激及局部DNA超甲基化,导致肿瘤抑制基因的显著失活。利用MethylCIBERSORT进行的肿瘤微环境DNA甲基化分析显示存在两个预后相关的簇(IC1和IC2),具有特定的细胞组成和突变谱。此外,BPDCN的转录亚组(C1和C2)在白细胞介素/炎症信号通路基因的DNA甲基化特征上存在差异,C2表现出更高的转录因子活性(如JAK-STAT和NFkB信号通路),而C1-BPDCN则依赖于EZH2。此研究的综合分析为BPDCN提供了新的分子见解和潜在的诊断应用。
研究思路
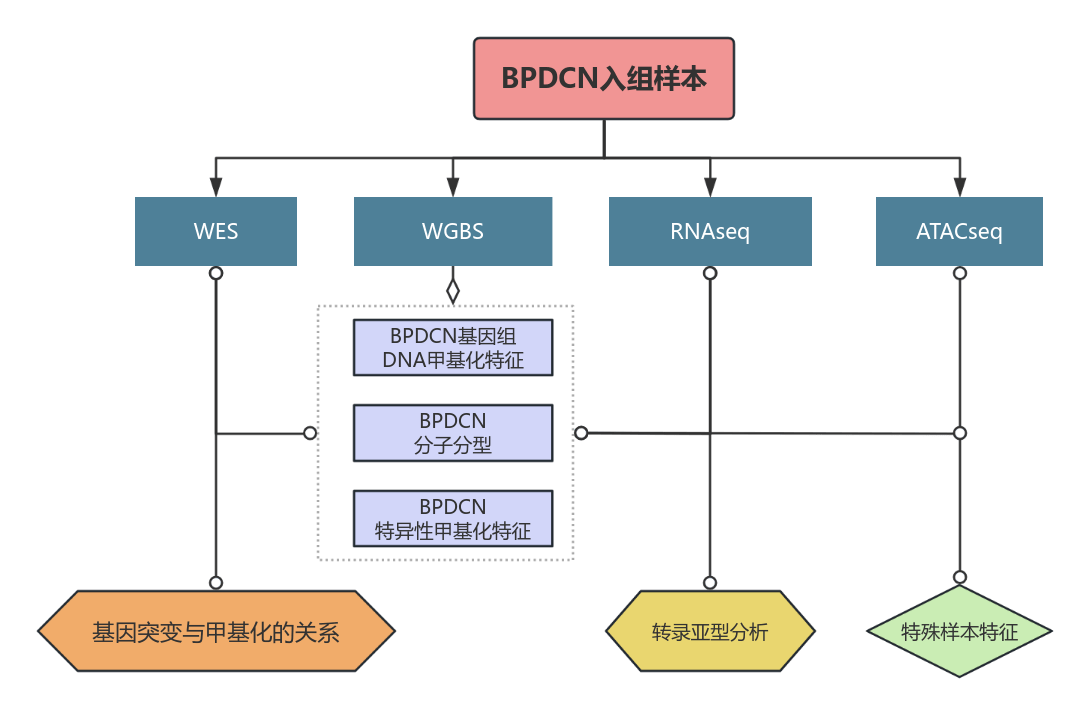
步骤一
DNA甲基化全局特征分析:揭示BPDCN的DNA甲基化特征在从早期和成熟树突状细胞向恶性转化过程中显著丧失,与急性髓系白血病(AML)、慢性髓系白血病(CMML)和T细胞急性淋巴细胞白血病(T-ALL)相比,BPDCN表现出最明显的全局去甲基化、细胞分裂应激及局部DNA超甲基化,导致肿瘤抑制基因的显著失活。
步骤二
DNA甲基与转录组联合分析:通过MethylCIBERSORT进行的肿瘤微环境DNA甲基化分析显示存在两个预后相关的簇(IC1和IC2),这两个簇具有特定的细胞组成和突变谱。BPDCN的转录亚组(C1和C2)在白细胞介素/炎症信号通路基因的DNA甲基化特征上存在差异,其中C2表现出更高的转录因子活性(如JAK-STAT和NFkB信号通路),而C1-BPDCN则依赖于EZH2。
步骤三
DNA甲基化与WES联合分析:通过全外显子组测序发现,BPDCN患者的C1亚型突变负担较高,支持C2亚型是由于DNA甲基化失调引起的。发现突变与细胞增殖增加显著相关,且启动子区域的超甲基化与整体甲基化水平显著相关。
步骤四
FFPE-ATAC-seq验证的结果显示,在BPDCN的C1亚群中,CDK6和STAT5A等高度表达位点具有显著的染色质可及性,这与DNA甲基化和转录结果一致。
研究内容
1.表观遗传特征分析显示关键调控通路的显著失调主要源于DNA甲基化的丧失
为评估影响DC向BPDCN转化的表观遗传过程,并定位该实体在血细胞谱系中的位置,首先对BPDCN及外周血中多种细胞类型进行PCA分析。结果显示,BPDCN与DC亚群之间存在显著差异,早期和成熟DC的基因组平均DNA甲基化水平显著较高,表明在转化过程中的甲基化丧失。此外,差异甲基化区域分析发现,细胞外基质、胶原调节和神经系统相关基因的DNA甲基化显著降低,并影响了KRAS信号通路等致癌驱动过程。
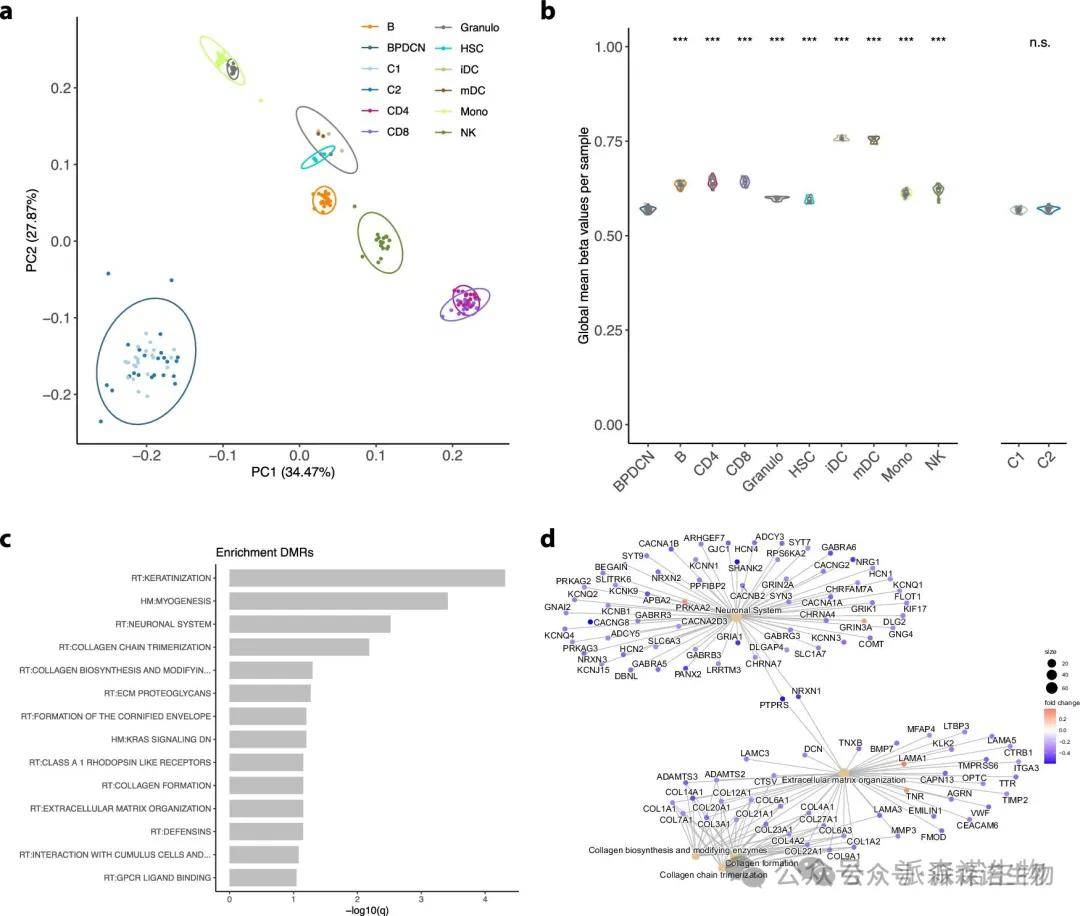
BPDCN及分选的造血细胞群体的表观遗传谱
2.BPDCN具有独特DNA甲基化特征,显示出明显甲基化丧失和与细胞分裂基因相关的表观遗传变化
BPDCN的DNA甲基化特征与相关疾病显著不同,但存在一些特殊病例。为了解DNA甲基化在BPDCN与其他疾病间的诊断潜力,作者比较了BPDCN与BEAT-AML、CMML的甲基化数据。结果显示,这些样本在分析中被分为不同的类别,BPDCN与T-ALL和恶性黑色素瘤的区别更加明显。
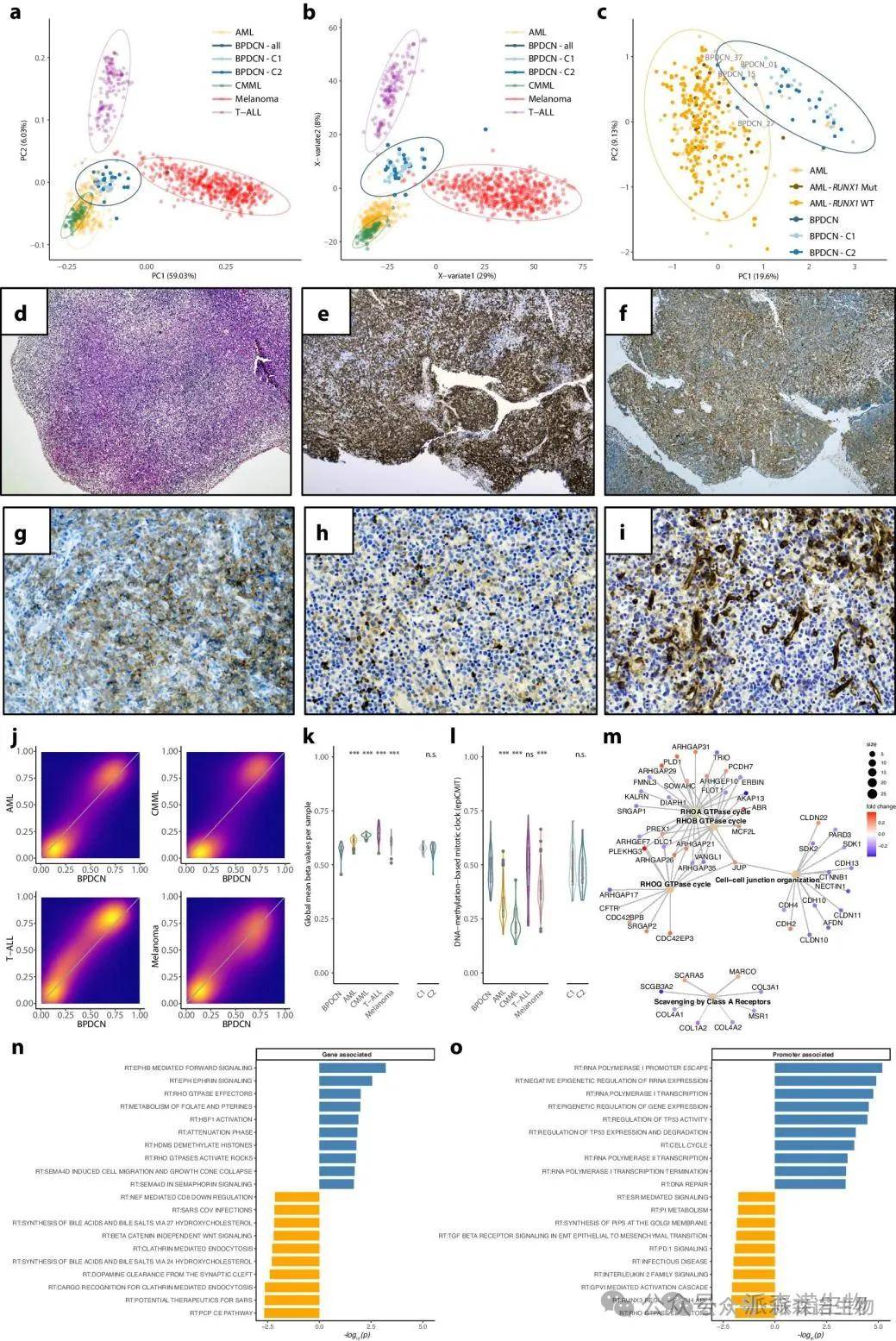
BPDCN与AML、CMML、T-ALL和黑色素瘤DNA甲基化特性的比较
在四个特殊病例中,DNA甲基化存在显著重叠,且三例同时表现出急性白血病和转化的CMML特征。BPDCN显示出最高的甲基化丧失,且这种丧失在不同亚型中都很明显,并且BPDCN的细胞分裂加速,反映其侵袭性的临床特征。
3.与CMML和AML相比,BPDCN中肿瘤抑制基因DNA甲基化高度失调
为了研究BPDCN中特异性DNA甲基化特征,对CMML和AML也进行了抑癌基因DNA甲基化分析。
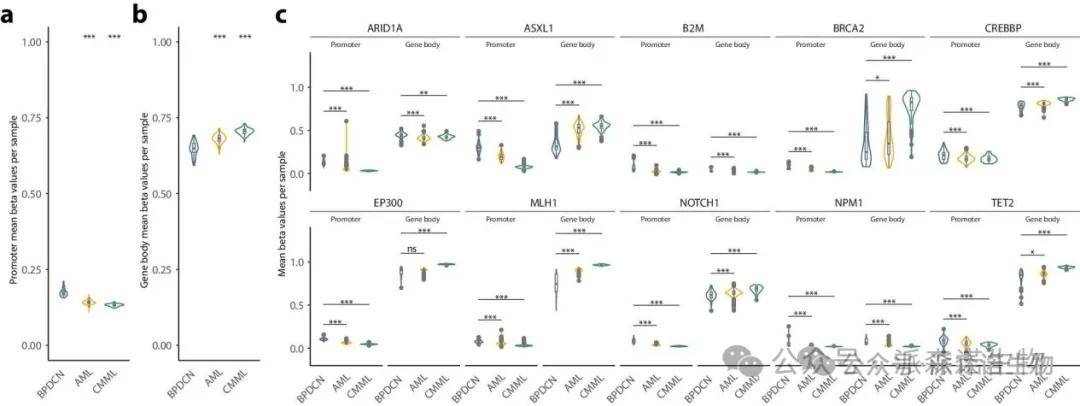
BPDCN、AML和CMML中肿瘤抑制基因的DNA甲基化特征
BPDCN表现出明显失调的DNA甲基化特征和全局甲基化丧失,肿瘤抑制基因的启动子区域甲基化水平显著高于CMML和AML,而基因体区域的甲基化水平则显著较低。这表明BPDCN中的失调DNA甲基化具有显著的致癌影响。此外,研究发现从CMML到BPDCN,DNA甲基化失调特征与临床侵袭性增强呈正相关。
4.DNA甲基化模式和基因表达特征区分BPDCN的C1和C2亚型,并塑造C2-BPDCN中JAK/STAT驱动特征
研究表明,BPDCN的C1和C2亚型在DNA甲基化模式和基因表达特征上存在显著差异。在差异DNA甲基化分析中,作者发现114个探针在C1和C2之间的甲基化水平显著不同,C2-BPDCN中与细胞因子和JAK/STAT信号通路相关的基因表现出更高的甲基化水平,而C1则显示出与翻译后修饰和代谢过程相关的显著甲基化。
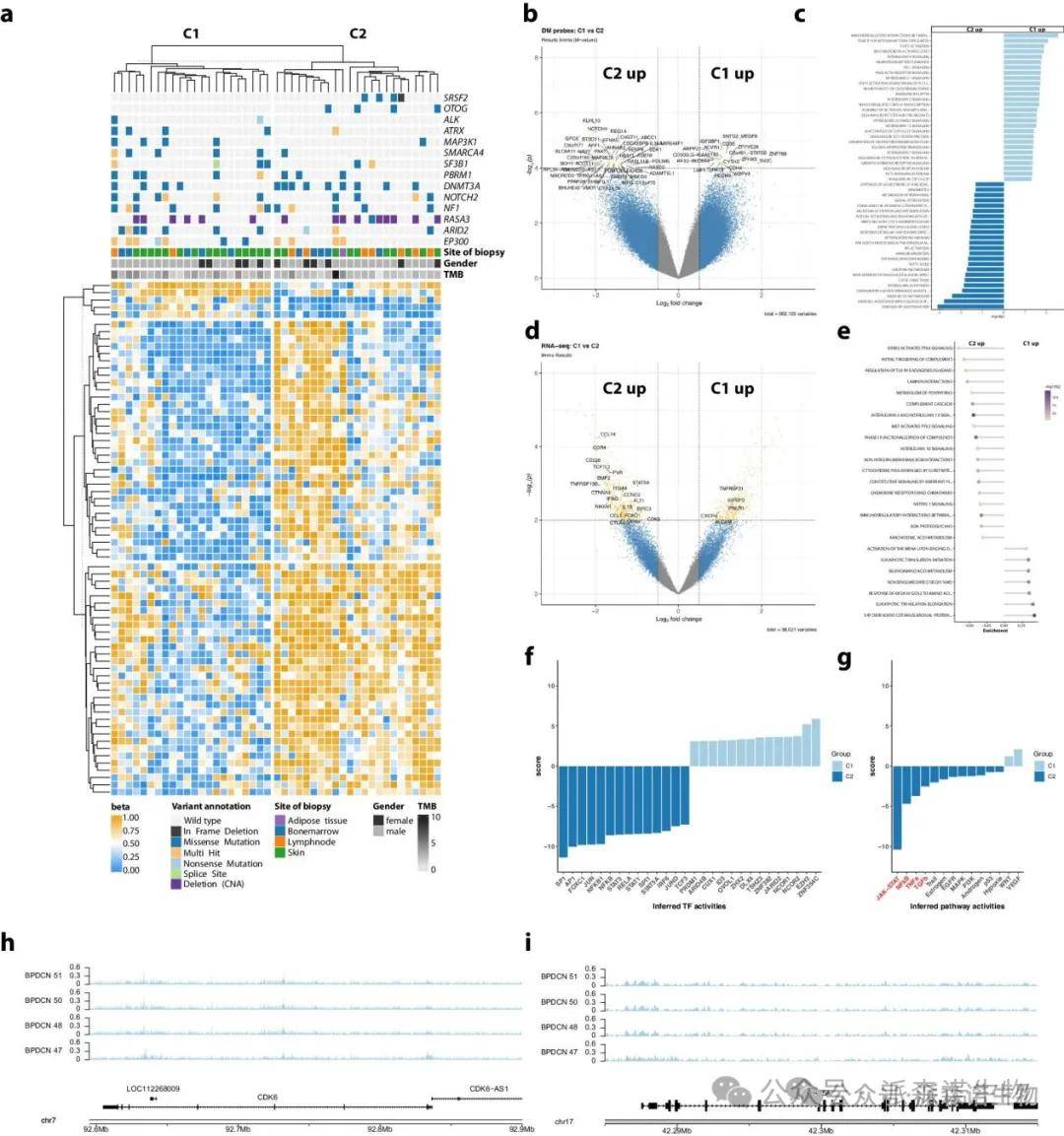
BPDCN亚型C1和C2中的差异DNA甲基化、转录和突变模式
基因表达分析显示C2亚型中先天、适应性免疫过程及细胞外基质相互作用的上调,同时STAT5A、CDK6等关键基因在C2中表达显著升高。相关性分析揭示了DNA甲基化与基因表达之间的显著关联。进一步的转录因子活性推断显示,C2-BPDCN中NFkB和JAK-STAT信号通路的活性显著增强,而C1-BPDCN则依赖于EZH2,揭示了两种亚型在转录调控上的潜在差异。这些发现为BPDCN的个性化治疗提供了新的思路。
5.通过MethylCIBERSORT和免疫组化分析的肿瘤微环境揭示了与肿瘤基因组相关的不同免疫亚型
为了评估肿瘤微环境(TME),作者对45个高质量全基因组的DNA甲基化谱进行全面的MethylCIBERSORT分析,预测出两种TME类别(IC1和IC2)。IC1亚型表现出单核细胞、B细胞和自然杀伤(NK)细胞的减少,同时调节性T细胞富集,并且中性粒细胞和细胞毒性T细胞的数量有所上升。皮肤样本中的角质形成细胞比例显著高于非皮肤样本。
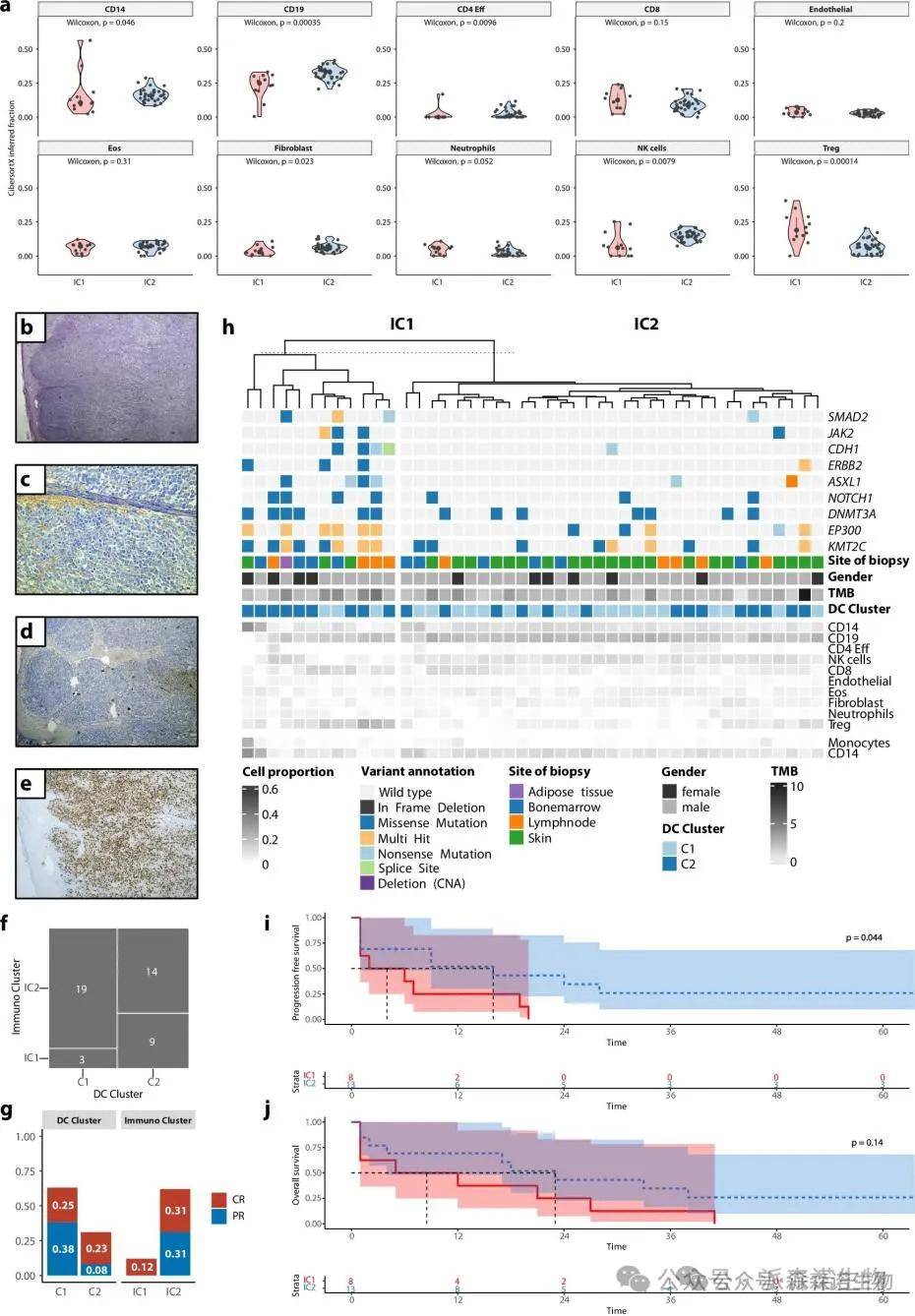
通过MethylCIBERSORT分析的肿瘤免疫组成揭示具有不同免疫原性的细胞簇
通过免疫组化(IHC)验证了肿瘤浸润的T细胞与单核细胞之间的显著相关性。TME与突变谱的分析显示,影响多种肿瘤相关基因突变在IC1中富集,且此类患者的无进展生存期显著缩短。同时,免疫组化和MethylCIBERSORT分析揭示了T细胞和单核细胞在IC1与IC2中的不同富集特征。epiCMIT结果表明,IC2的增殖压力显著高于IC1。此外,C1/C2与IC1/IC2之间的总体响应率存在显著差异,提示不同免疫亚型对患者生存预后具有重要影响。
6.突变驱动因子及表观遗传调控因子的启动子状态影响BPDCN增殖命运和DNA甲基化谱
为提供本研究中DNA甲基化谱的基因组背景,作者对未参与先前BPDCN分子研究的患者进行了全外显子组测序(WES)。结果显示,C1 BPDCN的突变负荷较高,支持C2-BPDCN的非突变机制,如失调的DNA甲基化和转录谱。C2簇内的表观遗传特征与DNMT3A的改变频率相关,并在剪接基因SRSF2中观察到显著突变富集。
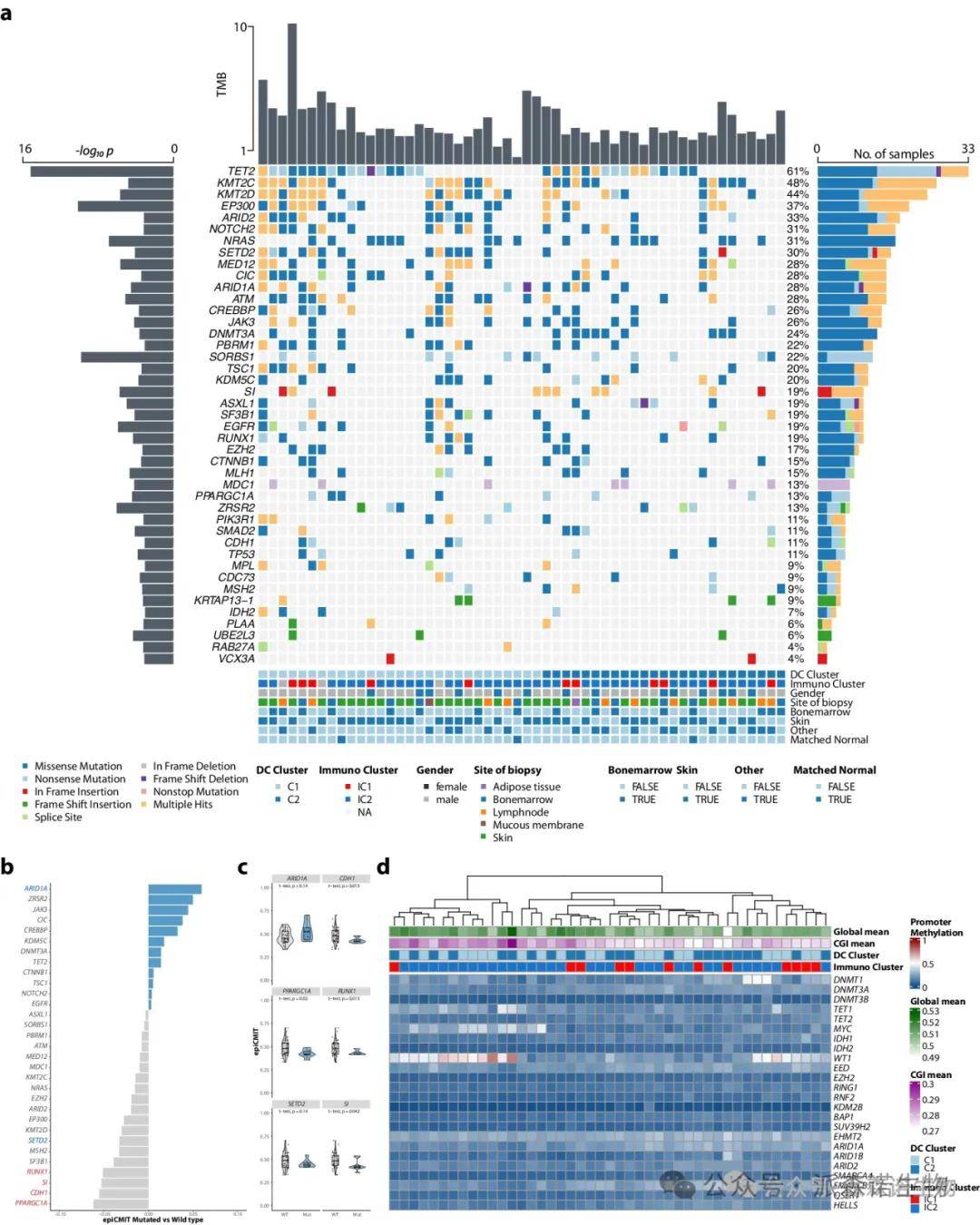
显著驱动突变和表观遗传调控因子的DNA甲基化状态对增殖和CGI DNA甲基化的影响
作者还探讨了特定突变驱动因子与增殖历史的关系,发现携带ARID1A、ZRSR2等突变的病例增殖潜力上升,而携带PPARGC1A等突变的病例则显著降低有丝分裂活性。这表明BPDCN的增殖潜力由突变驱动事件决定。此外,作者研究与表观遗传调控相关基因的启动子甲基化状态,发现多基因启动子甲基化与整体CGI甲基化显著相关,提示其对BPDCN的表观遗传景观有重要影响。
文章总结
本文针对BPDCN的45例患者进行了全基因组DNA甲基化分析, 并辅以WES、RNA测序和特定病例的ATAC-seq。研究发现,在从早期和成熟树突细胞向BPDCN的恶性转化过程中,DNA甲基化显著丧失。BPDCN的DNA甲基化谱与AML、CMML和T-ALL之间存在显著差异,BPDCN表现出明显的全局去甲基化、细胞周期压力和局部的DNA高甲基化,导致肿瘤抑制基因的显著失活。利用MethylCIBERSORT对肿瘤微环境的DNA甲基化分析,识别出两个具有预后相关性的细胞簇(IC1和IC2),它们在细胞组成和突变谱方面具有特异性。并且BPDCN的转录亚组(C1和C2)在白细胞介素/炎症信号基因的DNA甲基化特征上存在差异,C2组表现出较高的转录因子活性,尤其是在JAK-STAT和NFkB信号通路中,而C1则依赖于EZH2。 通过全外显子组测序发现,BPDCN患者的C1亚型突变负担较高,支持C2亚型是由于DNA甲基化失调引起的。通过FFPE-ATAC-seq验证发现,在BPDCN的C1亚群中,CDK6和STAT5A等高度表达位点具有显著的染色质可及性,这与DNA甲基化和转录结果一致。