2025-08-12

文章亮点
直接证实了肠道菌群对肥胖个体T2DM易感性的因果影响。
强调了在“肥胖前期”通过FMT干预进行糖尿病预防的可行性和重要性。
深入阐明了FMT改善代谢健康的多种机制(改善胰岛素信号、减轻炎症、调节菌群组成与代谢物)。
突出了特定有益菌(如嗜黏蛋白阿克曼菌)和代谢物(如丁酸盐)的关键作用。
为将FMT拓展应用于代谢性疾病预防领域提供了有力的科学依据。
研究背景
肥胖是2型糖尿病(T2DM)的易感因素之一,两者都会加速人体衰老并带来诸多危害。本研究使用 16S rRNA 和靶向代谢组学评估了微生物群对肥胖大鼠 T2DM 易感性的定向影响,揭示肠道稳态可能是控制肥胖和预防 T2DM 的关键,多角度分析了肠道微生物群在肥胖向 T2DM 演变过程中的指向性。
研究思路
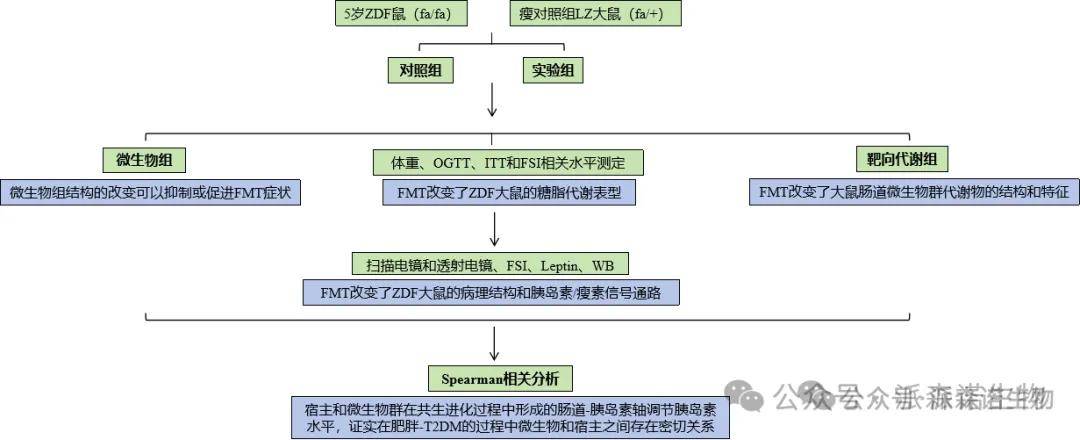
研究方法
微生物组、靶向代谢组
研究结果
1.FMT改变了ZDF大鼠的糖脂代谢表型
在供体组中,所有代谢评估指标都表明,ZDF 组成功诱导了肥胖 T2DM 模型,且与 LZ 组有显著差异。ZDF受体大鼠中,移植正常微生物群的大鼠体重增加显著下降,而移植肥胖-T2DM微生物群的大鼠体重增加呈上升趋势,Z-Zg组的腹围显著增加,Z-P组和Z-Zg组的随机血糖明显高于Z-Lg组。血脂的变化表明,Z-Lg 组优于 Z-P 组。口服葡萄糖耐量试验(OGTT)和胰岛素耐量试验(ITT)显示,Z-Lg组的葡萄糖耐量和胰岛素耐量优于Z-P组和Z-Zg组,表明移植LZ肠道微生物群改善了ZDF大鼠的胰岛素抵抗。
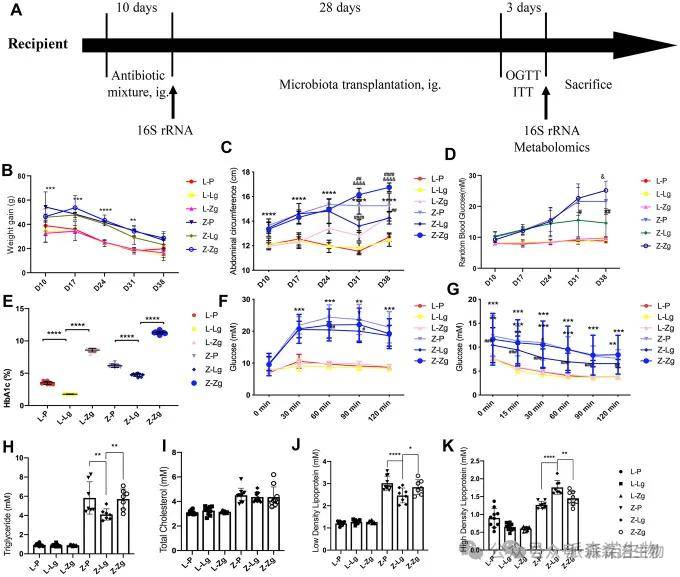
图1 移植前后受体大鼠糖脂代谢表型的变化
2.FMT 对大鼠肠道群落的影响
根据LZ和ZDF大鼠的肥胖和T2DM病进展以及微生物组变化,对照组LZ大鼠对移植的LZ或ZDF大鼠微生物组没有显示出显著的反应,这与ZDF大鼠不同。据推测,ZDF大鼠对肥胖和T2DM的易感性增加。在此基础上,微生物组结构的改变可以抑制或促进FMT症状,这为肠道微生物组在T2DM进展中的定向作用增加了证据。
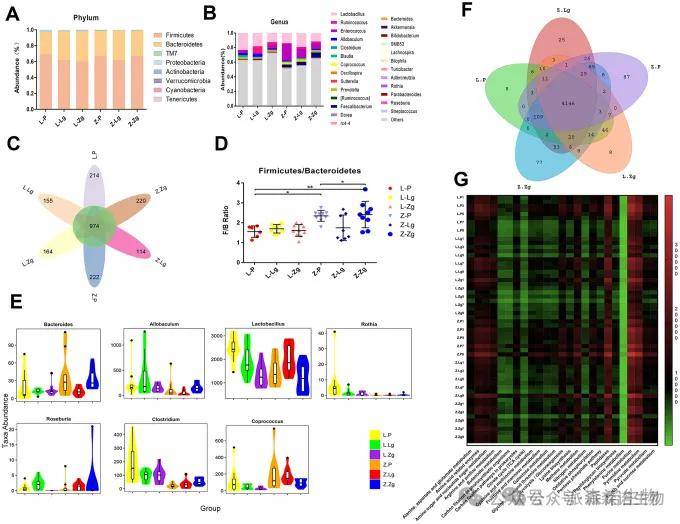
图2 FMT之后每个类群中的特定门和属
3.FMT改变了ZDF大鼠的病理结构和胰岛素/瘦素信号通路
移植瘦对照组大鼠的微生物群可以通过调节胰岛素抵抗和瘦素抵抗来减轻基因缺陷导致的糖代谢功能障碍,而移植肥胖 T2DM 大鼠的微生物群则会加重 胰岛素抵抗(IR)和瘦素抵抗(LR)。
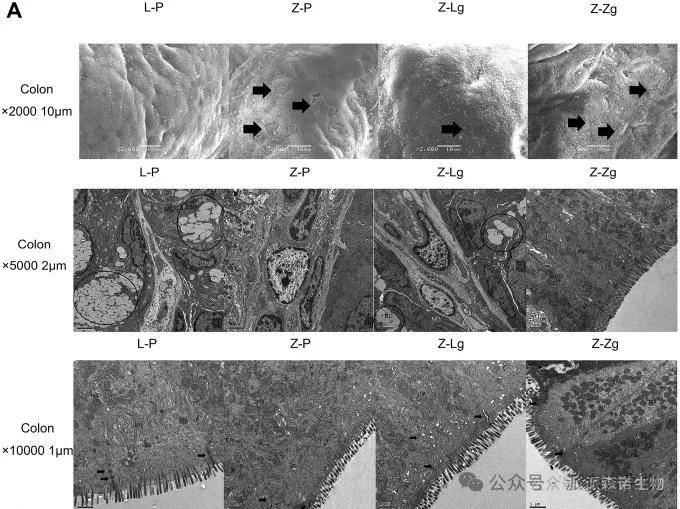
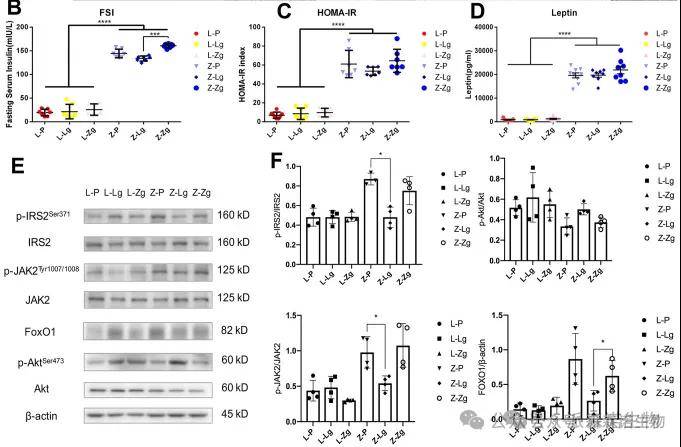
图3 FMT 对大鼠肠道病理结构、IR 和 LR 的影响
4.FMT改变ZDF大鼠的肠道代谢结构和特征
为了确定不同样本代谢物之间的异同,对所有差异代谢物进行了自然聚类。结果表明:Z-P 组和 Z-Zg 组的某些代谢物具有特定的聚类效应,与 L-P 组或 Z-Lg 组有显著差异。经统计分析得到的排名靠前的代表性差异代谢物方框图中,移植 LZ 大鼠微生物群后,代谢物转变为 L-P 对照组的代谢结构,而移植 ZDF 大鼠微生物群后代谢方向完全改变。
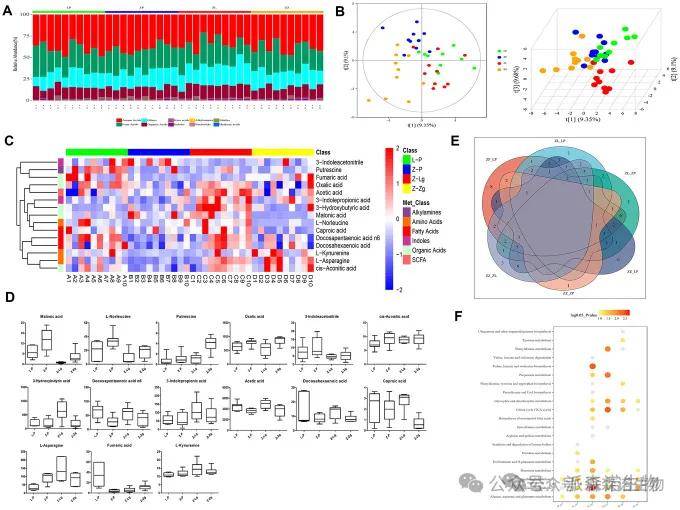
图4 FMT后ZDF大鼠肠道菌群的代谢产物组成
5.宿主表型、肠道微生物群和代谢物之间的潜在关系
通过计算Spearman相关系数生成相关矩阵,来全面分析宿主表型、肠道微生物群和肠道微生物代谢物之间的关系。发现:宿主与微生物群在共生进化过程中形成的肠-胰岛素轴调节胰岛素水平,证实了微生物与宿主在肥胖-T2DM 过程中存在密切关系。
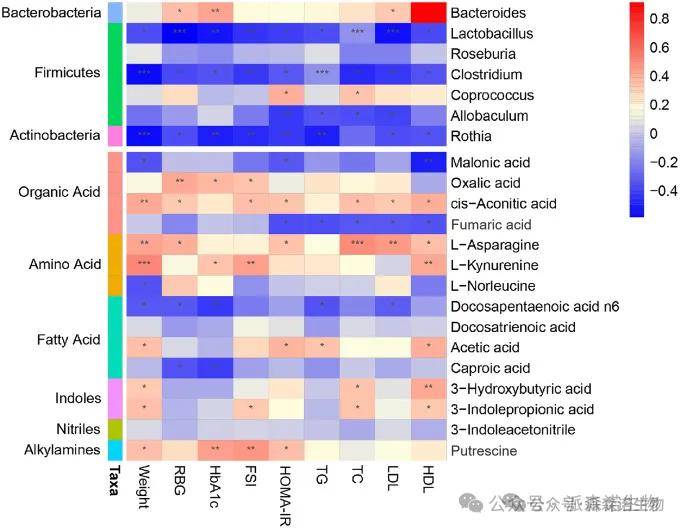
图5 肠道微生物组、表型和代谢组的三层分析关联整合图
结 论
本研究揭示了肠道微生物群在引导肥胖症向T2DM发展过程中的作用。肠道微生物群更多地参与了催化疾病的进展,而不是引发疾病。FMT与个性化益生菌的组合或添加“缺失”的肠道细菌菌株可能会增强传统治疗策略的效果。这一发现为利用FMT预防和治疗T2DM提供了新的思路,期望通过调整饮食结构或提供治疗性FMT可以降低胰岛素抵抗,控制肥胖,延缓和逆转T2DM的发展。
参考文献
Zhang L, Zhou W, Zhan L, et al. Fecal microbiota transplantation alters the susceptibility of obese rats to type 2 diabetes mellitus[J]. Aging (Albany NY), 2020, 12(17): 17480.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7521520/


