
研究物种:小鼠
发表期刊:Carbohydrate Polymers
发表时间:2023年
影响因子:12.5
文章亮点
创新性地发现并证实了Usp10是羊肚菌多糖(MEP)保肝作用的关键上游靶点。
系统阐明了MEP通过激活Usp10,一方面抑制NF-κB炎症通路,另一方面激活Nrf2抗氧化通路,从而协同发挥强大保肝作用的分子机制。
利用严谨的基因敲低/敲除实验验证了Usp10在此机制中的核心枢纽作用。
为天然产物保肝机制研究开辟了新视角,并提升了羊肚菌作为保肝功能性资源的应用价值。
研究背景
酒精性肝病(ALD)是由长期过量饮酒引起的,其特征是脂肪在肝脏中积聚,并逐渐发展为脂肪变性,伴有炎症、肝纤维化和肝硬化。全球超过7500万人患有酒精使用障碍,患酒精相关肝病的风险很高。酒精及其代谢产物促进肠道微生态失调,增加肠道通透性,并诱导细菌产物从肠道转移到肝脏,从而诱导促炎因子的产生,从而促进ALD的发展。
羊肚菌(Morchella esculenta,ME)是一种高营养价值的独特药用和食用同源真菌,主要生长在中国、韩国、日本和欧洲阔叶或混交针叶林的腐殖质层中。ME主要用于治疗消化不良、痰相关疾病和呼吸急促。在酒精诱导的急性肝损伤小鼠模型中,ME通过调节NF-kB/Nrf2信号通路具有肝脏保护作用。然而,MEP在慢性酒精性肝损伤中的详细结构和疗效分析及其潜在机制尚未系统报道。本研究基于对肠道微生物组、代谢组和蛋白质组分析,为MEP2在慢性酒精诱导的肝损伤中的应用提供了实验证据。
研究思路
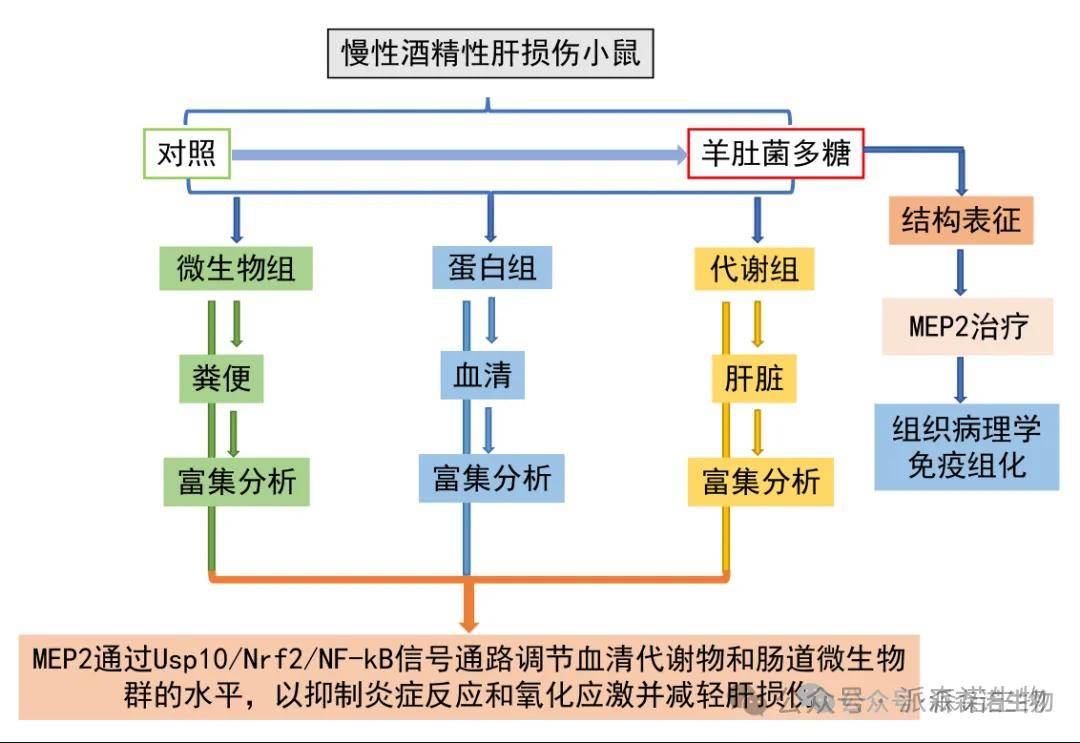
研究方法
微生物组、转录组、蛋白质组
研究结果
MEP2的纯化与结构表征
使用DEAE-52色谱柱纯化MEP(图1A),并分析了MEP-A、MEP-B和MEP-C对酒精诱导的细胞损伤的保护作用。MEP-A和MEP-B均在HepG2细胞中表现出较强的保护作用(图1B)。MEP2由单糖Glc(90.971%)、Gal(0.161%)、Man(0.145%)和Glc-UA(0.094%)组成(图1G)。分子量(Mw)为510至980 kDa的多糖是MEP2的主要成分(约63.4%,图1H)。MEP2的平均Mw为959 kDa(图1I)。
采用核磁共振波谱进一步分析了MEP2的结构特征。利用扫描电镜观察MEP2的微观结构和形貌特征。大多数MEP2残基具有纸状结构,只有少数残基呈棒状或线圈状,表明MEP2具有无定形结构(图2)。
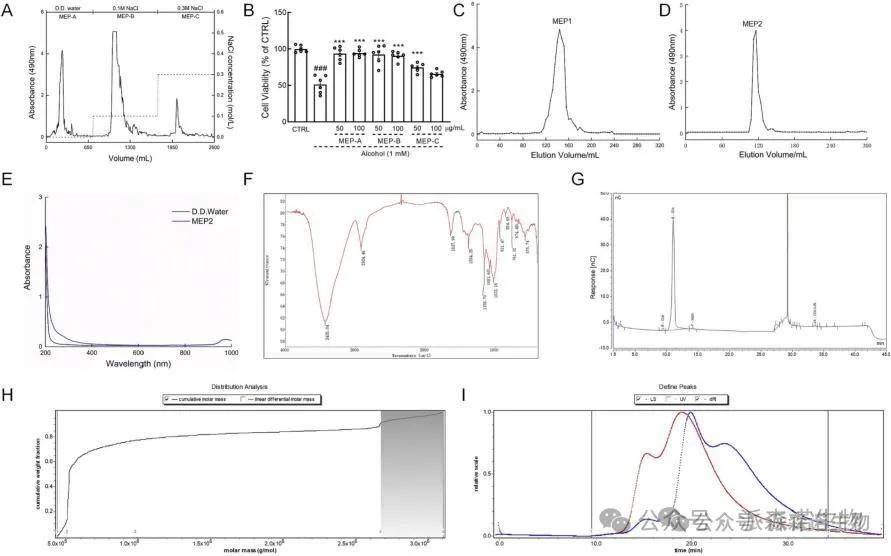
图1. MEP2的纯化和初级结构表征
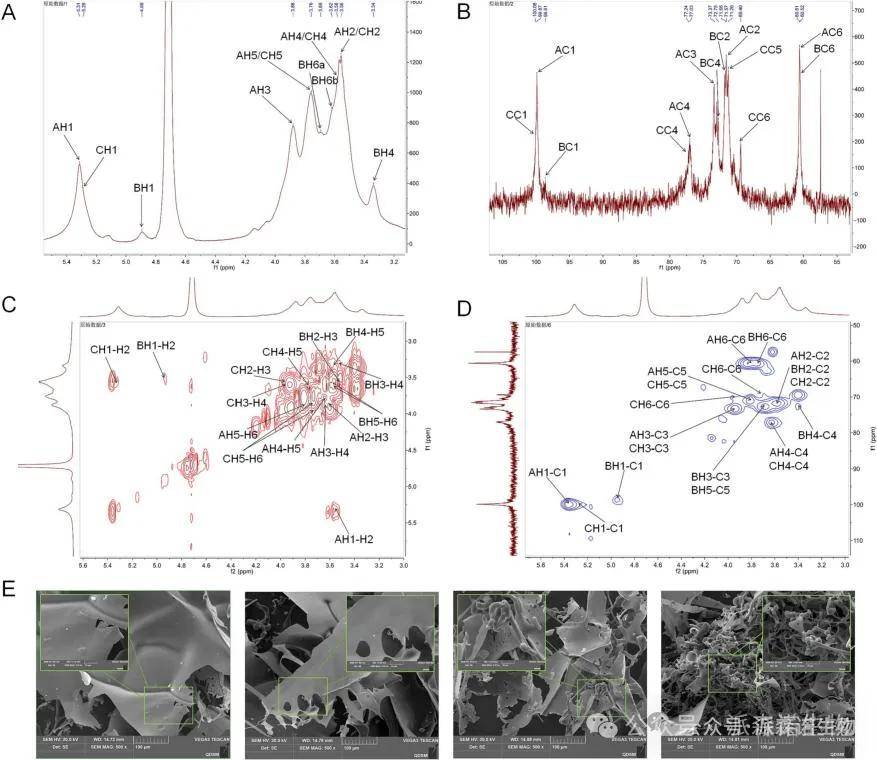
图2. 利用核磁共振和扫描电镜对MEP2进行结构表征
MEP2改善了慢性酒精性肝损伤小鼠的病理和生化改变
长期饮酒抑制小鼠体重增加,与CTRL小鼠相比,心脏、肝脏、肺和肾脏指标升高,脾脏指数和胸腺降低。长期酒精摄入导致小鼠肝细胞索紊乱、肝细胞肿胀、脂肪液泡数量增加、炎症细胞浸润和肝细胞核数量减少,这些都被MEP2和Sil强烈逆转(图3A)。试验组均未发现心、肺、脾、肾、脑、胸腺有明显变化;与载体处理的酒精给药小鼠相比,在慢性酒精诱导的小鼠中,MEP2强烈抑制天冬氨酸氨基转移酶,丙氨酸氨基转移酶,γ-谷氨酰转移酶和CYP2E1并增加肝脏ADH水平和醛脱氢酶(图3B-F)。
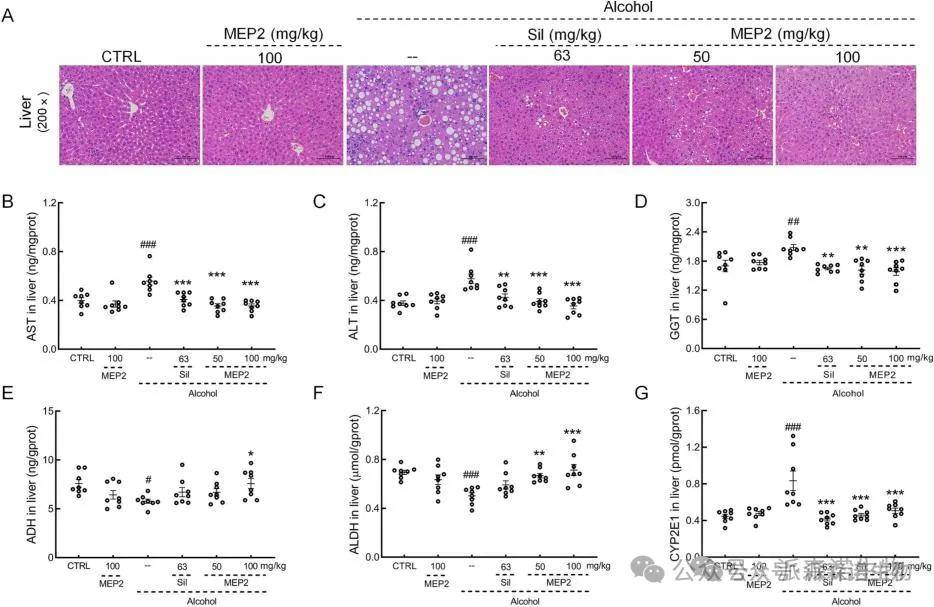
图3. MEP2在慢性酒精诱导小鼠中显示出肝脏保护作用
MEP2 改变了慢性酒精诱导小鼠的肠道微生物
在CTRL、载体处理酒精给药组和MEP2处理酒精给药组中,总共分别发现了6304个(25.99%)、6297个(25.96%)和7409个(30.55%)独有OTUs,在所有组中发现了1514个(6.24%)共有OTUs(图4A)。MEP2给药促进拟杆菌的增殖至52.63%,并将厚壁菌的相对丰度降低至40.76%(图4B)。此外,还分析了三组中丰度变化最大的前20个细菌属(图4C-G)。
使用MetaCyc数据库对酒精给药组和MEP2处理的酒精给药组之间与改变的肠道细菌相关的代谢途径进行分析。在8条一级功能通路中,分析了58条二级功能通路,脂肪酸和脂质生物合成、TCA循环、醇降解、脂肪酸和脂质降解和醛降解与肝脏酒精代谢有关(图4H)。
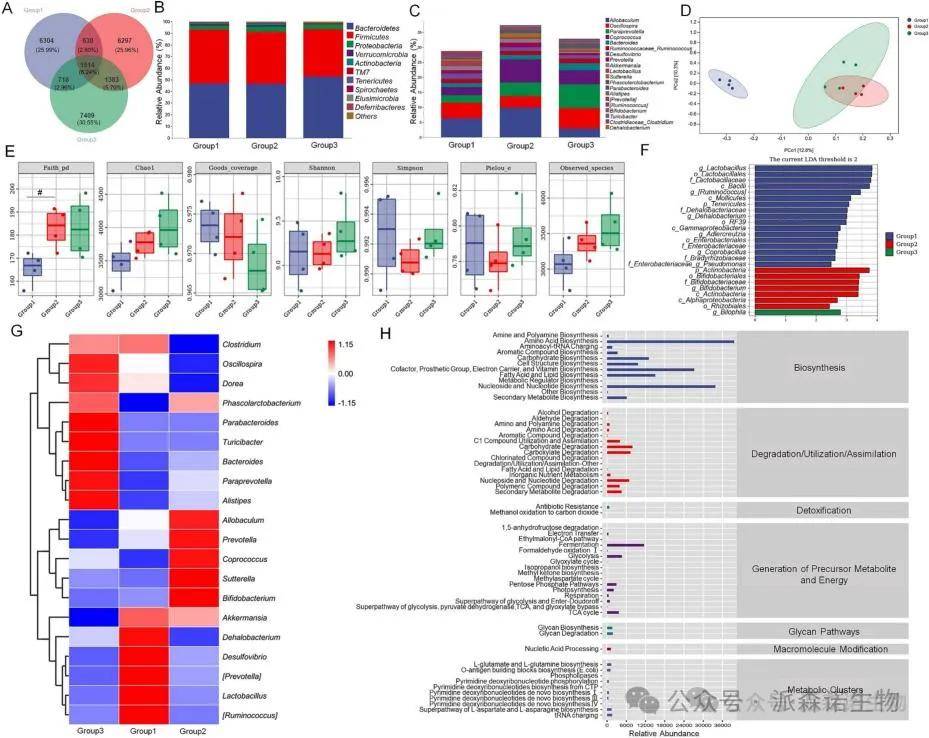
图4. MEP2调节慢性酒精诱导小鼠肠道菌群
MEP2改变了慢性酒精诱导的肝损伤小鼠血清中的代谢物水平
实验组共检出血清代谢产物1035种,包括脂质和类脂分子,有机酸及其衍生物。KEGG富集分析显示MEP2改变了22条代谢途径,分别与氨基酸代谢、碳水化合物代谢、消化系统、癌症代谢、信号转导等有关(图 5A)。与载体处理的酒精给药组相比,MEP2增加了一种代谢物的水平,降低了13种代谢物的水平(图5B)。血栓素B2(TXB2)水平与白三烯B4(LTB4)水平之间存在显著的正相关关系(图5C)。相关性分析表明TXB2水平与食盐杆菌丰度呈强正相关,与脱盐杆菌和瘤胃球菌丰度呈强负相关,LTB4水平与乳酸杆菌和脱卤杆菌丰度呈强负相关(图5D)。
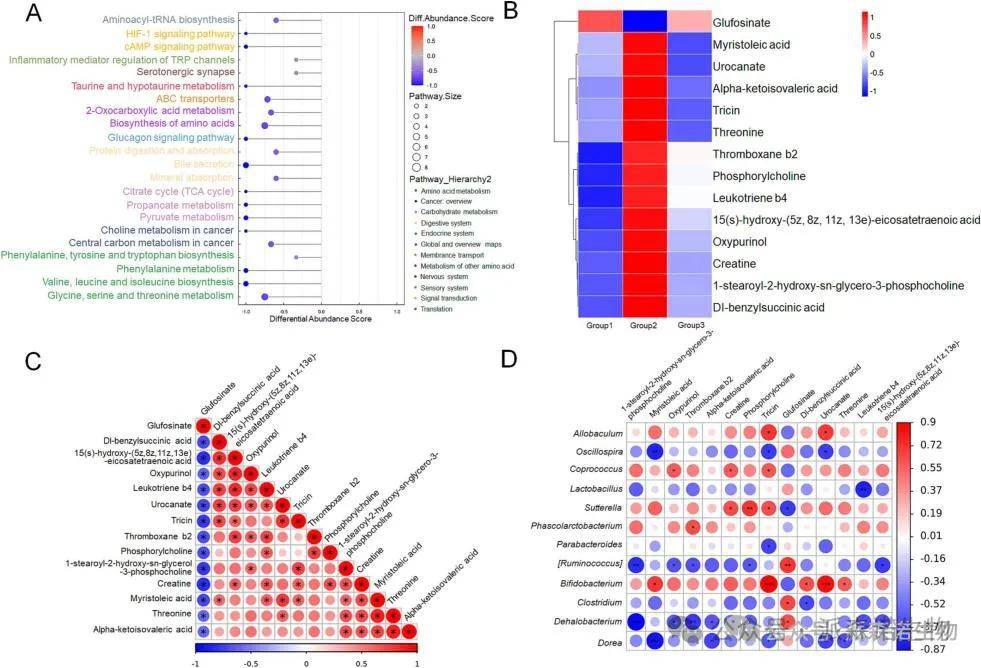
图5. MEP2调节慢性酒精诱导小鼠血清代谢物水平
蛋白质组学分析
GO富集分析显示与线粒体功能相关的细胞成分以及与氧化还原酶活性相关的分子功能(图6A)。载体处理的酒精给药组中观察到21种蛋白质(如Pafah1b2,Usp10和Cldn3)的下调,MEP2强烈逆转(图6B)。MEP2抑制PAF受体,并增强了Usp10,Cldn3、1b2、Mtx2、Mrps2、Cox7c、Taco1(图6C)。IHC结果进一步证实,由MEP2诱导的慢性酒精损伤小鼠的UsP10的肝脏水平升高(图6D)和PAFR的下降(图6E)。
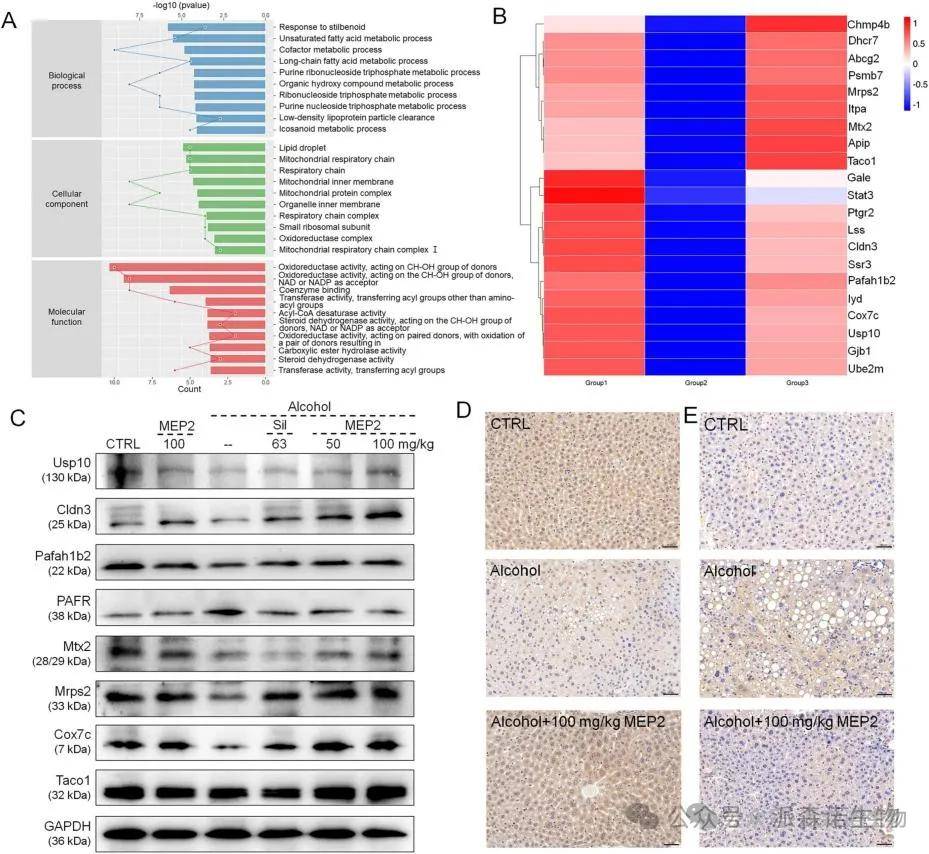
图6慢性酒精诱导小鼠肝脏的蛋白质组学分析
MEP2减轻了慢性酒精诱导的肝损伤小鼠中与NF-κB相关的炎症
酒精性肝病的特征是肝脏中巨噬细胞和中性粒细胞的募集和活化,释放有害介质,从而增加炎症。长期饮酒会提高肿瘤坏死因子(TNF)-α的表达水平,降低IL-6,NF-kB、IKK、IkBα、IL-10水平,但这些变化均被MEP2显著逆转(图7A)。与载体处理酒精给药组相比,MEP2导致在小鼠的肝脏中干扰素(IFN)-α,IFN-γ,TNF-α,IL-6和IL-17水平降低。IHC结果进一步证实了MEP2对慢性酒精诱导小鼠肝脏磷酸化NF-kB水平的抑制作用(图7)。
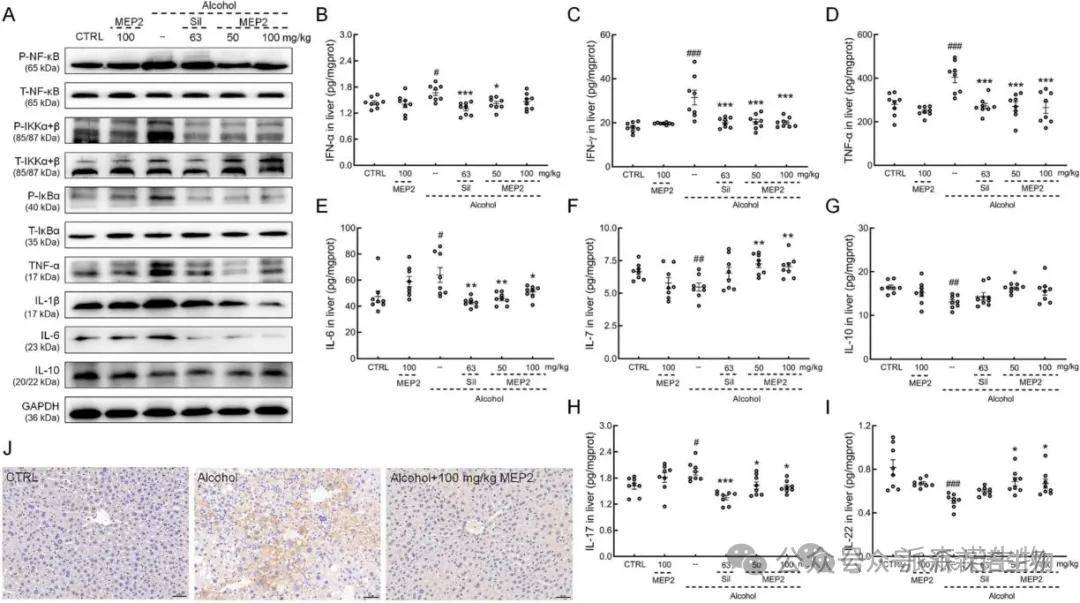
图7 MEP2抑制了小鼠酒精诱导的炎症反应
MEP2 通过 Nrf2 改善氧化应激
与载体处理的酒精给药小鼠相比,在慢性酒精诱导MEP2给药小鼠的肝脏中谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)水平均显著提高(图8C-E),ROS和MDA水平显著降低(图8A-B)。WB结果显示,Nrf2及其下游蛋白的表达水平,包括CAT、NQO、HO-1、SOD-1在慢性酒精诱导小鼠的肝脏中的表达水平降低,MEP2治疗显著改善(图8F)。IHC结果进一步证实了Nrf2表达的增强(图8G)。MEP2有效地改善了氧化磷酸化,并抑制了长期饮酒引起的氧化应激损伤。
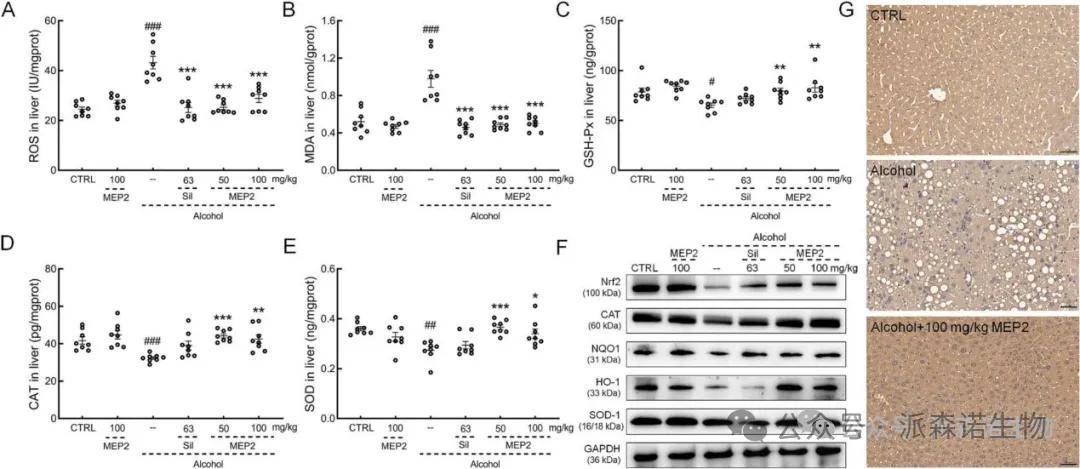
图8 MEP2改善慢性酒精诱导小鼠肝脏中的氧化应激
结 论
从羊肚菌中提取并纯化了水溶性羊肚菌多糖2(MEP2),分子量为959kDa的MEP2具有a→4)-α-D-Glcp-(1→葡聚糖主链,并且该分支在H-6位置被α-D-Glcp-(1→4)-α-D-Glcp-(1→残基和α-D-Glcp-(1→残基。在慢性酒精诱导的肝损伤小鼠中,MEP2通过Usp10/Nrf2/NF-kB信号通路调节血清代谢产物和肠道微生物群的水平,以抑制炎症反应和氧化应激,减轻肝损伤。这些数据支持了MEP2作为酒精性肝损伤潜在治疗策略的应用。
参考文献
Shanshan Teng, Yongfeng Zhang, Xinghui Jin, Yanfeng Zhu , Lanzhou Li, Xiaowei Huang ,Di Wang , Zhe Lin. 2023. Structure and hepatoprotective activity of Usp10/NF-κB/Nrf2 pathway-related Morchella esculenta polysaccharide. Carbohydrate Polymers, 303, 120453. DOI:10.1016/j.carbpol.2022.120453.




















