
研究物种:小鼠
发表期刊:Frontiers in Endocrinology
发表时间:2022年
影响因子:4.6
文章亮点
研究对象新颖且具有应用潜力:
研究的焦点是绞股蓝多糖(GypPs),这是一种从传统中药绞股蓝(俗称“南方人参”)中提取的天然活性成分。探索天然产物对现代高发疾病(如NASH)的治疗作用,符合“药食同源”的理念,具有很高的开发成功能性食品或植物新药的潜力。
阐明了清晰且创新的作用机制通路:
文章没有停留在“有效”的表象,而是深入挖掘了其“为何有效”的深层机制。它揭示了一条从肠道到肝脏的完整作用轴:“肠道菌群调控 → TLR2信号通路抑制 → NLRP3炎性小体失活 → 肝脏炎症与纤维化减轻”。
这条通路逻辑清晰,将肠-肝轴理论与先天免疫和炎症反应的经典通路巧妙地联系了起来,为理解NASH的发病和治疗提供了新的视角。
确证了肠道菌群的核心桥梁作用:
研究通过抗生素清除菌群的实验发现,一旦小鼠的肠道菌群被破坏,GypPs的保护作用就几乎完全消失。这强有力地证明了GypPs的疗效高度依赖于肠道菌群的存在,其首要作用是作为“预 biotic”,调节菌群平衡。
它不仅仅是相关性研究,而是通过实验验证了因果关系,这是该研究的一大亮点。
精准定位了关键受体TLR2,而非常见的TLR4:
在Toll样受体(TLR)家族中,以往NASH研究更关注由脂多糖(LPS)激活的TLR4。而本研究通过基因敲除(TLR2⁻/⁻)小鼠模型,发现GypPs主要通过抑制TLR2(主要识别菌群产生的脂蛋白等)来发挥作用。
这一发现指出了TLR2在NASH中可能被忽视的重要作用,为药物靶点开发提供了新的方向。
多维度综合评价疗效,证据链完整:
研究从多个层面证明了GypPs的效果:
表型:减轻肝脏重量、改善肝功能指标(ALT/AST)、降低血脂。
组织学:改善肝脏脂肪变性、气球样变和炎症浸润(通过HE、Oil Red O染色等证实)。
分子机制:下调TLR2、NLRP3、Caspase-1、IL-1β等关键炎症因子的表达。
这种从宏观到微观,从表象到机制的多维度验证,使得研究结论非常坚实和可信。
为治疗NASH提供了“多靶点、低毒性”的新策略:
当前NASH缺乏特效药。GypPs作为一种天然多糖,通过调节肠道菌群这一整体生态系统,间接但有效地抑制了下游的过度炎症反应,这是一种“多靶点”的治疗策略。同时,相比于化学药物,天然多糖通常安全性更高,副作用更小,这为其临床转化奠定了良好的基础。
研究背景
最近的研究揭示了肠道菌群在包括非酒精性脂肪性肝炎(NASH)在内的肝脏疾病进展中的关键作用。绞股蓝(GP)等天然草药已被广泛应用于NASH的预防,但其生物活性成分及潜在机制尚不清楚。本研究的目的是研究GP多糖(GPP)是否对NASH具有保护作用,并探讨其潜在机制。
技术路线
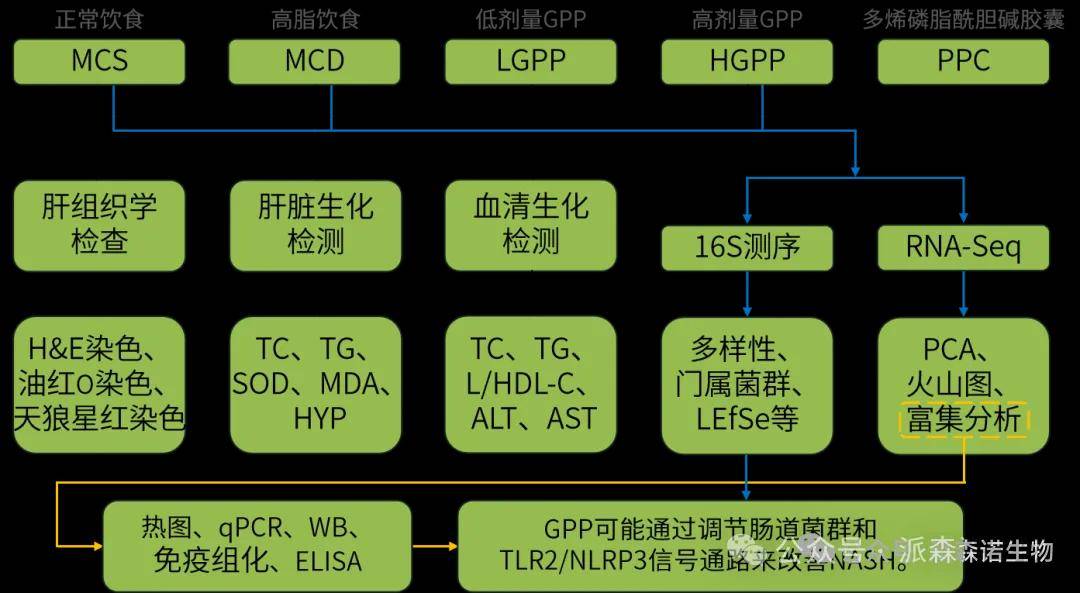
研究结果
GPP对MCD诱导的NASH小鼠的影响
病理结果表明NASH的表型包括气球变性,脂肪变性,小叶炎症和MCD饮食诱导的纤维化。 GPP和PPC改善了肝脂肪变性,而HGPP基于测量正区域染色和NAS评分,HGPP表现出与PPC组相似的疗效。关于肝脂质水平,MCD组显示出肝TC和TG的水平显着增加,而HGPP组显示出明显降低肝TC的水平。 MCD还诱导肝脏中的氧化损伤,如SOD和MDA指数所反映。
GPP和PPC对肝MDA具有明显的改善作用,而HGPP和PPC对肝SOD产生了更好的影响。同时,Hypy Assay表明LGPP和HGPP都可以显着降低肝胶原蛋白含量,而PPC没有统计差异。此外,MCD饮食显着降低了血清TC,TG,LDL-C和HDL-C的水平,它们可以分别通过不同剂量的GPP和PPC部分回收。与PPC组的显着下调相反,ALT的水平在LGPP组中显示出向下趋势(P = 0.13),但HGPP组的向上趋势(P = 0.07)。此外,差异在五组之间的AST水平上没有统计学意义。这些结果表明,GPP可以改善MCD诱导的NASH表型,包括肝脂肪变性,氧化应激和部分纤维化。
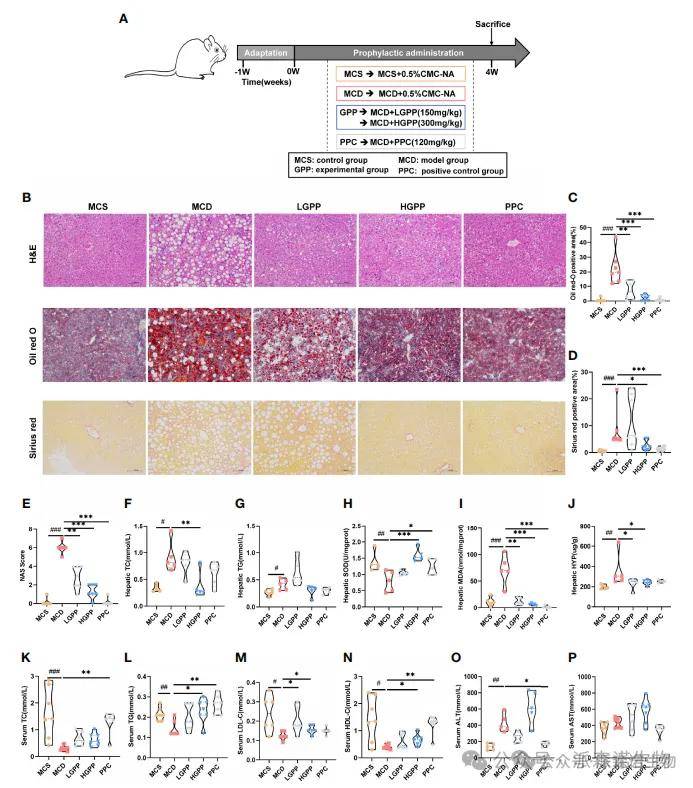
GPP减轻了蛋氨酸-胆碱缺陷型(MCD)诱导的非酒精性脂肪性肝炎
通过HGPP处理修饰的肠菌群的组成
通过测序16S rRNA基因的v3–v4区域来分析肠道微生物群的组成。Chao1和Shannon指数反映的α多样性在MCD和HGPP组之间没有统计学差异。基于Bray-Curtis距离的主坐标分析(PCoA)显示三组之间存在明显的分离,HGPP组更接近MCS组。三组的相似性分析(ANOSIM)差异显著(P=0.002,ANOSIM R=0.5341)。此外,我们观察到门和前20个属水平的相对丰度发生了显著变化。MCD和HGPP组之间的LEfSe分析表明,在属水平上,Akkermansia和A2在HGPP组中富集,而未培养的梭菌在MCD组中富集。随机森林对MCD和HGPP组的区分有贡献的前15个属进行了排名,前5个属包括乳杆菌属、A2属、梭菌属-UCG-014_norank属、GCA-900066575属和Akkermansia属。。进一步比较了MCD组和HGPP组之间乳杆菌、Akkermansia、A2和未培养梭菌的相对丰度。HGPP组中乳杆菌的相对丰度有较高的趋势(P=0.09)。此外,与MCD相比,HGPP发现Akkermansia和A2的相对丰度显著增加,未培养梭菌的相对丰度明显降低。
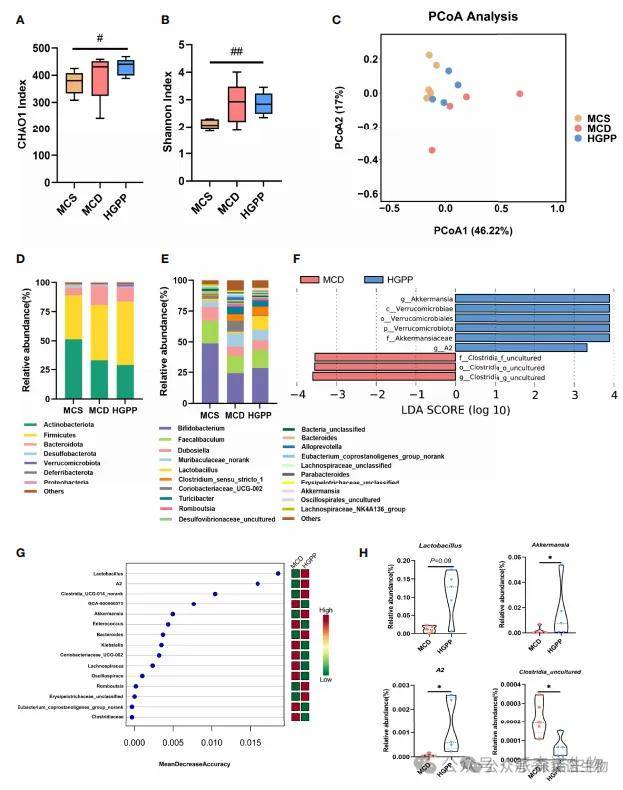
HGPP改变了肠道菌群的组成
HGPP调节MCD喂养小鼠肝脏基因表达谱
为了进一步了解HGPP抗NASH作用的潜在机制,研究者对不同组小鼠的肝脏转录谱进行了表征。首先,PCA显示MCS、MCD和HGPP组之间存在明显的分离。HGPP处理导致MCD的PC2背景下的基因表达明显分离。火山图显示MCD组和HGPP组之间有755个基因(上调132个基因,下调623个基因)。维恩图描述了三组比较中重叠和不同的DEGs的数量。GO富集分析显示,MCD组和HGPP组在生物过程中显著富集的前20个GO term,如免疫系统调节、白细胞激活、细胞激活、炎症反应、T细胞激活、细胞因子产生等。一些KEGG信号通路,包括趋化因子信号通路、破骨细胞分化、血小板激活、白细胞跨内皮细胞迁移、TLR信号通路和NLR信号通路,在MCD组和HGPP组之间广泛富集。GSEA结果显示,MCS组与MCD组间|NES|>1且P adjust<0.05的通路共有40条,MCD组与HGPP组间|NES|>1且P adjust<0.05的通路共有42条。筛选MCS与MCD、MCD与HGPP之间重叠的KEGG通路,包括自然杀伤细胞介导的细胞毒性、造血细胞系、TLR信号通路、NLR信号通路、B细胞受体信号通路、Fc epsilon RI信号通路、白细胞跨内皮迁移等。先前的一项研究表明,炎症通路的转录上调通常由模式识别受体(PPRs)启动,如TLRs和NLRs。MCD持续导致TLR和NLR信号通路的激活,表明这两条通路在小鼠MCD模型的NASH发展中的重要性。在MCD和HGPP组之间也发现了这一结果。如上分析,当HGPP与MCD相比,肝脏基因表达谱反映了基因表达和信号通路的改变。可能的机制是与调节TLR和NLR信号通路有关。
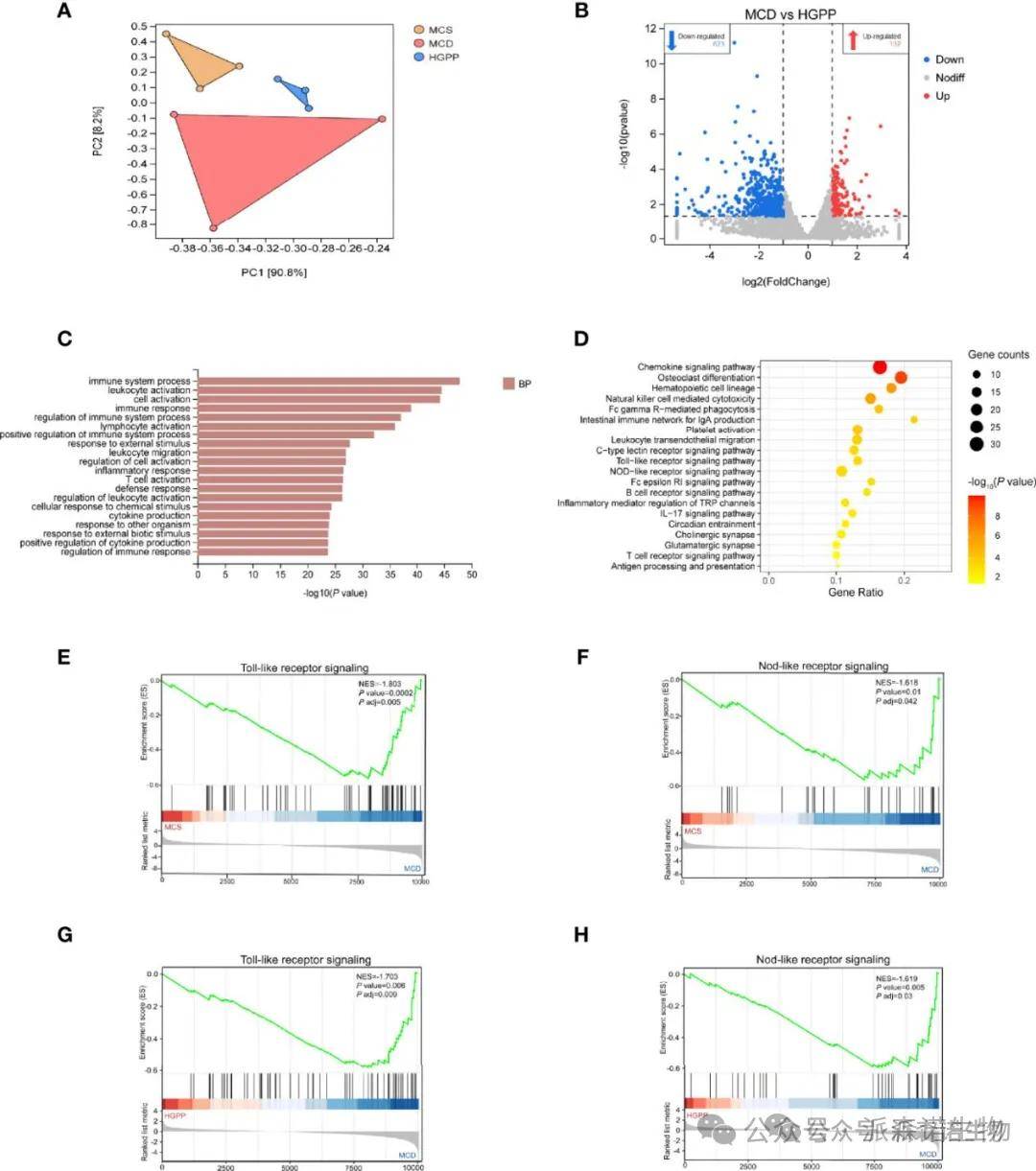
HGPP引起小鼠肝脏中基因表达的改变
HGPP可调节MCD小鼠肝脏TLR2/NLRP3信号通路
为了研究HGPP治疗NASH的抗炎作用是否影响的TLR和NLR,研究者检查了潜在的分子机制。基因表达热图(FPKM)显示,与MCS组相比,TLR基因、炎性体激活基因、促炎基因和免疫相关基因在MCD组中表达上调。相反,包括Tlr1、Tlr2、Tlr4、Nlrp1b、Nlrp3、Naip1、Naip5、Naip6、Aim2、Caspase1、Nod2、Card9、Il-1b、Il-18rap、Tnf-a、Cd40和Cd80在内的基因在HGPP处理下表达下调。进一步的qPCR显示,与MCD组相比,HGPP中富含TLR和NLR信号通路的TLR2、NLRP3、ASC、IL-1b和TNF-a基因的表达显著下调。TLR2、NLRP3、ASC、Caspase-1和IL-1b的免疫组织化学染色和定量结果表明,在HGPP处理的小鼠中IOD数量减少。通过蛋白质印迹验证HGPP组肝脏中Pro-caspase-1和Caspase-1的表达。进一步研究了LBP的血清水平,与MCD组相比,HGPP显著降低了LBP。在HGPP处理中,IL-1b的血清水平显著降低。IHC定量显示与MCD相比,HGPP中TLR2、NLRP2、ASC、Caspase-1和IL-1b的IOD降低。这些结果表明,HGPP的抗炎作用涉及TLR2/NLRP3信号通路。
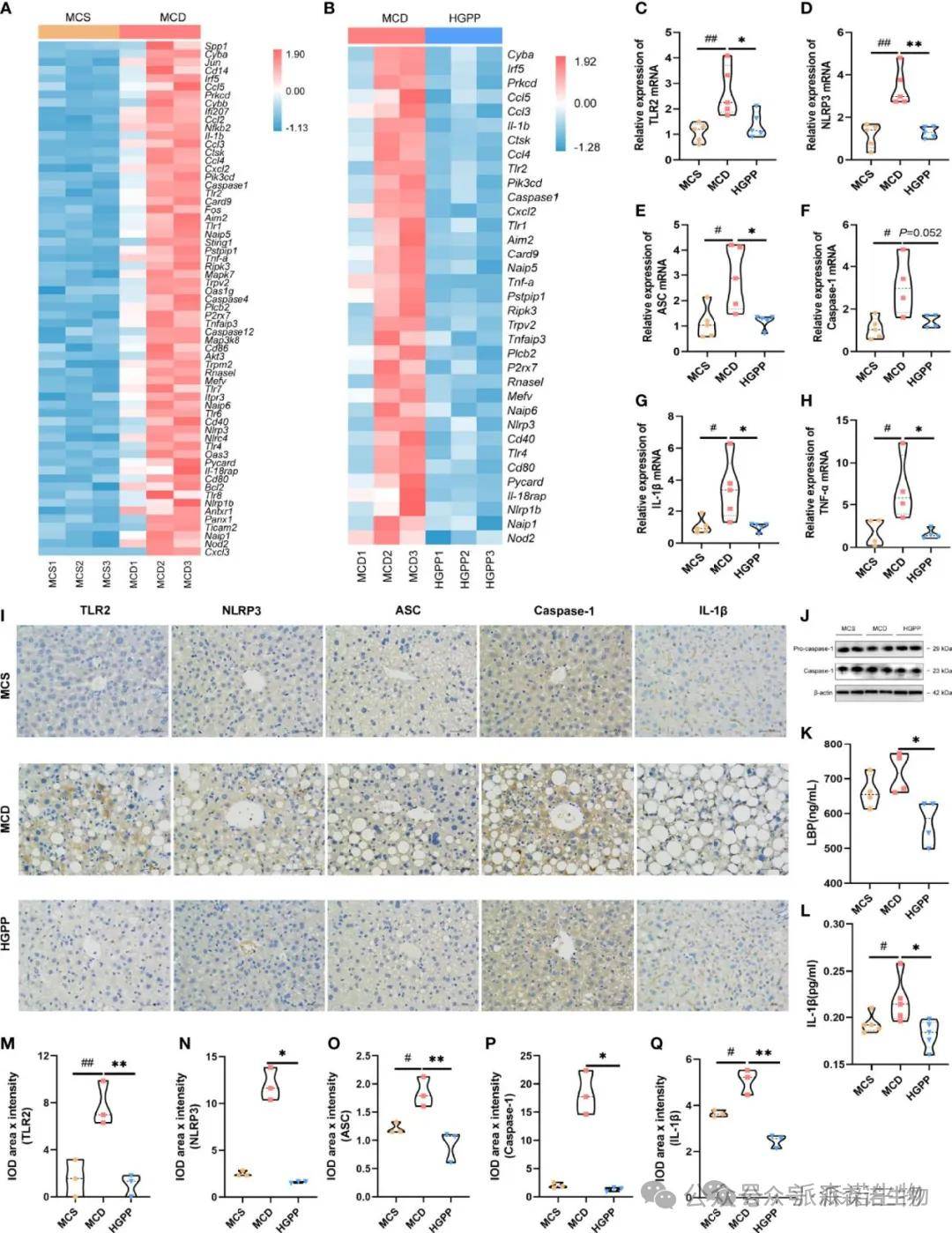
在分子水平上探讨HGPP的潜在作用机制
研究结论
研究结果表明,通过GPP的干预,肝脏脂肪变性、肝细胞肿胀、肝纤维化和氧化应激的症状可以部分恢复,并具有剂量依赖效应。此外,肠道微生物组测序结果显示,HGPP改变了肠道菌群的组成,主要表现为Akkermansia、Lactobacillus和A2等属的富集。肝脏转录组分析表明,HGPP的抗炎作用可能与TLR和NLR信号通路有关。HGPP可抑制TLR2的表达,下调NLRP3炎性小体以及促炎细胞因子肿瘤坏死因子(TNF)-a和白细胞介素(IL)-1b的表达。综上所述,GPP可能通过调节肠道菌群和TLR2/NLRP3信号通路来改善NASH,表明GPP可以作为一种益生元药物用于预防NASH。




















