
2025-09-04

研究物种:小鼠
发表期刊:Phytomedicine
发表时间:2025年
影响因子:8.3
文章亮点
系统性的机制预测:采用网络药理学“多成分-多靶点-多通路”的研究思路
多成分筛选: 不是简单地研究单一成分,而是从川科止注射液的复杂中药复方中,筛选出多个潜在的活性化合物成分(如黄芩苷、熊果酸等)。
多靶点预测: 通过数据库分析和网络构建,预测出这些活性成分可能作用的多个关键靶点(如IL-6、TNF-α、VEGFA、MAPK1、AKT1等),清晰地展示了中药“多靶点”协同作用的特点。
多通路整合: 研究并未将机制局限于某一条通路,而是通过富集分析发现,这些靶点显著富集在多条与炎症和免疫密切相关的通路上,如TNF信号通路、PI3K-Akt信号通路、MAPK信号通路等,揭示了其作用的全局性和系统性。
严谨的实验验证:从体内到体外的多层次证据链
体内动物实验: 在哮喘小鼠模型中,通过川科止注射液进行治疗,证实了其确实能够有效缓解气道炎症(如降低炎症细胞浸润)、减轻气道高反应性(AHR)等关键哮喘症状。这验证了药物的整体疗效。
体外细胞实验: 在细胞层面(如人支气管上皮细胞16HBE),使用LPS诱导炎症模型,进一步验证了川科止注射液的抗炎作用。研究表明它能显著抑制关键炎症因子(如IL-6, TNF-α, IL-1β)的释放。
分子机制验证: 实验的最终层深入到蛋白和基因水平。通过Western Blot、qPCR等技术,证实了川科止注射液能够抑制网络药理学所预测的PI3K/AKT和MAPK信号通路的激活,即下调p-PI3K、p-AKT、p-p38等关键磷酸化蛋白的表达。这使得最初的预测得到了坚实的实验数据支撑,形成了完整的闭环。
研究模式的示范性:为中药现代化研究提供了经典范例
本研究完美展示了如何利用计算生物学(网络药理学)作为“导航”,快速、高效地提出复杂中药体系的作用机制假说。
然后通过传统的生物实验手段(体内外实验)进行“验证”,将虚拟预测转化为客观证据。
这种 “预测 + 验证” 的研究模式,极大地提高了中药机制研究的效率和针对性,避免了盲目筛选,是中医药走向现代化、国际化和被现代医学认可的重要途径。
研究背景
哮喘是一种常见的慢性气道炎症性疾病,现有治疗方法仍存在局限性。川科止注射液(CKZI)是一种中药复方制剂,临床上显示出良好的抗哮喘疗效,但其作用机制尚不明确,缺乏系统的科学阐释。因此,本研究旨在运用网络药理学和实验验证相结合的方法,深入揭示CKZI治疗哮喘的抗炎作用机制。
研究思路
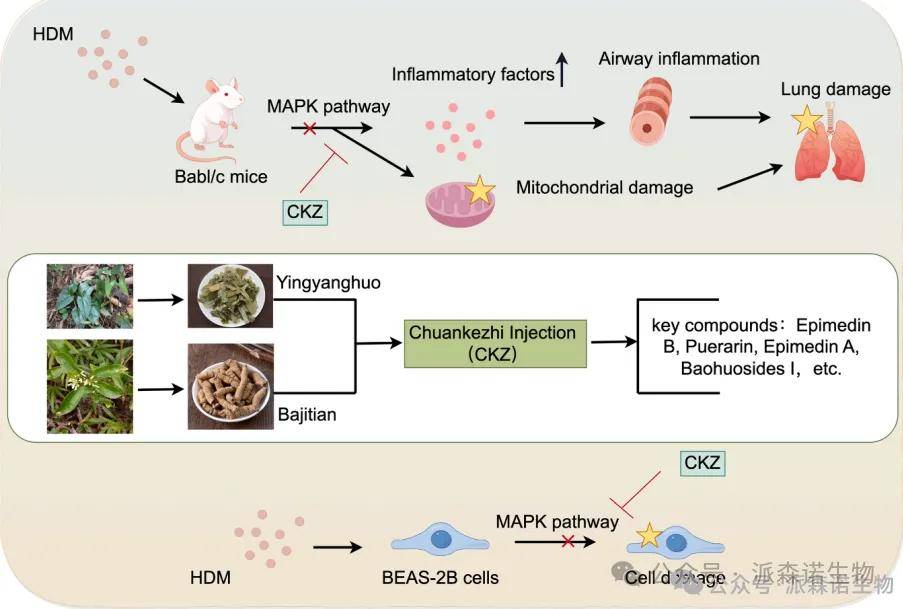
研究方法
空间代谢组、网络药理学
研究结果
1.CKZ的化学成分
CKZ由两种中国草药组成:yinyanghuo和bajiitian(表1)。通过LC/MS分析鉴定了134种CKZ化合物。类黄酮化合物通常被认为是其抗炎和抗氧化作用的关键成分。根据现有结果,我们从选择中确定了12种关键化合物。
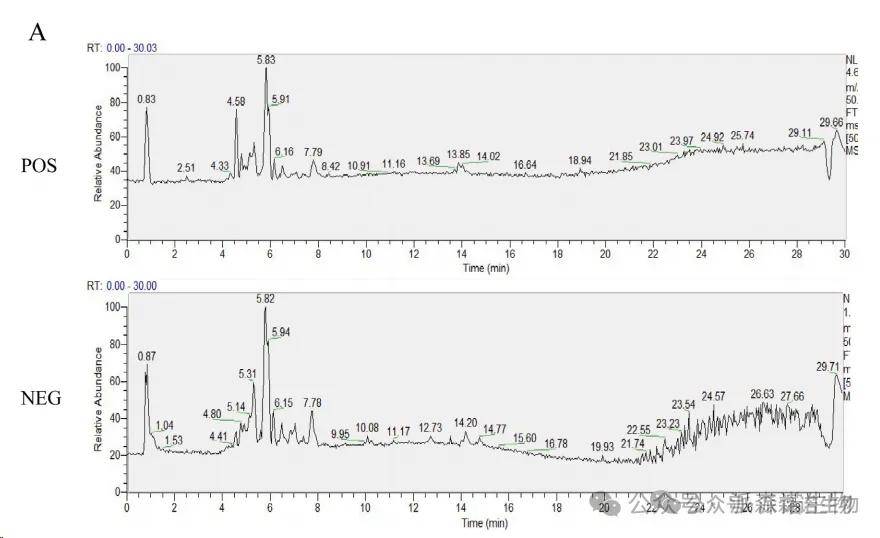
图1Chuankezhi注射液的总离子色谱图(TIC)
2. MALDI-TOF的空间代谢组分析
如图2所示,MALDI-TOF的结果呈现了CKZ干预后小鼠肺组织中关键类黄酮化合物的原位空间分布。在这项研究中,MALDI-TOF在肺组织中成功检测到了各种类黄酮,包括Icariin,Epimedin A,B和C等,这可能在氧化应激和炎症调节中起重要作用。光谱中的主要峰分布在中等质量范围内,这表明样品中的类黄酮化合物具有相对浓缩的分布。
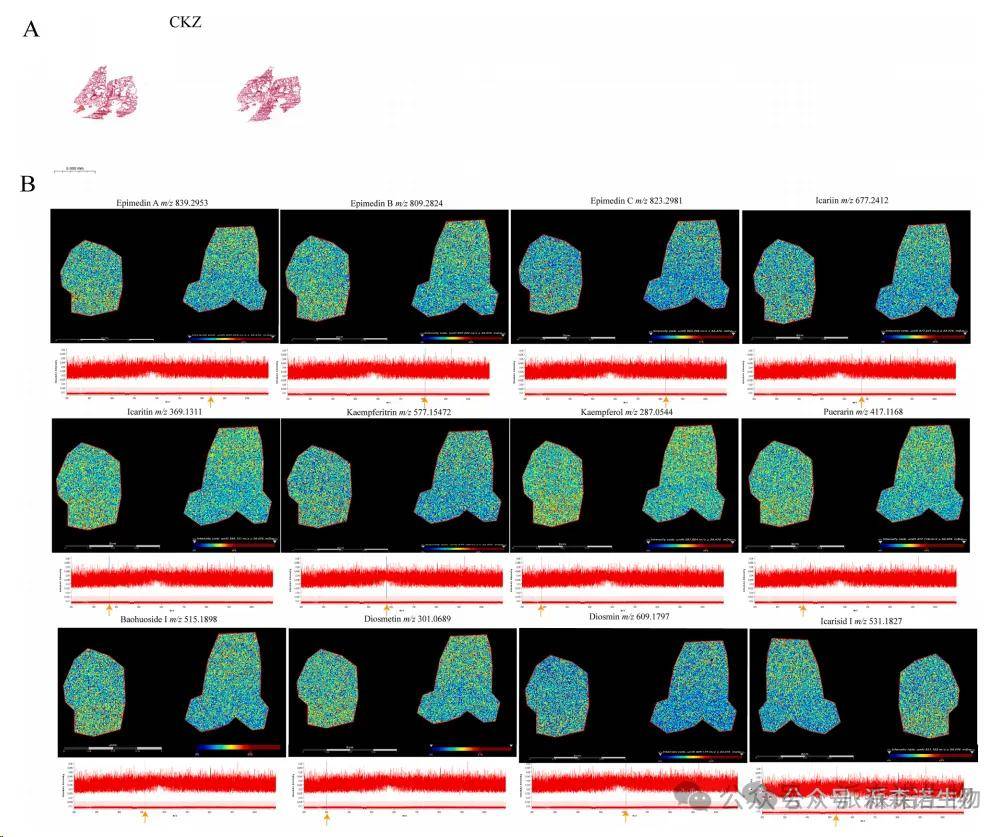
图2.MALDI-TOF的空间代谢组分析
3.网络药理学分析
通过swiss目标预测筛选了1084个CKZ靶标,总共确定了638个重叠目标(图3A)。如图3B的网络分析所示,将主要的药物靶标和疾病进口到Cytoscape 3.9.0进行可视化,从而导致“组件 - 靶向疾病”网络图的构建,这表明它包含766个节点和4187个边缘。值得注意的是,单个活性成分可能对应于多个靶标,并且不同的活性成分也可以共享相同的靶标,表明该药物通过多型,多毒剂机制对疾病产生影响。如图3C所示,将638个相交目标导入到字符串数据库中进行分析,从而产生PPI网络图。该网络包含638个节点和14,614个边缘。按程度排名的前五个节点是TNF,AKT1,IL6,GAPDH和SRC,表明这些节点在PPI网络中占据中心位置,并且具有密集的连接。表4显示了前10个靶标。这些选定的基因靶标可能是药物治疗哮喘的核心靶标,药物疗效的机理可能与这些基因的表达有关(图3D-E)。使用David数据库,对靶基因的富集分析显示了GO富集术语,其中包括与生物学过程(BP)相关的1425个,165个与细胞成分(CC)相关的术语(CC)和352个分子功能(MF),P <0.05。 BP项主要涉及细胞凋亡的阴性调节,细胞增殖的阳性调节,蛋白质磷酸化的阳性调节以及内皮细胞增殖的阳性调节。 MF项主要包括酶结合,受体结合和蛋白酶结合,而CC项主要涉及线粒体,蛋白质复合物和细胞内膜结合的细胞器。表5显示了前十BP,CC和MF项,图3F。结果暗示,治疗哮喘的CKZ可能与以下BP高度相关:肽基 - 酪氨酸磷酸化,磷脂酶C激活G蛋白偶联受体信号途径,胞质钙离子浓度的阳性调节,蛋白质自动磷酸化和蛋白质磷酸化。 CC术语侧重于凋亡过程,受体复合物,膜筏,树突和质膜外侧的负调节。具有最高富集的MF术语主要涵盖跨越蛋白酪氨酸激酶活性的非膜性的。
p值<0.05的20个术语来自KEGG途径分析(表6)。图3G通过条形图和气泡图显示了富集值的前20个途径。结果表明,CKZ治疗哮喘的机制主要涉及癌症中的途径,神经活性配体 - 受体相互作用,MAPK信号通路,PI3K-AKT信号通路和钙信号通路。根据富集评分排名,MAPK途径可能是最重要的调节途径之一,而线粒体可能是最关键的细胞器。基于上面的信息,我们将通过随后的实验进一步验证这些信息。
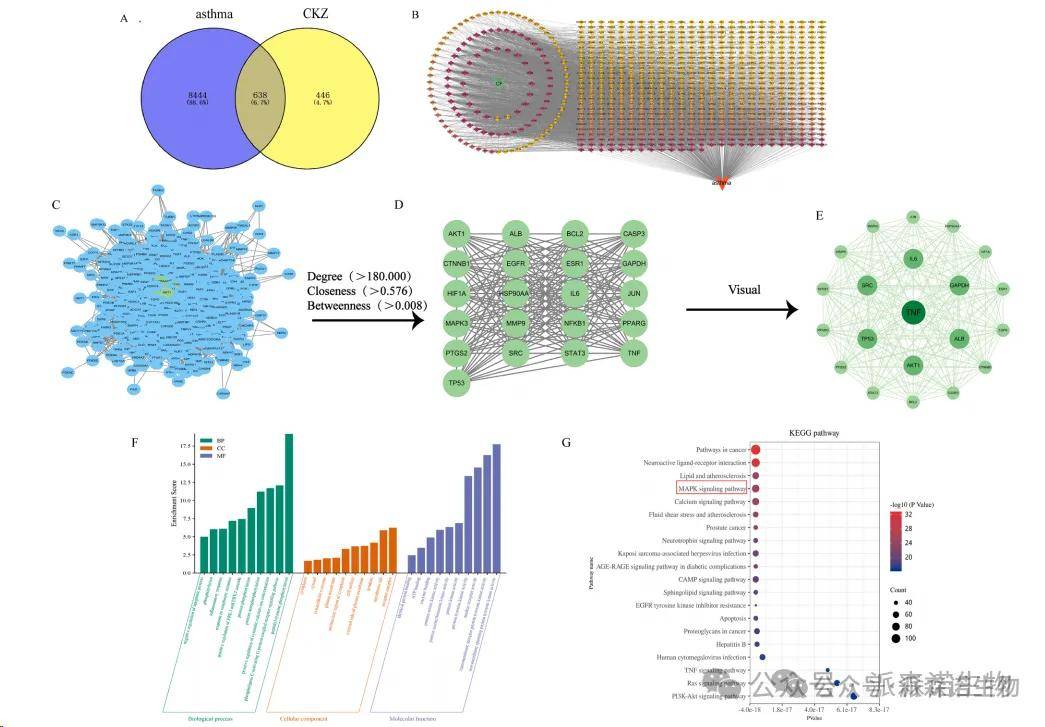
图3 CKZ治疗哮喘的网络药理学预测。
4.分子对接分析
以前,我们在表3中筛选了12个键的类黄酮化合物。Epimedin B,瓜素,epimedin A,Baohuoside I的峰等级相对较高,这表明这四种可能是发挥观察到的效果的主要活性成分。结合MALDI-TOF,EPIMEDIN B,PUERARARIN,EPIMEDIN A和BAOHUOSIDE I的分析,富含在肺组织中。 TNF被确定为具有最高程度的目标,表明它可能是CKZ发挥其功能的最关键因素。基于此,进行了分子对接分析。这四种化合物的结合能范围从-5到-10,表明相对较好的结合性能。其中,epimedin a和b与TNF的结合能分别小于-7(-7.5和-7.4),表明具有高结合强度和潜在的更高的生物学活性。 (图4A和表7)。表面等离子体共振(SPR)分析表明,固定在CM5传感器芯片上的TNF-α可以与具有不同亲和力的所有四种测试化合物结合。这些结果表明,在四种测试化合物中,Epimedin A具有与TNF-α的结合亲和力最高。
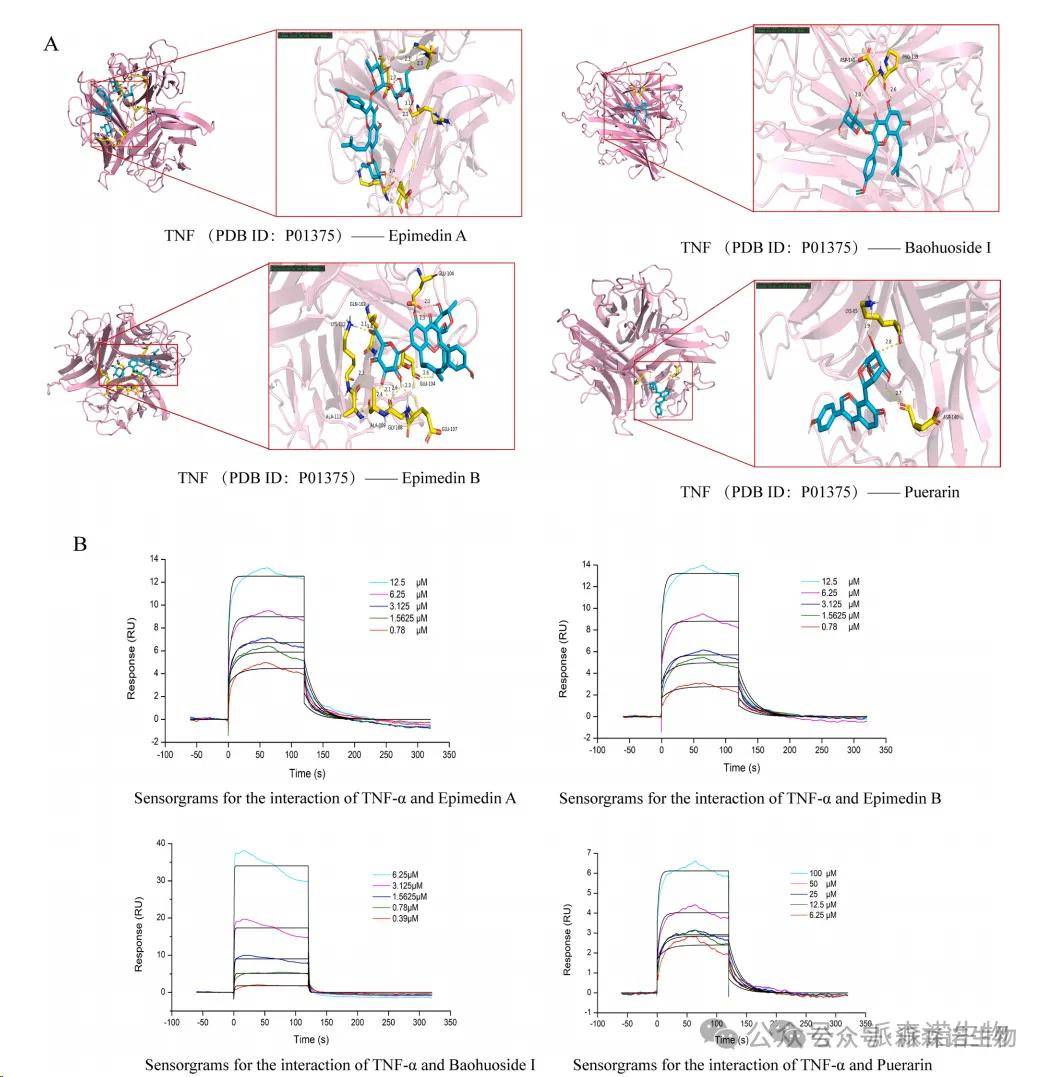
图4分子对接结果
5. CKZ改善了HDM诱导的气道炎症和HDM诱导的哮喘小鼠模型的重塑
我们使用HDM来建立哮喘小鼠模型。(图5A)支气管壁增厚,炎症细胞浸润和杯状细胞的增生是用于评估哮喘病理严重程度并代表哮喘的主要特征的关键标记。在肺组织中,H&E染色显示周围和周围的周围和周围的周围炎症细胞浸润增加,气道上皮细胞脱离以及HDM诱导的哮喘的小鼠的粘液产生过多。模型组中可比的炎症得分明显高于对照组中的炎症分数(p <0.001)。 CKZ在低,中和高剂量以及DEX(1 mg/kg)组中表现出显着的抗炎作用。 CKZ治疗显着降低了炎症细胞浸润,上皮损伤和粘液过量产生,从而导致炎症评分大大降低(P <0.001),表明与模型组相比恢复(图5B和C)。与对照组相比,在哮喘模型的气道上皮中,胶原蛋白纤维含量显着增加,如Masson的三色染色所示(图5B和C)。此外,通过CKZ和DEX的给药可以明显改善胶原蛋白纤维含量。 DEX管理似乎比CKZ更有效。PAS染色显示模型组气道上皮中的杯状细胞(GC)增生,而对照小鼠中未观察到这种变化。与对照组相比,模型组的标准化GC面积(图6B和C)显着增加(P <0.001)。然而,在CKZ和DEX组中,这种增加显着降低(p <0.01)。这些发现表明,Ckzand Dex有效抑制了哮喘小鼠肺中的GC增生。这些结果表明,HDM诱导的哮喘导致肺组织的组织病理学变化。CKZ对减轻哮喘的组织病理学特征有明显的影响。
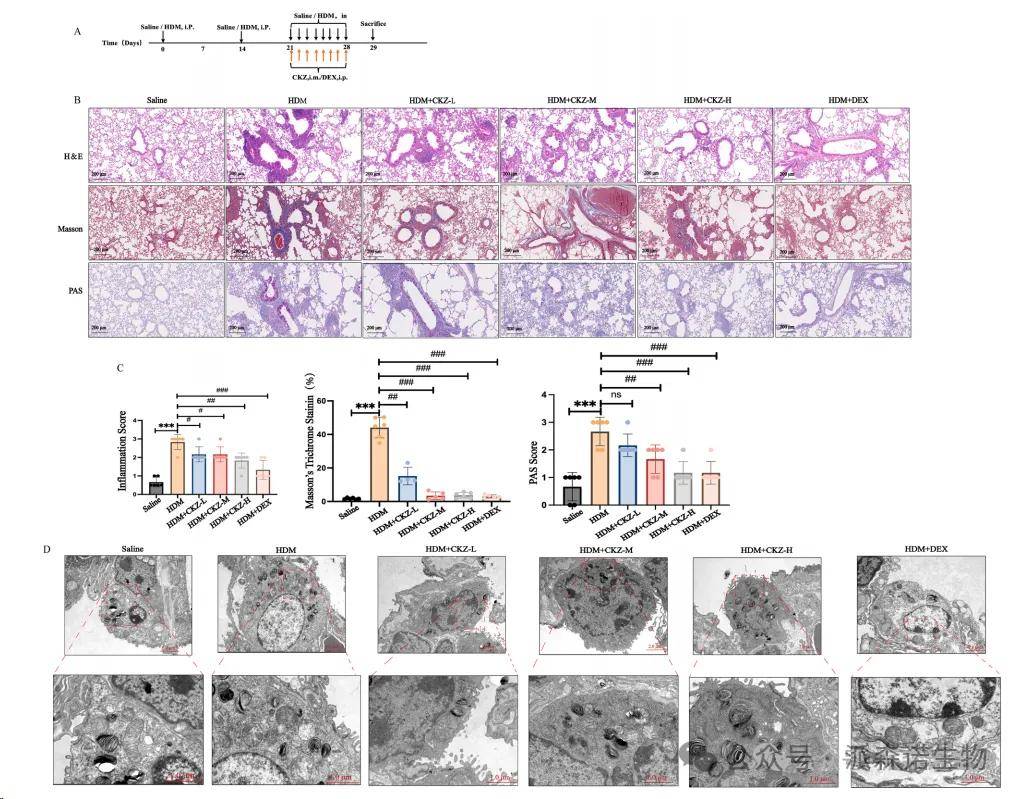
图5CKZ可以减轻哮喘小鼠气道炎症和线粒体损伤的损害。
6.CKZ处理调节哮喘的血清和BAL中的炎症细胞和介质
如图6A和B所示,HDM诱导的小鼠BALF的总细胞和嗜酸性粒细胞的明显升高相对于对照组。相反,CKZ和DEX给药减少了总细胞和嗜酸性粒细胞计数。此外,在血清分析中,我们观察到与盐水组相比,我们观察到2型炎症因子(IL-4,IL-5,IL-13和TNF-α)的明显增加,这是肺部炎症的关键指标。 CKZ治疗表现出降低炎症因子水平的趋势,表明其潜在的抗炎特性(图6C)。此外,HDM挑战还导致BALF内IL-4,IL-5,IL-13和TNF-α的显着增加。显然,与HDM组相比,CKZ和DEX处理都大大降低了BALF炎症性细胞因子的表达(图6D)。根据先前的结果,MAPK信号传导是CKZ介导的最重要的途径之一。在由HDM诱导的哮喘小鼠的肺组织中,相对于对照组中的JNK,ERK和P38的磷酸化水平增加,CKZ和DEX的处理有效地降低了磷酸化的JNK,ERK和P38的水平,导致MAPK Signalk Signalk Signalking Pathway的抑制(图6E)。
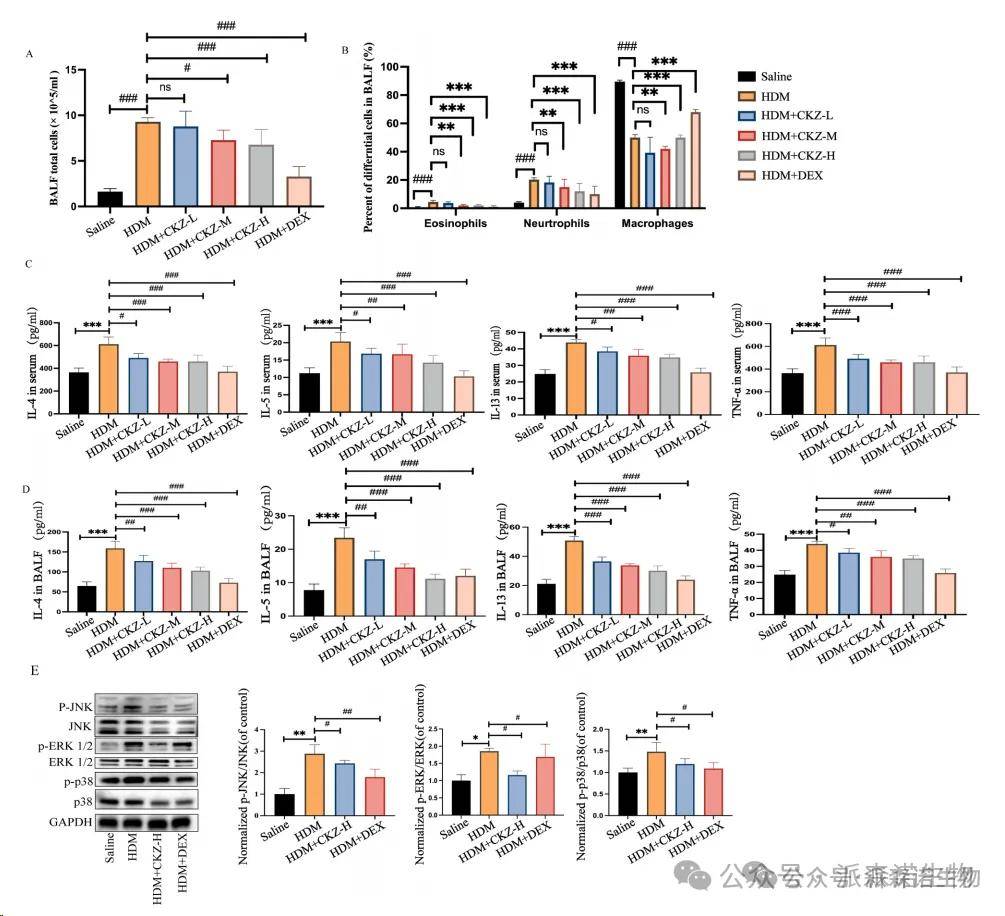
图6CKZ可以降低哮喘小鼠的BALF和血清中炎性细胞的表达和因子。
7. p38/MAPK途径在哮喘中的作用和CKZ的调节作用
基于上述结果,我们进一步探讨了使用p38 MAPK抑制剂(p38-i,SB 203,580)以及CKZ对p38途径的抑制作用(图7A)。 HE,Masson和PAS染色的结果初步表明,使用p38抑制剂可以显着改善哮喘诱导的肺损伤(图7B-C)。对TEM结果的进一步分析还表明,阻断p38途径可以减轻肺组织中的线粒体损伤(图7D)。进一步的蛋白质印迹结果表明,CKZ-H(高剂量)可以抑制p38途径的关键蛋白(P-MKK3/6,P-P38)的磷酸化,这可能是CKZ发挥其抗炎作用的关键途径之一(图7E)。
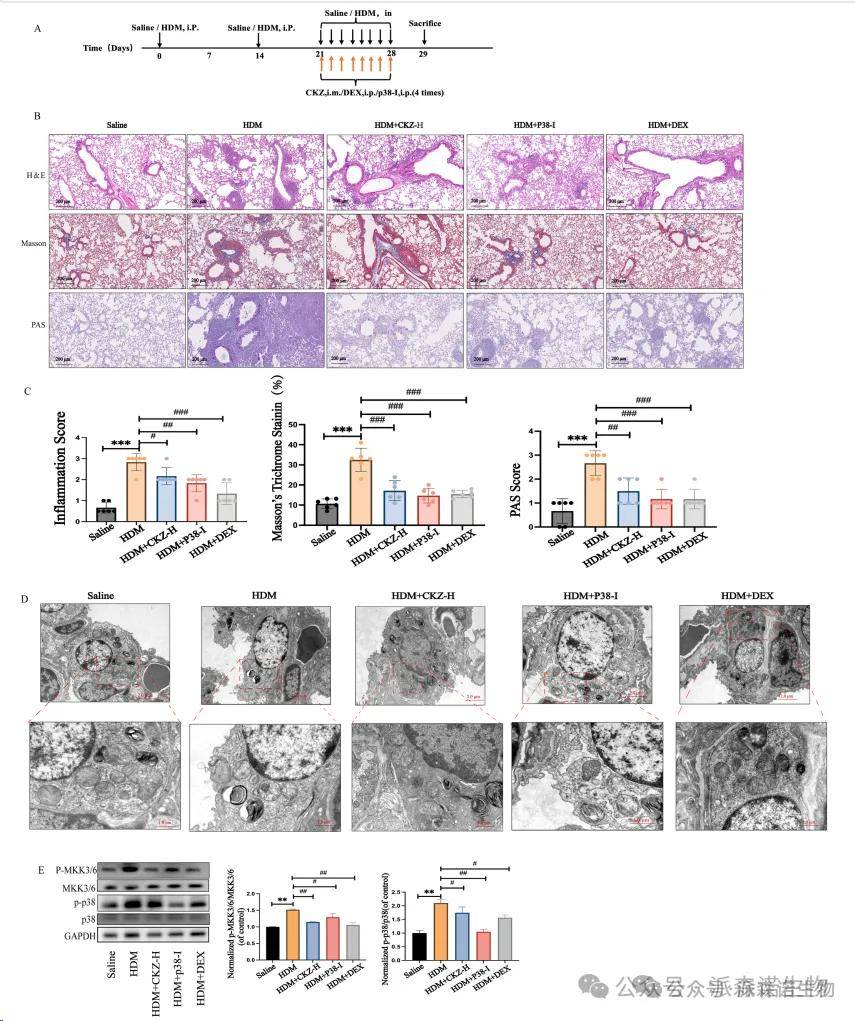
图7 p38/MAPK途径在哮喘和CKZ的调节作用中的作用。
8.CKZ可以调节BEAS-2B细胞中的炎症反应
为了评估CKZ在24小时48小时内诱导的细胞毒性,测量了细胞活力。在CCK-8测定中,在24小时和48小时治疗后,CKZ浓度分别为16%,细胞活力分别为57.58%和55.43%,并且未降至50%以下。根据结果,确定细胞活力超过80%的浓度范围为2%至8%。因此,建议将8%作为后续实验的安全剂量。 (图8a)EDU测定进行EDU测定以评估细胞增殖。使用荧光显微镜定量EDU阳性细胞的百分比。在HDM组中,与对照组相比,观察到EDU阳性细胞的数量显着增加,表明细胞增殖增强。相比之下,CKZ(2%,4%,6%)和DEX组的增殖速率低于HDM组和对照组,而6%CKZ组和DEX组对细胞增殖表现出最强的抑制作用。 (图8b和c)另外,通过伤口愈合测定法评估了细胞迁移,我们在0 h,12 h和24 h时测量了刮擦宽度,以比较差异。暴露于HDM(模型组)的BEAS-2B细胞在12 h和24 h时表现出比对照细胞差异更严重的(p <0.001,图8D和E)。与HDM处理的细胞相比,CKZ治疗(2%CKZ,4%CKZ,6%CKZ)和DEX治疗都显着改善了愈合区域的细胞迁移,而HDM处理的细胞在12 h和24 h(p <0.01,p <0.01,p <0.01,p <0.001和p <0.001和p <0.001均分别为p <0.001和p <0.001,图8D和e)。
CKZ使BEAS-2B细胞中的MAPK途径失活,以研究CKZ抑制HDM诱导的细胞损伤的机制,使用Western blotting在BEAS-2B细胞中分析了与MAPK相关蛋白的表达。结果表明,CKZ抑制了MAPK途径中HDM诱导的ERK,JNK和P38的磷酸化(分别为P <0.001,图8F)。
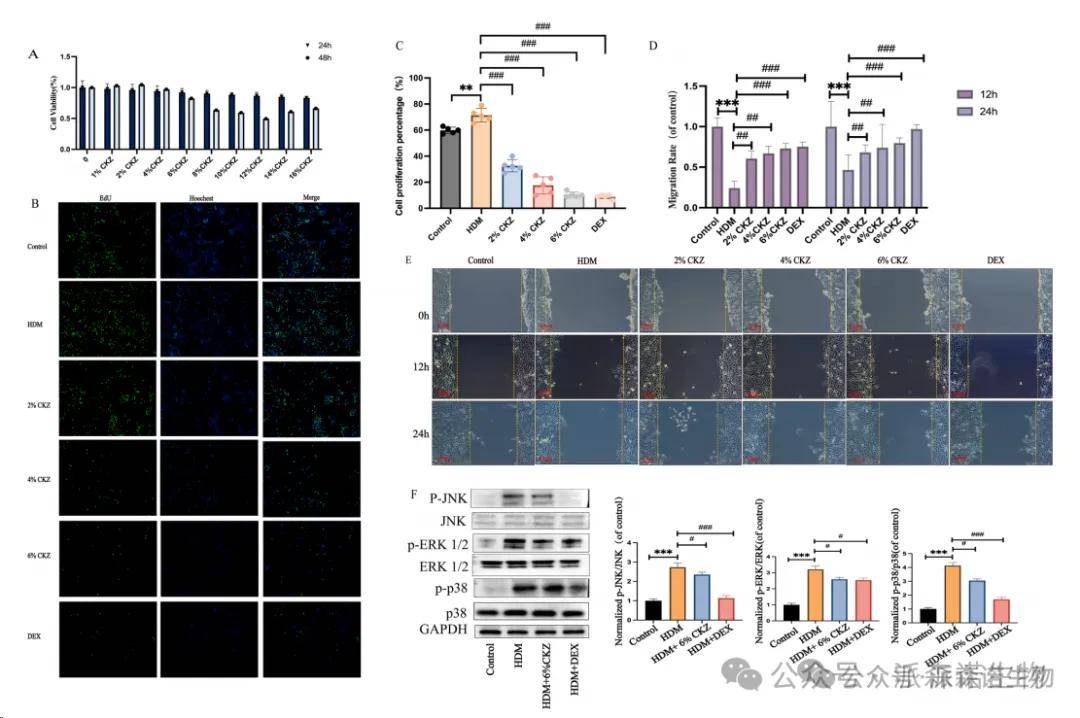
图8 CKZ可以调节BEAS-2B细胞中的炎症反应。
9. CKZ减轻了HDM诱导的BEAS-2B细胞中线粒体损伤
哮喘患者的气道上皮细胞在接触过敏原、空气污染物、炎症介质时可能会出现线粒体功能障碍。这可能导致线粒体膜电位降低,活性氧(ROS)产生增加,细胞能量代谢紊乱。BEAS-2B细胞用Mito Tracker Red染色。使用共聚焦显微镜捕获线粒体图像,随后用ImageJ软件进行分析和骨架化。结果清楚地表明,HDM治疗导致线粒体分支长度减少,导致线粒体断裂;6%的CKZ、P38-I(SB 203580)和DEX治疗都有助于恢复线粒体网络(图9A)。DCFH-DA的流式细胞术分析显示,HDM提高了细胞ROS的产生(图9B)。相比之下,CKZ、P38-I(SB 203580)或DEX治疗显著减少了HDM诱导的ROS积累。JC-1染色的流式细胞术分析表明,HDM治疗加重了MMP的损失,而CKZ、P38-I和DEX对HDM治疗的BEAS-2B细胞中的线粒体具有保护作用(图9C)。这些发现表明,CKZ不仅保护线粒体,而且具有抗凋亡作用。
CKZ对BEAS-2B细胞p38/MAPK通路的调控作用为了研究CKZ对p38/MAPK信号通路的调节作用,我们进行了蛋白质印迹分析,以评估BEAS-2B电池中p38通路的激活状态。CKZ处理显著抑制了MKK3/6和p38的磷酸化,而MKK3/6和p38总蛋白水平保持不变。(p<0.001,图9D)这表明CKZ主要通过去磷酸化调节p38活性。此外,当细胞用p38抑制剂处理时,观察到MKK3/6和p38磷酸化的类似减少。这些发现表明,CKZ可能通过下调p38/MAPK通路的激活来发挥其调节作用。
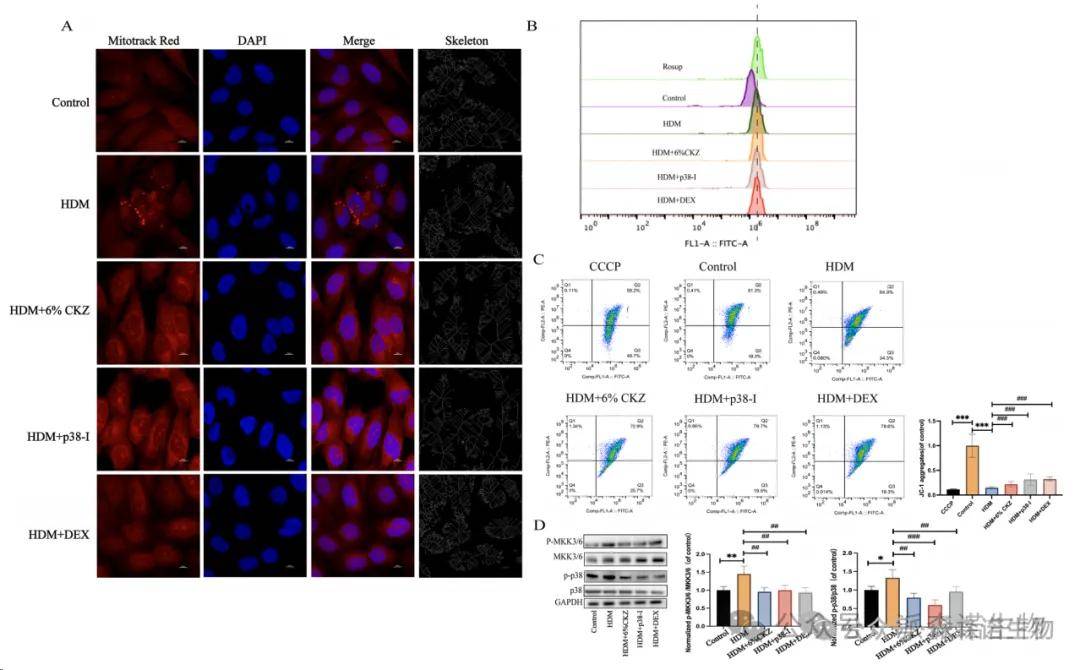
图9 CKZ减轻了HDM诱导的BEAS-2B细胞中线粒体损伤。
结 论
总之,本研究的数据表明,CKZ可以抑制小鼠HDM哮喘模型中的气道炎症,减轻肺支气管上皮细胞的线粒体损伤,并抑制MAPK信号通路的激活,这可能有助于阐明CKZ在哮喘治疗中的潜在调控机制。
参考文献
Yuan J, Wang Y, Sha B, Zhang Y, Mokuy OOEM, Jin M, Yu L, Xu X. Network pharmacology and experimental validation of inflammation inhibition by ChuanKeZhi Injection in treating asthma. Phytomedicine. 2025 Jul 25;143:156891. doi: 10.1016/j.phymed.2025.156891. Epub 2025 May 21. PMID: 40450983