
Metabolomics and proteomics reveal blocking argininosuccinate synthetase 1 alleviates colitis in mice
代谢组学和蛋白质组学揭示阻断精氨酸琥珀酸合成酶1可缓解小鼠的结肠炎。
发表期刊:Nature Communications
影响因子:15.7
发表时间:2025
发现队列: 131 例UC患者 和 127 例健康对照
验证队列1:141例UC vs 136例对照
验证队列2、3:各30例UC vs 30例对照
样本类型:血清、结肠黏膜、粪便
组学技术:血清非靶/靶向代谢组、黏膜蛋白质组、粪便16S、分子对接

研究背景
溃疡性结肠炎 (UC) 是一种慢性特发性炎症性肠病,UC 已成为一项全球健康挑战。UC 的发展是由多种因素的复杂相互作用驱动的,尽管目前在了解 UC 的发病机制方面取得了重大进展,但其发病机制的确切机制仍不完全清楚。目前的疗法,如皮质类固醇和靶向肿瘤坏死因子的生物制剂,已经改善了疾病管理,但也存在一些挑战。这些局限性凸显了迫切需要探索针对 UC 病理生理学关键方面的治疗策略。
技术路线
①临床现象发现
UC患者血清中存在49种差异代谢物。mTOR信号通路被显著激活。精氨酸是上调最显著的代谢物之一,且其水平与疾病严重程度(Mayo评分)呈强正相关。
②锁定关键靶点
发现精氨酸合成通路中的限速酶—ASS1在UC患者的结肠组织中蛋白和mRNA水平均显著上调。ASS1的表达水平也与疾病严重程度正相关。
③功能验证
体外:在肠上皮细胞中用IL-6刺激,发现ASS1表达上调,mTOR通路激活。体内:给DSS结肠炎小鼠模型补充外源精氨酸或过表达ASS1,发现小鼠病情显著加重。
④机制深入探索
研究发现炎症因子IL-6能诱导组蛋白修饰(如H3乙酰化、H3K4三甲基化增加,H3K9二甲基化减少),从而开放ASS1基因的启动子区域,促进其转录。
⑤转化应用
SPR实验证实C-01与ASS1具有高亲和力结合。C-01治疗能有效降低精氨酸水平,抑制mTOR通路,显著改善结肠炎症状,效果与临床常用药5-ASA相当。
结 果
1.建立人类溃疡性结肠炎多中心队列
我们在中国的三家医院建立了多中心人类UC队列,在发现队列和验证队列中,对照组和 UC 参与者在性别、年龄或BMI方面均无显著差异。发现队列的非靶向代谢组学数据得到9757个代谢特征。
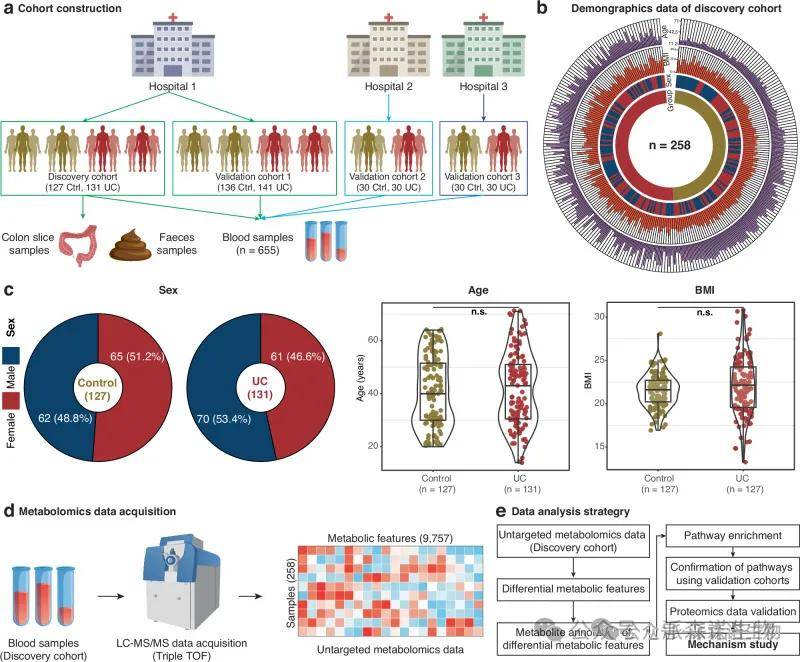
图1 建立多中心人类 UC 队列
2.多组学数据显示 UC 患者的精氨酸和ASS1较高
t-SNE 图表明 UC 组和对照组的代谢特征形成不同的集群。对筛选到的49种差异表达的代谢物进行 KEGG 通路富集分析,发现mTOR 信号通路显著富集。代谢物与 Mayo 评分的 Pearson 相关性分析发现,正相关最高的两种代谢物是精氨酸和亮氨酸。
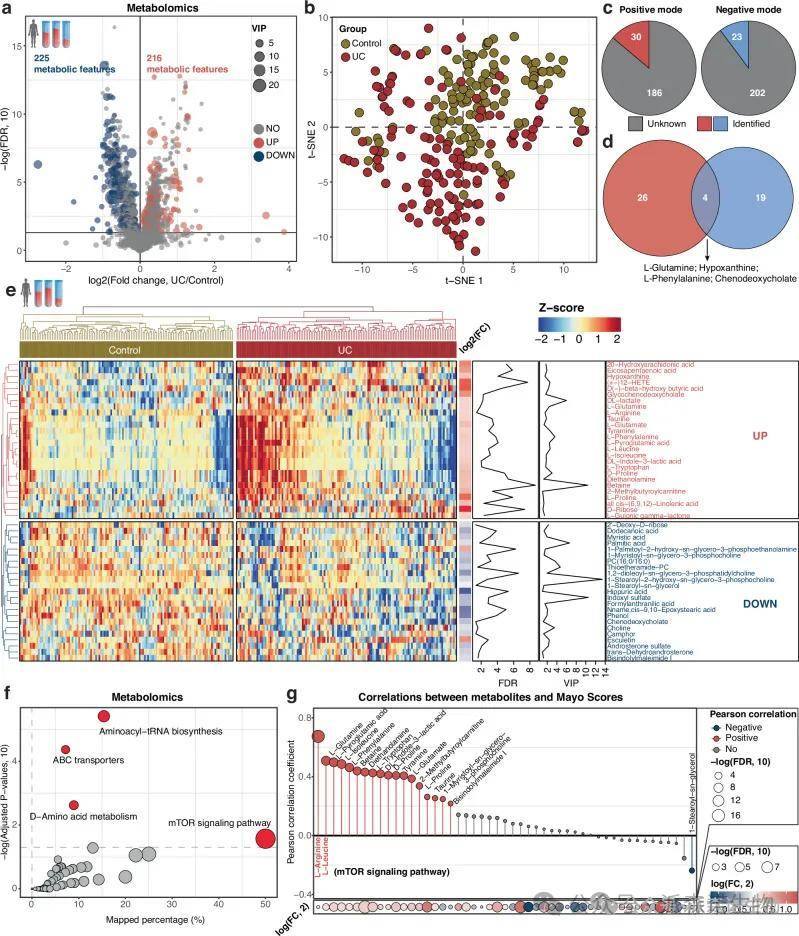
图2 对照组和 UC 组之间不同的代谢谱
我们发现三个验证队列的UC 患者的血清和粪便样本中的精氨酸均显着上调。UC患者血清样本中的中间代谢物精氨酸琥珀酸盐显著升高。此外,患者血清中精氨酸的下游代谢物显著上调。蛋白组学显示,与健康组相比UC组的结肠组织样本中ASS1蛋白显着上调。四个公共 UC 数据集的 GEO 分析进一步验证了 UC 患者 ASS1 的上调。在UC患者的6个结肠样本中,ASS1的IHC评分也与Mayo评分呈正相关。
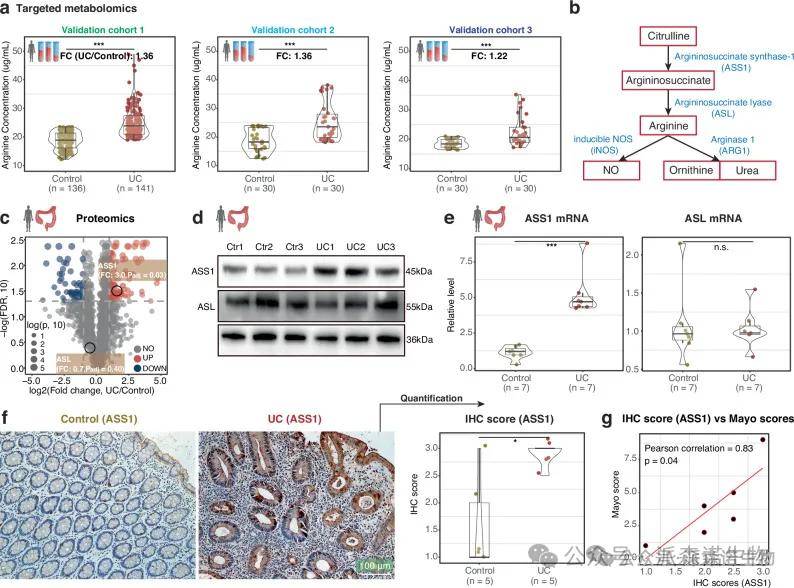
图3 人类 UC 患者精氨酸和 ASS1 水平升高
3.外源性精氨酸加剧了 UC 小鼠模型的临床结果
UC小鼠模型显示出体重显着快速减轻,疾病活动指数增加,结肠长度减少。在补充精氨酸的UC小鼠模型中,这种影响进一步加剧。正如预期的那样,UC 小鼠模型和补充精氨酸的小鼠模型的血清和结肠组织中的精氨酸水平显着升高。免疫印迹显示磷酸化的mTOR、STAT3显著上调,同时UC小鼠模型的结肠组织中ASS1和COX-2蛋白的表达增加。LEfSe显示,梭菌属和颤杆菌属的丰度显著降低,并在精氨酸给药后进一步降低。
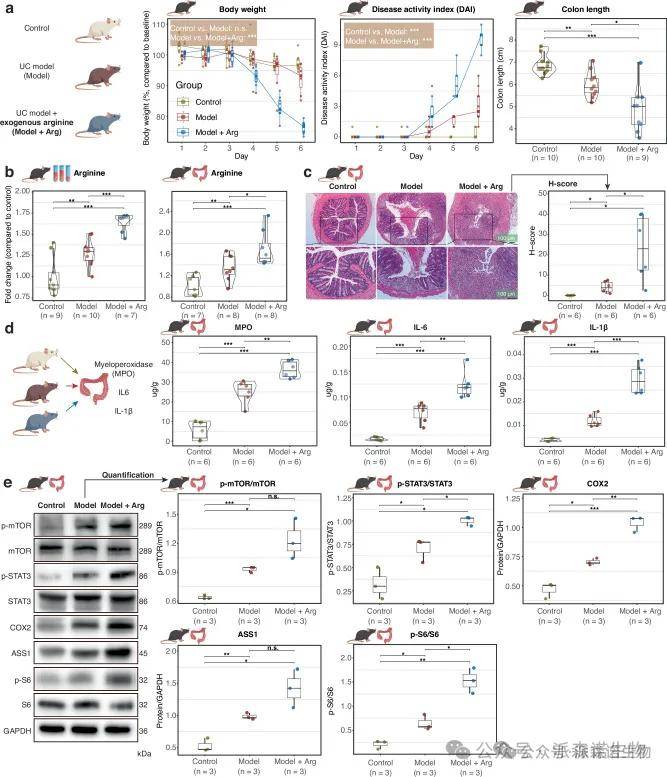
图4 外源性精氨酸加剧了 UC 小鼠模型的临床结果
4 精氨酸合成的操纵显著影响UC小鼠模型的临床结果
ASS1过表达对UC小鼠模型中的体重,DAI和结肠缩短产生了相似且显着的影响。MDLA抑制ASS1也减轻了UC小鼠模型的临床结果,结肠组织的组织病理学分析进一步证实,MDLA抑制ASS1可减轻炎症细胞浸润和粘膜损伤。
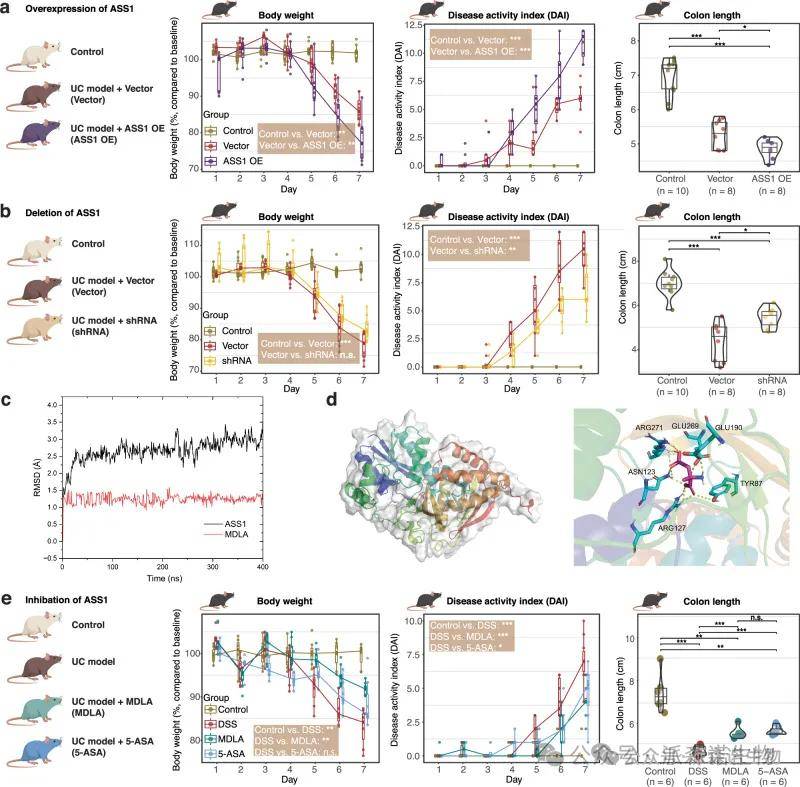
图5 调节精氨酸合成会加重或缓解UC小鼠模型的临床结果
5 研究细胞对转录组FLC特征的贡献
在IL-6刺激下,通常与活跃染色质相关的H3乙酰化和H3K4三甲基化被招募到ASS1启动子区域。代表抑制染色质的标志性组蛋白标记H3K9二甲基化在ASS1启动子区域下降。利用JASPER数据库,我们确定了转录因子c-Myc位于ASS1启动子内。重要的是,c-Myc的耗竭不仅阻止了IL-6诱导的ASS1上调,还改变了ASS1启动子区域的染色质结构。
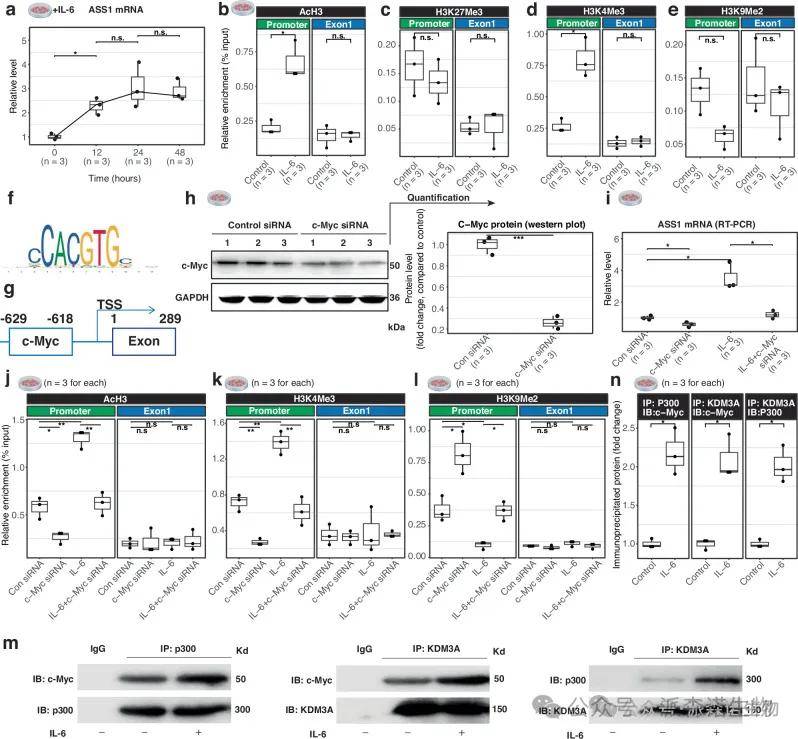
图6 IL-6暴露下结肠上皮细胞中ASS1的表观遗传激活
6.C-01 是 ASS1 的抑制剂
我们提出了一种计算机辅助药物设计策略来筛选ASS1抑制剂以治愈UC。其中,C-01和C-02有效抑制了IL-6暴露的NCM460细胞中STAT3的磷酸化,C-01效果更显著。分子动力学和表面等离子体共振分析显示C-01可以直接与ASS1结合。C-01 治疗有效降低了结肠炎小鼠的 DAI 评分,减轻了结肠缩短,改善了结肠组织病理学,并降低了促炎细胞因子的水平。
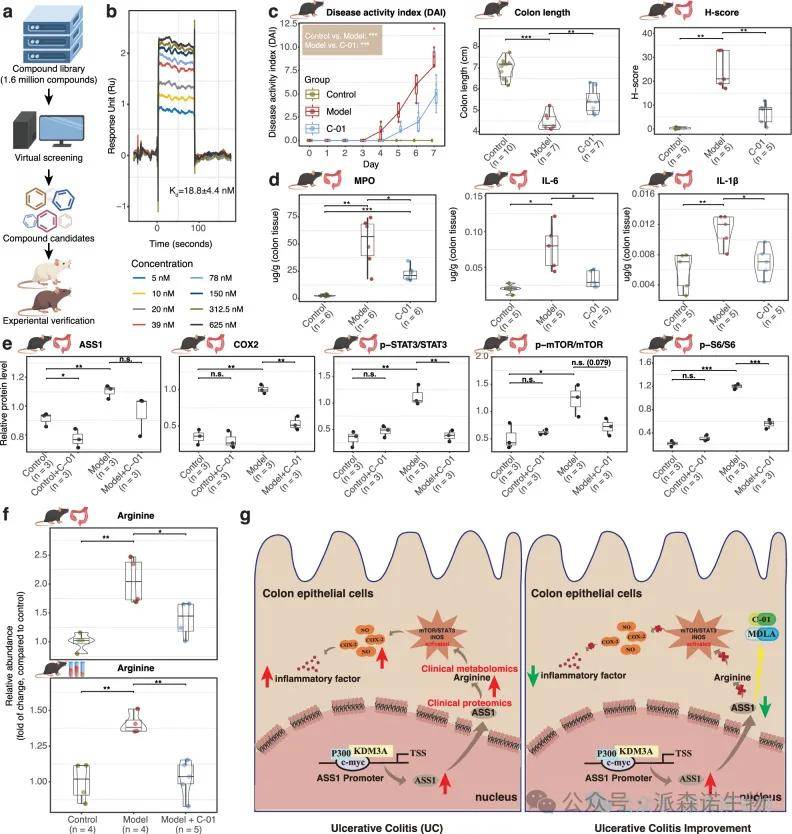
图7 筛选确定 C-01 是 ASS1 的抑制剂
文章总结:
针对多中心队列的代谢组学和蛋白质组学分析揭示,UC患者的血清精氨酸水平以及ASS1均显著升高。外源性精氨酸输注和ASS1过表达会加重小鼠结肠炎的病理特征,而抑制或沉默ASS1则可为结肠炎提供保护。ASS1的诱导伴随着ASS1启动子周围H3乙酰化和H3K4三甲基化水平的增加,以及H3K9二甲基化水平的降低,这表明ASS1在结肠炎中发生了表观遗传激活。ASS1/精氨酸轴触发了mTOR和iNOS的激活,并诱导肠道菌群失调,从而导致结肠炎。此外,我们还发现C-01通过与ASS1高度结合,显著改善了结肠炎。我们的研究结果表明,ASS1可能是治疗UC的一个有前景的靶点。




















