
一、前 言
近年来,单细胞测序技术(scRNA-seq)的快速发展为解析生物系统的细胞异质性、发育轨迹及分子互作网络提供了前所未有的分辨率。随着技术成本的降低和实验方案的优化,研究焦点正从单一器官或组织向跨器官、多组织系统性研究拓展。这类研究核心目标是通过单细胞分辨率解析复杂生物系统中细胞异质性、跨组织互作及疾病机制,为系统生物学和精准医学提供全新视角。
在PubMed上以“single-cell RNA-seq and multi-organ”为关键词进行搜索,近五年(2020-2025 年)跨器官多组织单细胞研究呈现显著增长态势。
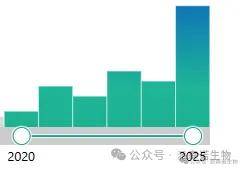
近5年文献发表合集(来源PubMed)
二、研究应用场景
应用场景1.构建细胞图谱,解析器官发育机制
自 2016 年 “人类细胞图谱计划”(The Human Cell Atlas)启动以来,多篇文章连续发表,首次构建了涉及 30 多种组织器官的单细胞图谱,其覆盖从发育到成年再到老年的阶段,系统性地绘制了人体所有细胞的分子特征、空间分布和功能网络,为人类健康和疾病的诊断、监测、治疗奠定了新基础,以推动全球医疗保健和医学的重大进步;同时,跨组织单细胞测序通过整合多器官数据,正推动发育生物学从 “静态描述” 向 “动态调控” 研究跃迁,如 2022 年《Science》发表的 Tabula Sapiens 项目对 30 余种人类组织的百万级单细胞进行测序,首次系统揭示了组织间保守的细胞特征(如巨噬细胞发育路径)与器官特异性分化机制(如心脏内皮细胞的 SLC14A1 代谢标记)。
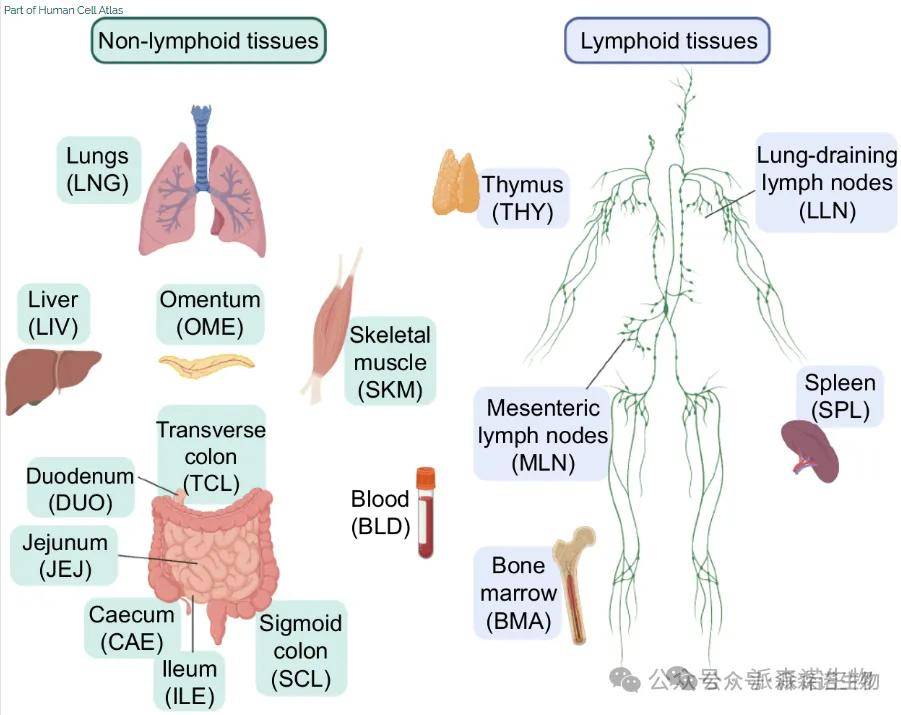
HCA单细胞图谱[1]
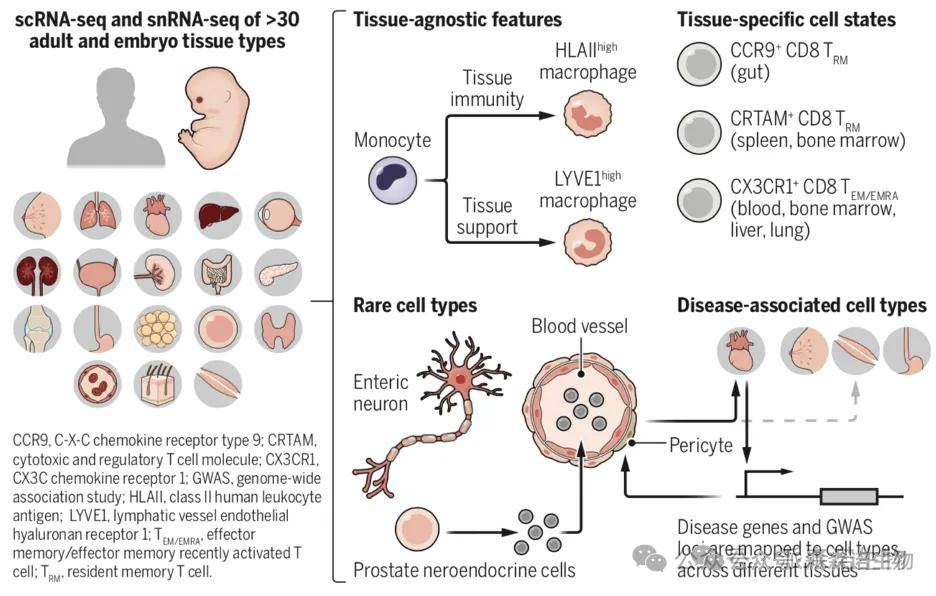
泛组织单细胞图谱[2]
应用场景2.跨器官轴调控研究,解析病理网络与疾病机制
单细胞技术通过追踪跨器官信号传导,正在重塑对复杂疾病的认知范式。2024 年《Cell》研究发现,中风后心脏纤维化的核心机制是脑损伤释放的 IL-1β 激活骨髓造血干细胞的 NF-κB/STAT1 通路,导致循环 Ly6Chigh 单核细胞持续募集至心脏并分化为促炎巨噬细胞。这种 “脑 - 心轴” 调控可通过中和 IL-1β 使心脏纤维化面积减少 60%,验证了跨器官免疫记忆的治疗潜力。
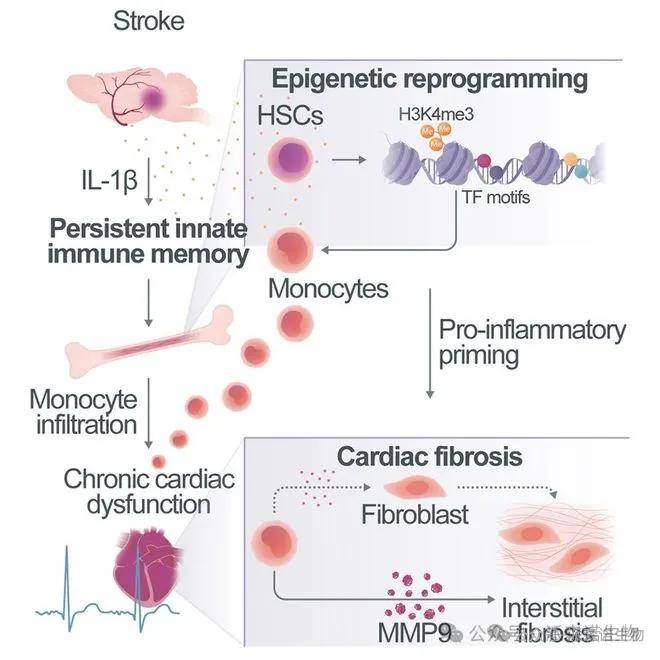
脑-心轴调控机制图[3]
应用场景3. 肿瘤微环境与免疫治疗研究,赋能精准医学实践
单细胞测序技术正推动肿瘤免疫治疗从 “广谱覆盖” 向 “亚型精准干预” 跃迁,而跨组织成纤维细胞异质性的发现为这一转型提供了关键支撑。2024 年《Cancer Cell》发表的跨组织人类成纤维细胞图谱研究,通过整合 517 例样本的单细胞数据,首次揭示了肌成纤维细胞在肿瘤微环境中的功能分化机制,这一研究不仅突破了传统癌症相关成纤维细胞(CAFs)的单一分类框架,更通过 “亚型 - 机制 - 治疗” 的闭环逻辑,为个体化联合治疗提供了新范式。
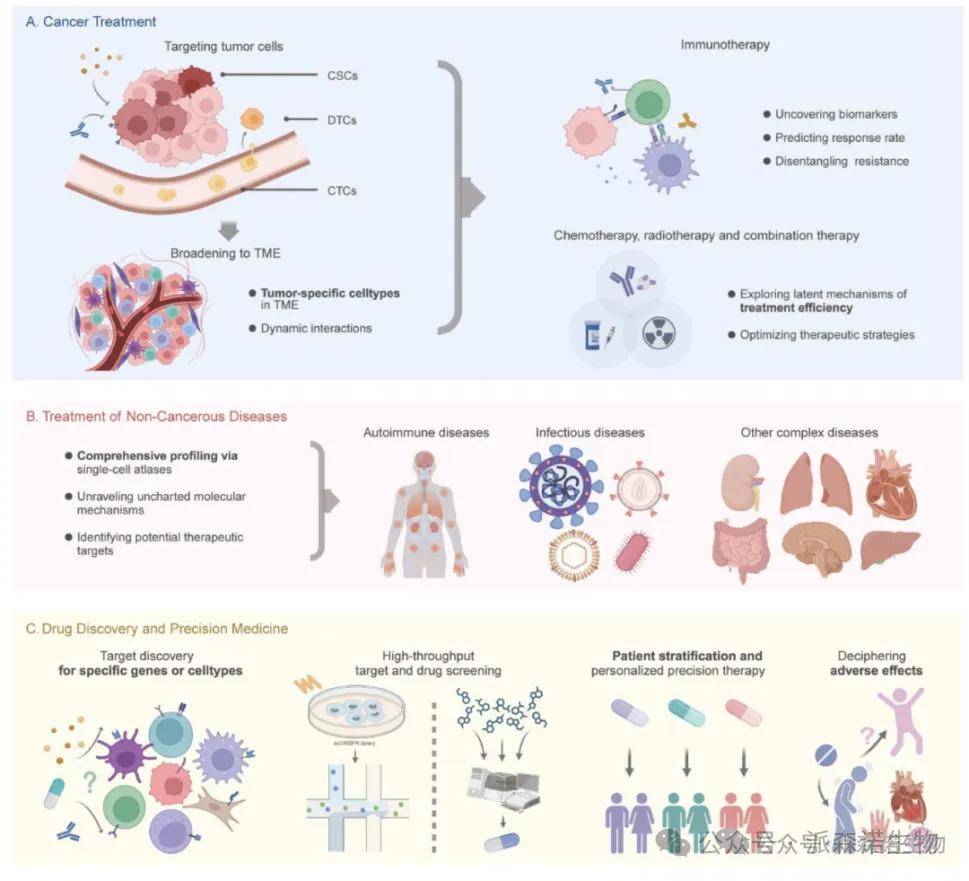
单细胞组学在癌症治疗、非癌症疾病治疗以及药物发现和精准医疗中的临床应用
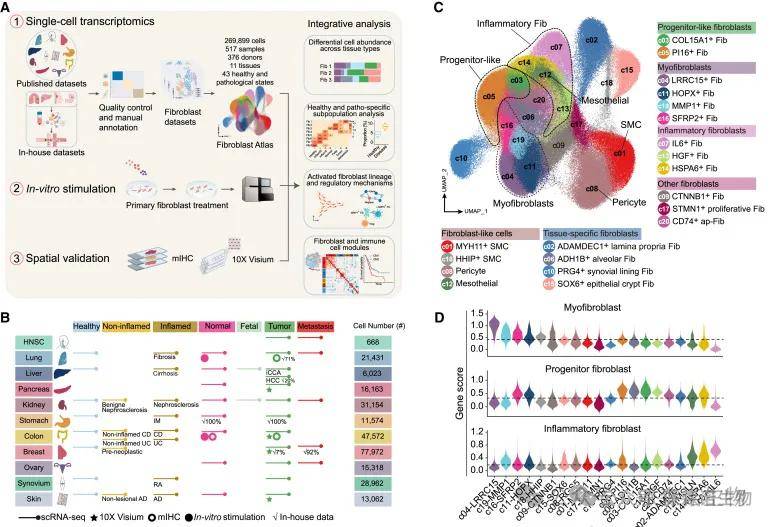
健康和疾病中的跨组织成纤维细胞图谱[4]
三、研究目标
针对不同组织样本(全身组织器官、重要组织器官),进行单细胞转录组测序,配合空间转录组测序从而实现以下研究目标:
1.构建兼具单细胞分辨率与空间位置信息的转录组图谱(为空间异质性研究奠定基础)。
2.探究不同组织区域中细胞类型的基因表达差异及空间分布关联规律。
3.解析特定空间位置的细胞类型所涉及的基因表达调控网络及其与组织功能的关联。
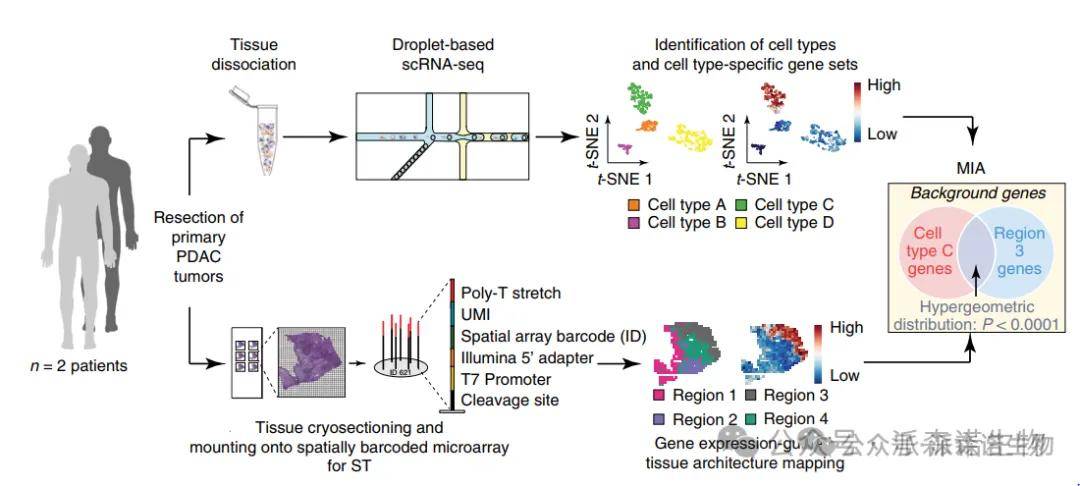
单细胞测序和空转联合分析方案示例[5]
四、研究思路
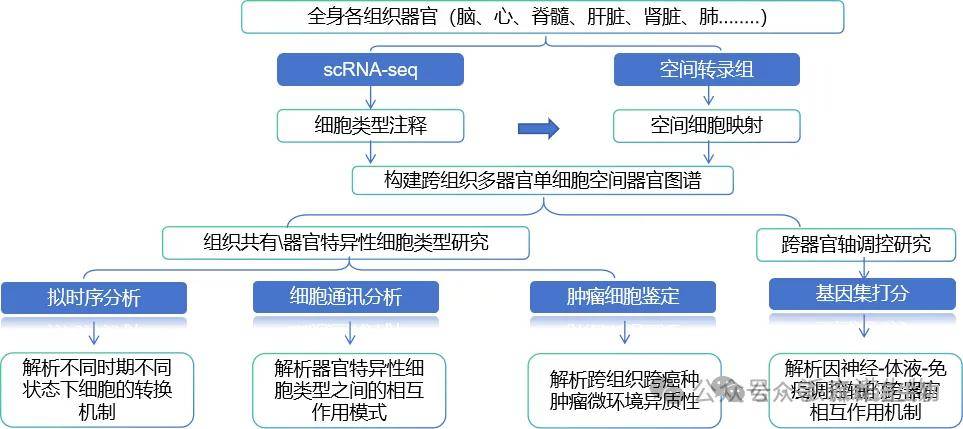
五、研究对象
实验设计方向1:跨组织细胞图谱研究
一般选择全身组织器官/重要组织器官,以下组织建议可供参考
小鼠:23个组织和器官的小鼠[6]
食蟹猕猴:45个组织/器官(全组织)[7]
牛:10种组织类型(多组织)[8]
猪:家猪的20个组织器官(全组织)[9]
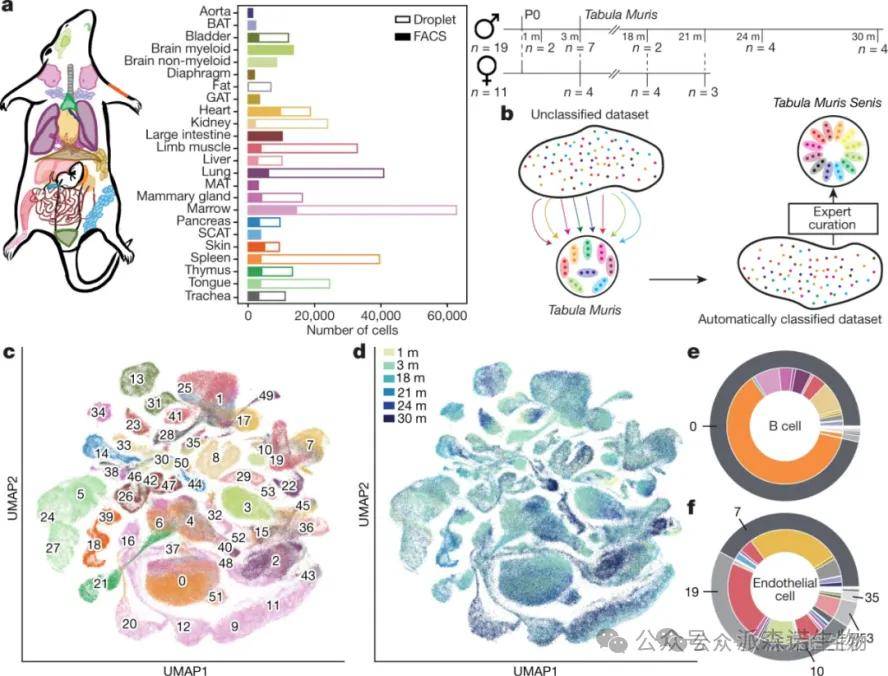
小鼠衰老组织的单细胞图谱[5]
实验设计方向2:跨组织器官轴研究
一般选择以“神经-内分泌-免疫”轴为核心,解析疾病发生发展机制,以下组织可供参考
(1)“肠-器官轴”:肠、脑、肝脏、心脏、肺脏、胰腺.......
(2)“神经-内分泌轴”:脑-心轴、脑-心-肾脏轴、
(3)“内分泌-免疫轴”:心脏-血液-脾脏免疫调节轴
(4)“骨-多器官轴”[10]:肌肉-骨轴、卵巢-骨轴
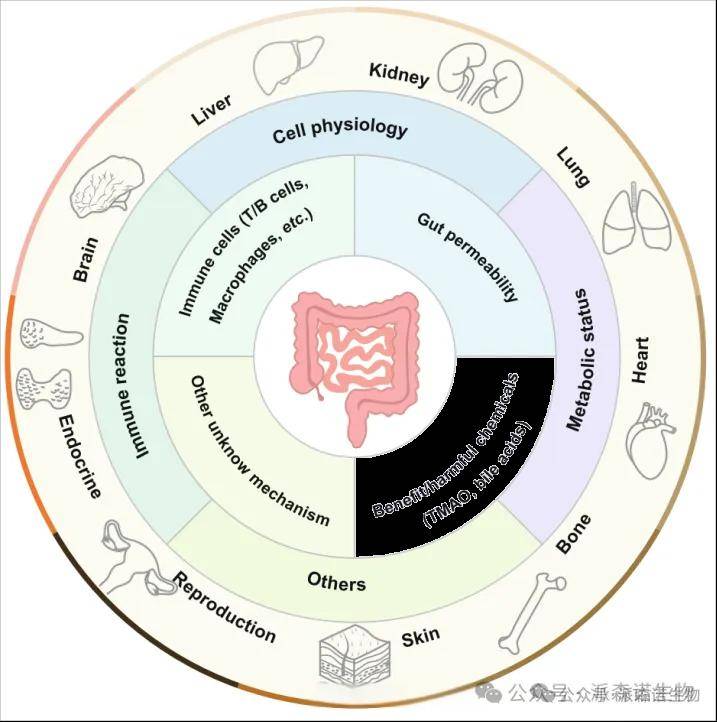
实“肠 - 器官轴” 的一般调节机制
实验设计方向3:跨组织跨癌种肿瘤微环境研究
(1)跨组织的人成纤维细胞图谱[4]:517 例人类样本,涵盖 11 种组织(肺、乳腺、结肠等),包括健康(120 例)、炎症(187 例)、癌前病变(55 例)、癌症及转移(155 例)。
(2)跨组织多细胞协同模式在肿瘤中的作用[9]:乳腺、肺、结直肠、胃、肝、前列腺、肾、胰腺等35个人体组织。
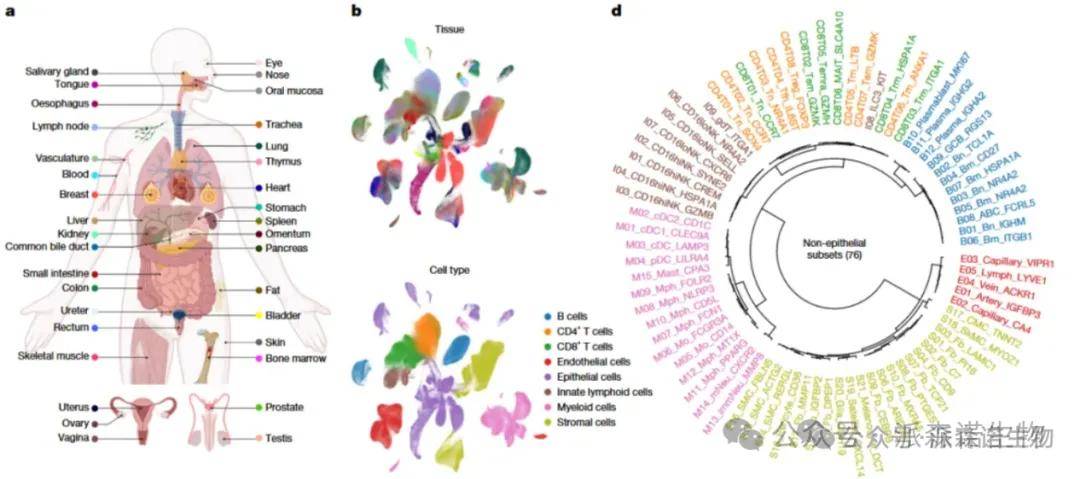
人类的单细胞图谱[11]
六、研究重点分析方法和预期结果
1.构建跨器官组织细胞图谱
整合多器官(如心、肝、肺等)的单细胞转录组 / 空间转录组数据,通过细胞聚类结合 UMAP 降维解析细胞异质性,构建跨组织多器官细胞图谱,揭示细胞类型的 “器官特异性” 与 “跨器官共有特征”。对跨组织保守或特异的 marker 基因,通过 多组学关联分析(RNA+ATAC 共定位) 、空间转录组映射及细胞功能实验(如谱系追踪),验证细胞类型注释在不同器官中的一致性与生物学合理性。
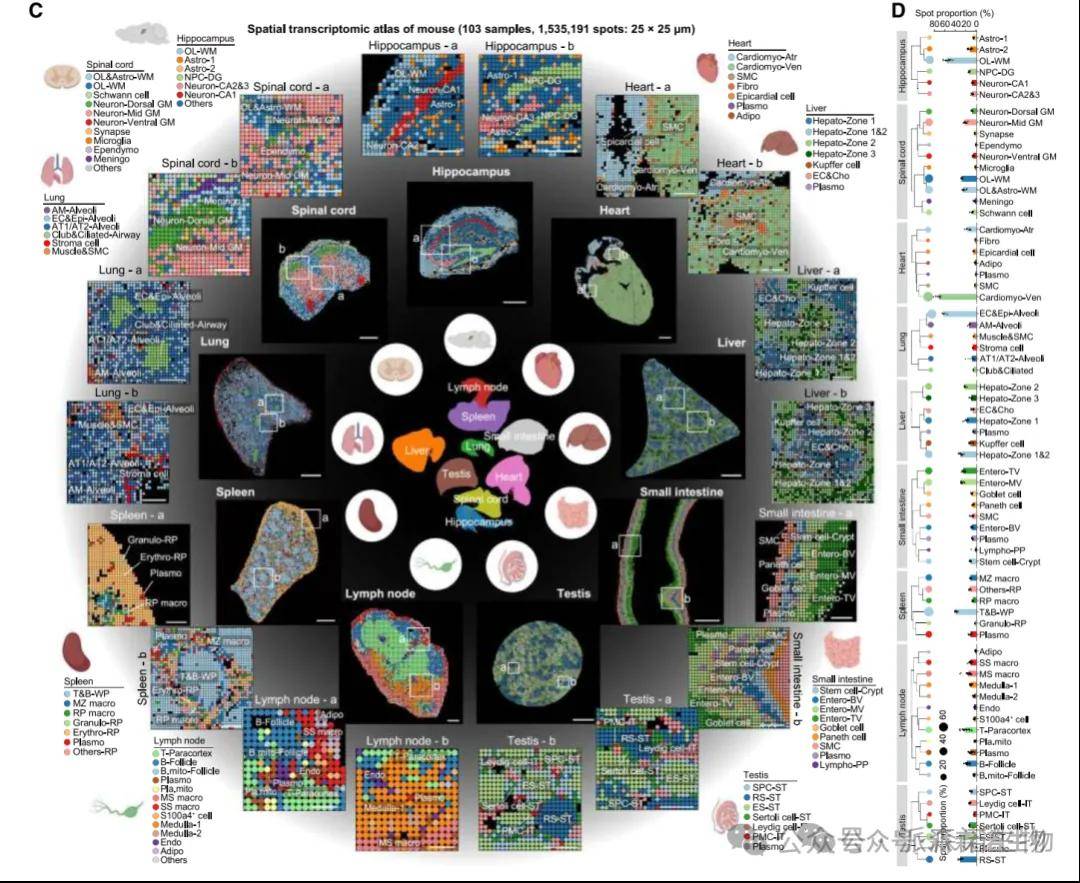
跨组织多器官空间细胞图谱[12]
2.组织共有\器官特异性细胞类型研究
通过对跨器官的不同细胞类群进行比较分析,评估其转录相似性以区分两类细胞类型。针对组织共有细胞类型,采用 Pearson 相关性分析方法,量化不同器官中相同细胞群的转录谱关联程度,判断其保守性;针对器官特异性细胞类型,则通过分析特征基因及关键转录因子在不同器官中的相对表达水平,揭示其表达的器官特异性模式,为解析这些细胞的器官特异性功能提供方法学支撑。
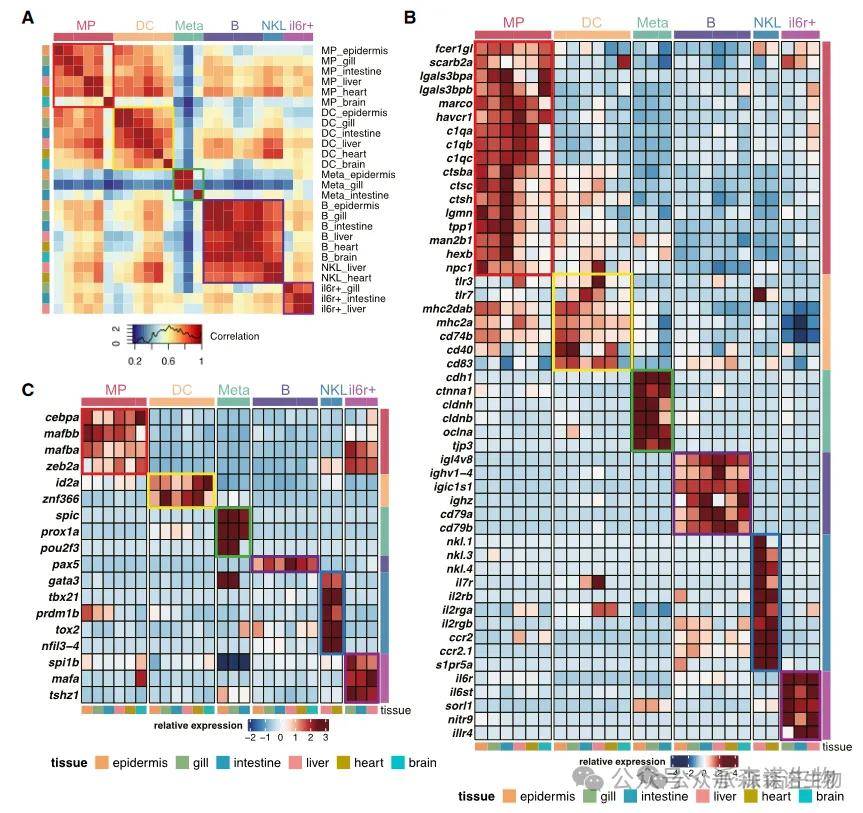
相同细胞群在不同组织器官间的保守性和特异性[14]
3.组织共有\器官特异性细胞类型研究-拟时分析
跨器官共有细胞类型拟时追踪:采用 Monocle 等拟时算法,构建同一细胞类型在不同器官中的发育轨迹,对比分化路径的分支差异,解析细胞状态动态演变的器官异质性;轨迹关键节点分子特征解析:挖掘拟时轨迹上的阶段特异性基因、转录因子调控模块,结合功能富集分析,揭示器官微环境驱动细胞功能分化的分子机制。
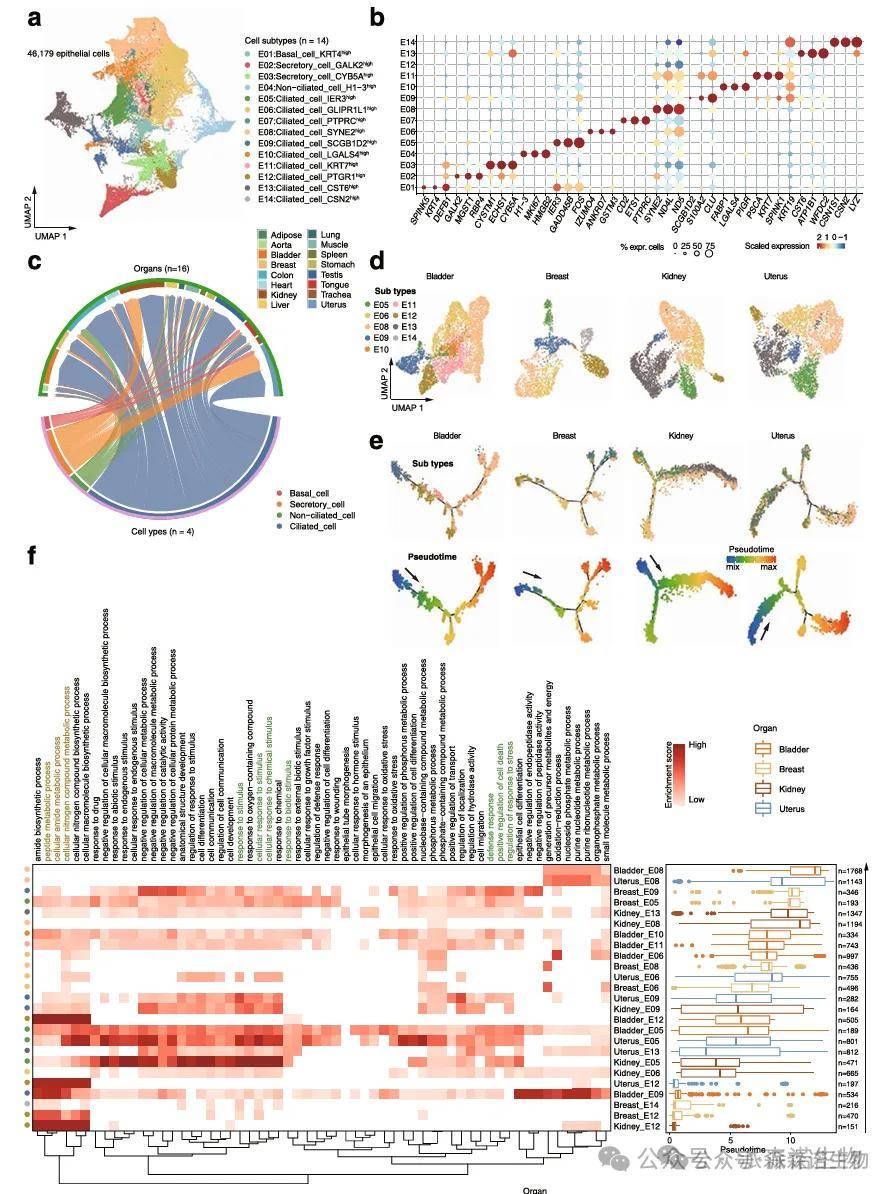
不同组织器官的上皮细胞亚群分化轨迹图[13]
4.组织共有\器官特异性细胞类型研究-细胞通讯分析
针对跨器官共有细胞类型,通过配体 - 受体互作分析(如 CellChat 算法),对比其在不同器官中的通讯强度、信号通路重叠度,挖掘跨组织保守的细胞互作模块;对器官特异性细胞类型,解析其独有的配体 - 受体对及上下游调控网络,结合功能富集,揭示器官微环境驱动细胞通讯特化的分子机制。
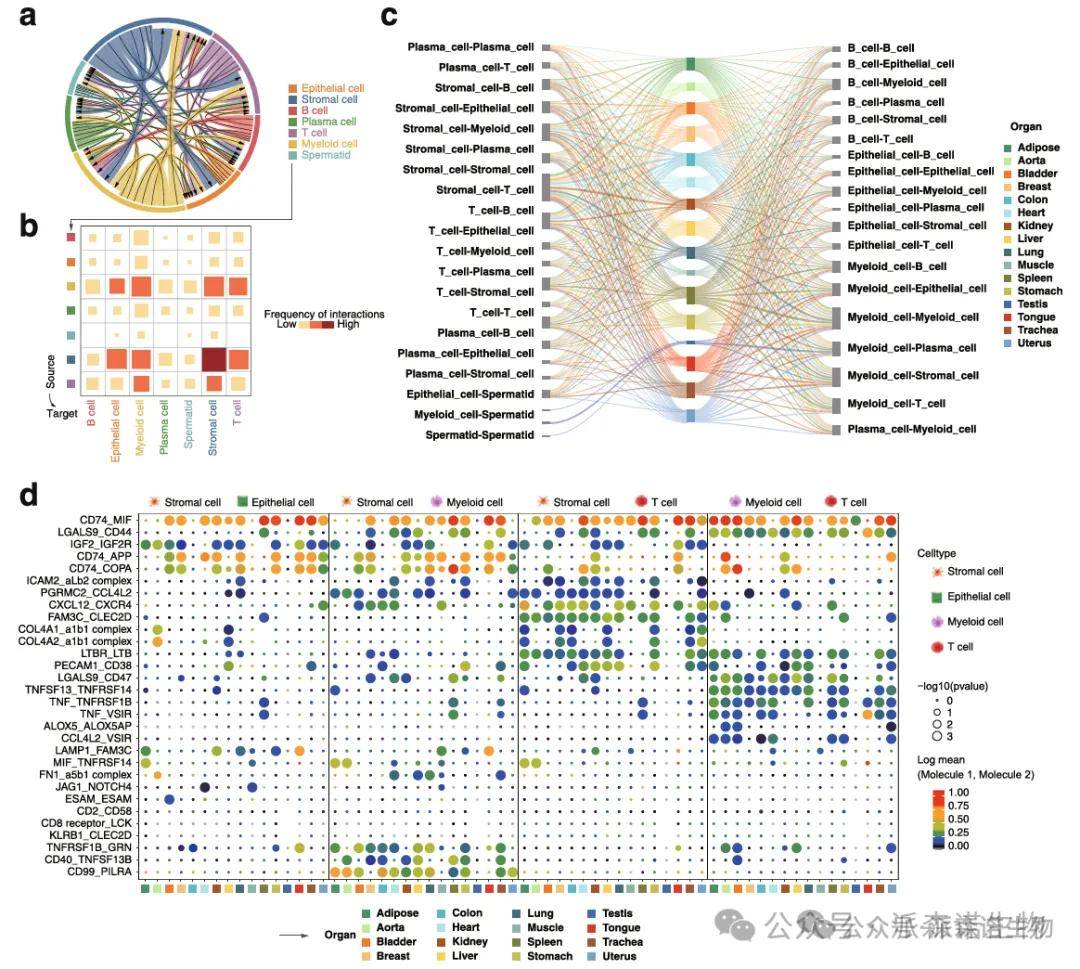
不同组织器官的细胞间的通讯模式解析[13]
5.组织共有\器官特异性细胞类型研究-肿瘤细胞鉴定
对跨器官共有的肿瘤细胞类型,通过基因组突变谱、表观遗传特征比对,挖掘保守的致癌驱动通路及免疫逃逸机制;针对器官特异性肿瘤细胞,解析其在特定微环境中特有的代谢重编程、基质互作模式,揭示肿瘤细胞的器官定植适应性与治疗耐药关联特征。
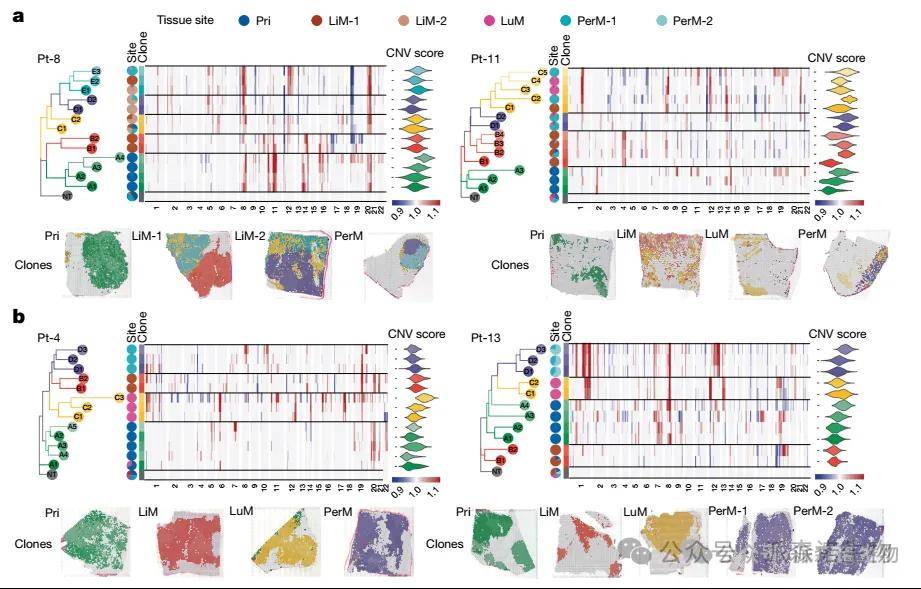
不同组织器官的细胞间的通讯模式解析[15]
6.跨器官研究
整合多器官单细胞及空间组学数据,挖掘细胞类群间跨器官的信号通讯链与功能关联,构建 “细胞 - 信号 - 器官” 互作轴;对比该轴在发育、稳态及疾病中的动态调控模式,解析跨器官协同作用的分子机制及器官特异性响应差异。
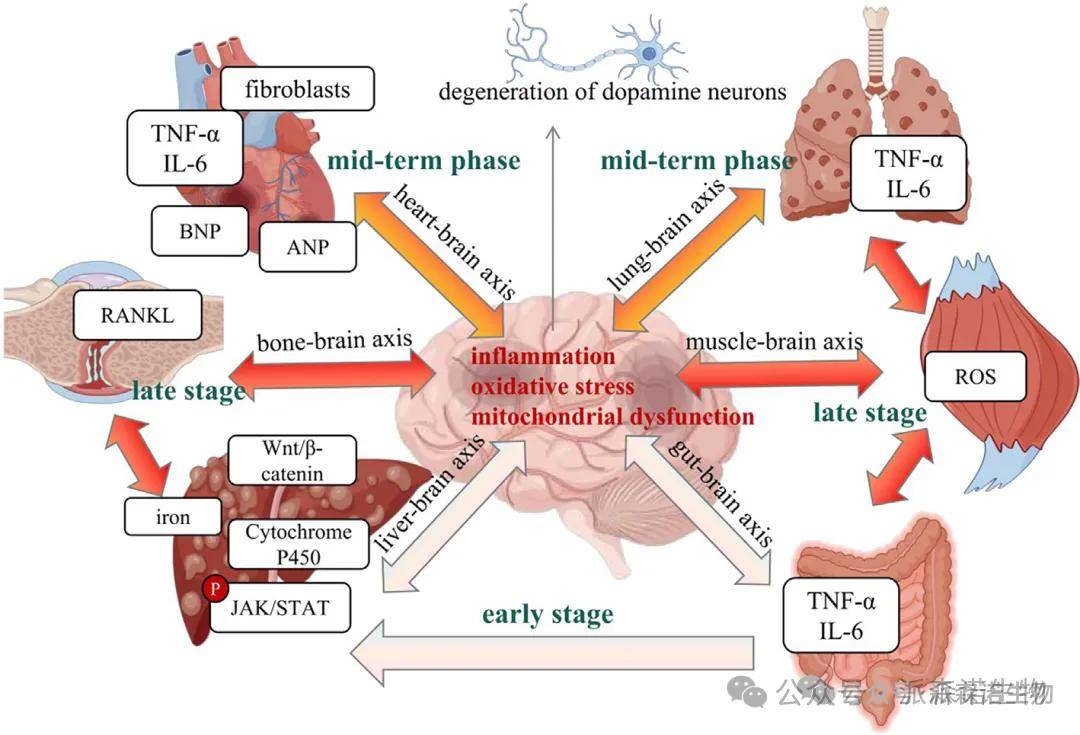
多脏器-大脑轴协同作用的整合机制模型[15]
七、总 结
通过整合多器官单细胞组学数据,从 细胞类型注释、拟时序动态、细胞通讯及跨器官轴构建 等维度,解析组织共有与器官特异性细胞的异质性、发育轨迹及互作模式;最终揭示跨器官细胞协同调控的分子机制,为理解器官发育、稳态维持及疾病跨器官关联提供 全景式研究框架 。
参考文献:
[1]https://explore.data.humancellatlas.org/
[2]Liu Z, Zhang Z. Mapping cell types across human tissues. Science. 2022;376(6594):695-696.
[3]Simats A, Zhang S, Messerer D, et al. Innate immune memory after brain injury drives inflammatory cardiac dysfunction. Cell. 2024;187(17):4637-4655.e26.
[4]Gao Y, Li J, Cheng W, et al. Cross-tissue human fibroblast atlas reveals myofibroblast subtypes with distinct roles in immune modulation. Cancer Cell. 2024;42(10):1764-1783.e10.
[5]Moncada R, Barkley D, Wagner F, et al. Integrating microarray-based spatial transcriptomics and single-cell RNA-seq reveals tissue architecture in pancreatic ductal adenocarcinomas. Nat Biotechnol. 2020;38(3):333-342.
[6]Tabula Muris Consortium. A single-cell transcriptomic atlas characterizes ageing tissues in the mouse. Nature. 2020;583(7817):590-595.
[7]Liao, Yuan et al. “Cell landscape of larval and adult Xenopus laevis at single-cell resolution.”Nature communications vol. 13,1 4306. 25 Jul. (2022).
[8]Calderon, Diego et al. “The continuum of Drosophila embryonic development at single-cell resolution.” Science (New York, N.Y.) vol. 377,6606 (2022): eabn5800.
[9]Zhu, Jiacheng et al. “Single-cell atlas of domestic pig cerebral cortex and hypothalamus.” Science bulletin vol. 66,14 (2021): 1448-1461.
[10]Deng AF, Wang FX, Wang SC, Zhang YZ, Bai L, Su JC. Bone-organ axes: bidirectional crosstalk. Mil Med Res. 2024;11(1):37. Published 2024 Jun 12.
[11]Shi Q, Chen Y, Li Y, et al. Cross-tissue multicellular coordination and its rewiring in cancer. Nature. 2025;643(8071):529-538.
[12]Ma S, Ji Z, Zhang B, et al. Spatial transcriptomic landscape unveils immunoglobin-associated senescence as a hallmark of aging. Cell. 2024;187(24):7025-7044.e34.
[13]Qu J, Yang F, Zhu T, et al. A reference single-cell regulomic and transcriptomic map of cynomolgusZhou Q, Zhao C, Yang Z, et al.
[14]Cross-organ single-cell transcriptome profiling reveals macrophage and dendritic cell heterogeneity in zebrafish. Cell Rep. 2023;42(7):112793. doi:10.1016/j.celrep.2023.112793IF: 6.9 Q1 monkeys. Nat Commun. 2022;13(1):4069. Published 2022 Jul 13.
[15]Pei G, Min J, Rajapakshe KI, et al. Spatial mapping of transcriptomic plasticity in metastatic pancreatic cancer. Nature. 2025;642(8066):212-221.
[16]Liu T, Wu H, Wei J. Beyond the Brain: Exploring the multi-organ axes in Parkinson's disease pathogenesis. J Adv Res. Published online May 16, 2025.




















