
2025-11-07

文章信息
英文题目:A telomere-to-telomere gap-free assembly integrating multi-omics uncovers the genetic mechanism of fruit quality and important agronomic trait associations in Pomegranate
中文题目:通过整合多组学技术实现端粒间无缝组装,揭示了石榴果实品质的遗传机制及其与重要农艺性状的关联。
发表期刊:Plant Biotechnology Journal
影响因子:10.5/Q1
发表时间:2025年4月
涉及组学:单倍型T2T基因组、比较基因组、GWAS、转录组、代谢组、FISH等。
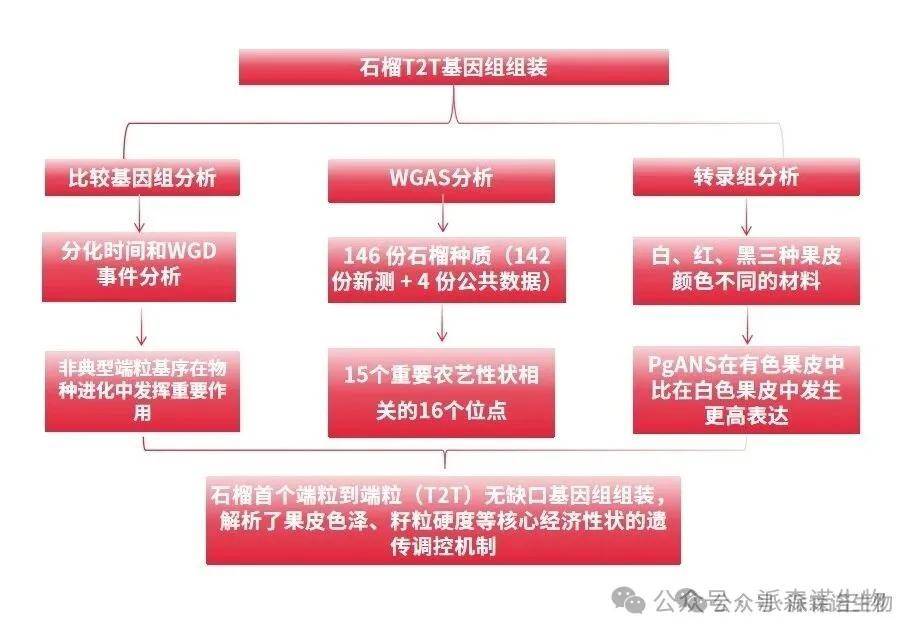
技术路线
摘 要
本研究完成了石榴特色品种“莫希柳”的端粒到端粒(T2T)无缺口基因组组装,总长度约366.71 Mb,包含32,158个预测基因,并完整解析了其非典型端粒序列(ttttaggg)及着丝粒结构。基于146个品系的GWAS分析,鉴定出16个与重要农艺性状相关的基因位点。功能研究表明:PgANS基因因37.2 kb染色体易位而功能丧失,导致花青素缺失;PgANR启动子区的重复扩展可能与黑色果皮形成相关;PgNST3基因的E56K突变(G→A)致使蛋白无法结合下游PgMYB46启动子,进而导致软籽性状,该机制在番茄过表达实验中得到验证。本研究为石榴功能基因组研究与分子育种提供了高质量的基因组资源和关键基因工具。
前 言
石榴(Punica granatum L.)原产伊朗等地,是全球重要的“超级食品”,兼具营养、药用、经济和观赏价值。其基因组小、幼年期短,是理想的多年生果树模式植物,但目前尚无完整的端粒到端粒(T2T)基因组。现有四个基因组组装仍存在缺口,且未完整构建着丝粒和端粒结构,相关基因挖掘与表达谱分析应用有限。果实颜色和种子硬度是石榴品质的关键性状。果皮颜色从白色到黑色(紫色)变化丰富,白色品种各组织均无花青素积累,而黑色品种花青素含量高。种子硬度由内种皮细胞壁厚度决定,软籽更受市场欢迎。现有研究表明花青素合成和木质素代谢相关基因表达与这两个性状相关,但关键基因组变异尚不明确。
本研究利用ONT、PacBio HiFi和Hi-C技术,结合146个品种的全基因组关联分析(GWAS),首次完成特色品种‘墨水莲’的T2T基因组组装,定位了15个重要农艺性状相关位点,并克隆验证了三个控制籽粒硬度和花青素合成的基因功能。研究结果为石榴分子育种提供了高质量基因组资源和早期选育标记,深化了对果实颜色与种子硬度形成机制的认识。
研究内容
1.基因组组装、验证和注释
本研究以黑皮石榴品种‘莫希柳’(2n=2x=16)为材料,构建了其端粒到端粒(T2T)参考基因组。综合利用PacBio HiFi(37.51 Gb, ~102×)、Oxford Nanopore(21.9 Gb, ~61×)和Hi-C(37.96 Gb, ~104×)测序数据,经过初步组装和Hi-C挂载,将98.53%的序列锚定到8条染色体上。随后利用ONT超长读长填补剩余缺口,最终获得一个总长为366.71 Mb、包含完整端粒和着丝粒的无缺口高质量基因组(图1a)。
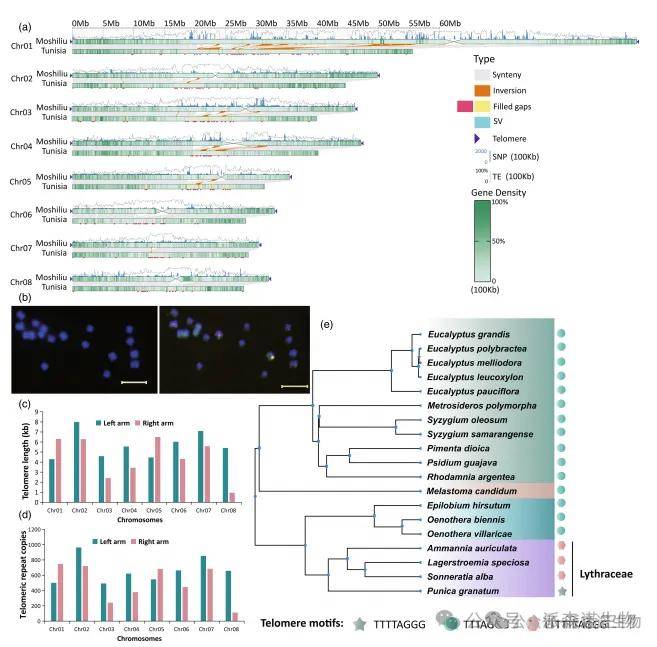
图1|无间隙基因组组装“Moshiliu”的全基因组景观及石榴中不寻常端粒基序的分析
2.组装的端粒、rDNA和卫星阵列的基因组结构
石榴的16个端粒均出现非典型基序ttttaggg(图1a),并存在T碱基插入,与其他植物的保守基序明显不同。FISH分析进一步验证了该重复序列(ttttaggg)n的分布特征(图1b)。端粒平均长度为5.1 kb(图1c),重复序列平均拷贝数为582(图1d)。茜草科其他物种(如白花茜草、重瓣木槿等)也检测到相同异常基序,而桃金娘科物种仍为典型tttaggg序列(图1e),提示该异常端粒可能对茜草科进化具有重要影响。
rDNA分析显示,石榴中5S rRNA由5S rDNA编码(图2a),18S、5.8S和28S rRNA来自45S转录本剪接(图2b)。FISH结果证实,染色体1和2上分别存在一个2.65 Mb的45S rDNA阵列(含约835个单元)和一个625.6 kb的5S rDNA阵列(含约2006个单元)(图2c–d)。两个阵列中分别检出195.8 kb和14.4 kb的转座元件。约33%的卫星重复定位于着丝粒,CL2和CL6为主要成分,占着丝粒区域70.7%(图2e)。根据其比例,可将着丝粒分为三类结构,部分染色体(如1、2、5等)的着丝粒几乎全部由CL2和CL6覆盖,而7号和4号染色体则分别主要由CL7和CL16构成(图2e)。
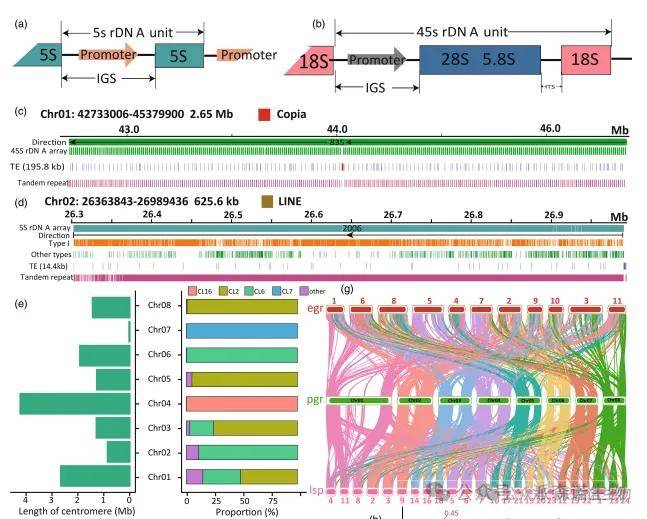
图2|石榴与其他植物物种的基因组结构及比较基因组学分析
3.石榴与其他植物物种的比较基因组分析
全基因组复制(WGD)事件在被子植物进化中具有重要作用。系统发育分析表明,石榴与白百合、斑叶百合等百合科物种的共同祖先,约在8378万年前与茄科、桃金娘科物种分化(图2f)。斑叶百合在分化后不久发生了全基因组三倍化事件(图2g, h),而石榴自身未检测到明显的近期WGD事件,该结论得到了4DTv分析(图S8)和共线性评估(图S9)的进一步支持。此外,长末端重复逆转录转座子(LTR-RTs)的插入时间分布也验证了这一进化时间线(图2i)。
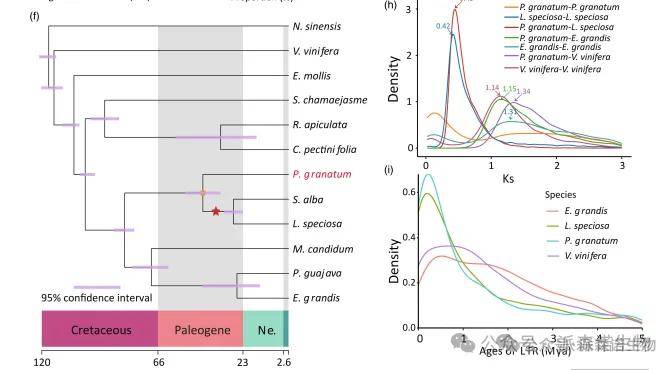
图3|石榴与其他植物物种的基因组结构及比较基因组学分析
4.146个广泛石榴接入体的变异图
研究人员对142个石榴品种进行基因组重测序,并整合4个已公开品种数据,共获得1.79 TB高质量数据(平均深度339×)。通过比对鉴定出115万个高质量SNP,基于此的系统发育分析将146个品种划分为六大类群,其地理来源分布清晰,该结果得到了群体结构和主成分分析的支持(图3a-c)。
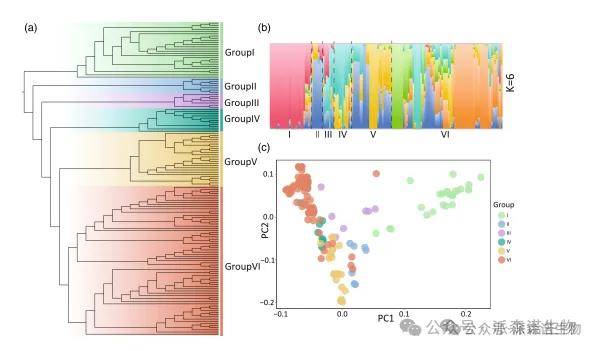
图4|146个石榴的系统发育关系和种群结构
5.15个重要农艺性状的GWAS
本研究对146份石榴材料的15个农艺性状进行了全基因组关联分析(GWAS),鉴定出16个显著关联位点。其中,一个与种子硬度相关的SNP(Chr01:87226201)和一个与白色果皮相关的SNP(Chr01:84728426)分别解释了100%和86.67%的表型变异。进一步研究发现,白色果皮表型与1号染色体上一个主效基因座显著相关。在该区间内,花青素合成酶基因PgANS(Pgr01G046260)在有色果皮中的表达显著高于白色果皮。序列分析表明,白色果皮品种的PgANS编码区存在一个37.2 kb的染色体易位,导致其表达几乎完全缺失。该易位在所有18个花青素缺陷型(白叶、白花、白果)品种中均被检测到,并通过PCR在11个白色品系中得到验证。
为验证PgANS功能,利用CRISPR/Cas9技术在红皮品种‘娜娜’中敲除该基因,获得两个突变体(Pgans-1和Pgans-2)。突变体植株叶片和茎秆的花青素积累显著减少,证实PgANS缺失导致花青素合成受阻。此外,在黑色果皮品种中,花青素还原酶基因PgANR的启动子区存在一个1056 bp的重复扩展结构变异,可能降低其表达水平,从而减少花青素向原花青素的转化,促使花青素积累,形成黑色果皮。
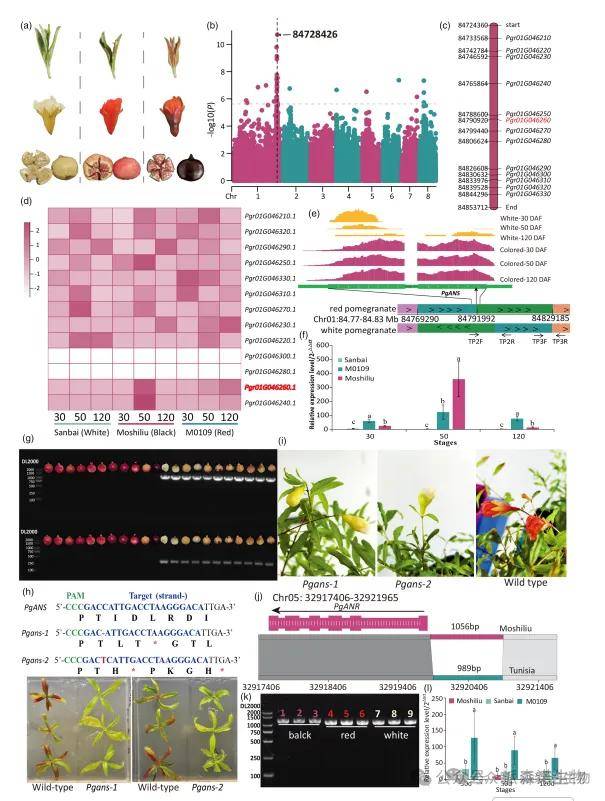
图5|破坏PgANS的独特的染色体易位导致石榴的白色果皮
6.PgNST3保守结构域中的非同义SNP变异会影响种子硬度
石榴种子硬度主要由内种皮厚度决定,软籽品种的内种皮显著薄于硬籽品种(图5a, b)。关键结构为内种皮中的厚壁细胞层(SCL),其细胞壁在果实发育30-50天期间增厚是硬籽形成的关键;硬籽品种此层持续增厚至120天,而软籽品种无此现象(图5c)。
遗传分析表明,软籽性状可能受单一隐性基因控制。GWAS在1号染色体上定位到一个与硬度相关的主效基因座(图5d)。其领先SNP位于基因Pgr01G048970内,该基因编码一个NAC结构域蛋白,与拟南芥中调控次生细胞壁增厚的AtNST3同源,故命名为PgNST3。一个关键的非同义突变(G→A)导致其DNA结合域发生E56K氨基酸替换,分别形成硬籽等位基因PgNST3G和软籽等位基因PgNST3A(图5e, 图S17)。对80个品种的测序验证显示,该SNP与表型完全共分离(图5f)。
表达分析显示,PgNST3在硬籽品种发育中的种皮内表达水平显著高于软籽品种,且其表达模式与种子硬度变化高度相关(图5g, h, i)。综合证据表明,PgNST3是调控石榴种子硬度的关键基因。
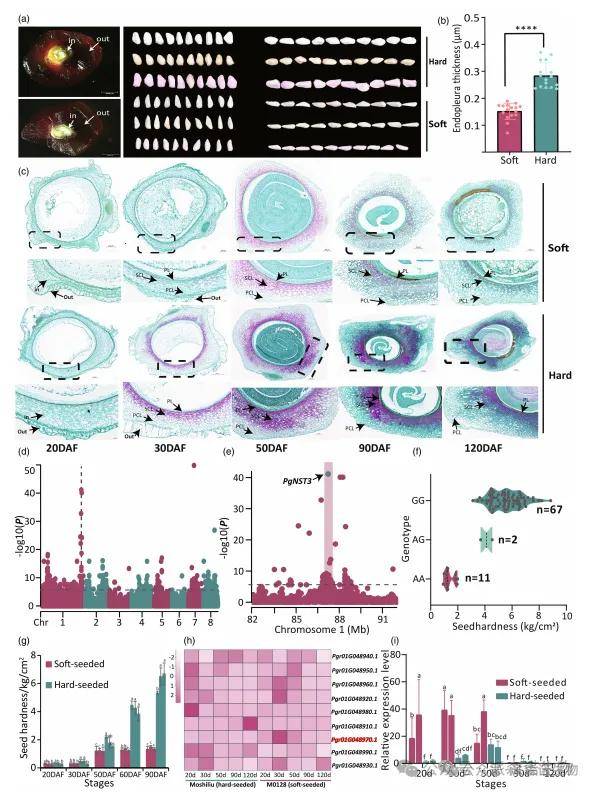
图6|种子硬度相关基因PgNST3
为验证PgNST3等位基因功能,我们在番茄中过表达了PgNST3G和PgNST3A。结果显示,过表达PgNST3A可导致种子种皮变薄、硬度显著降低(图6a-d),而过表达PgNST3G无显著表型(图S20)。分子机制研究表明,PgNST3G能直接结合并激活下游靶基因PgMYB46的启动子(图6f-h),而因关键SNP(G→A)产生的PgNST3A蛋白则丧失了此结合能力(图6h)。结论表明,该非同义突变通过削弱PgNST3A对PgMYB46的转录激活,最终导致软籽石榴内种皮变薄(图6i)。
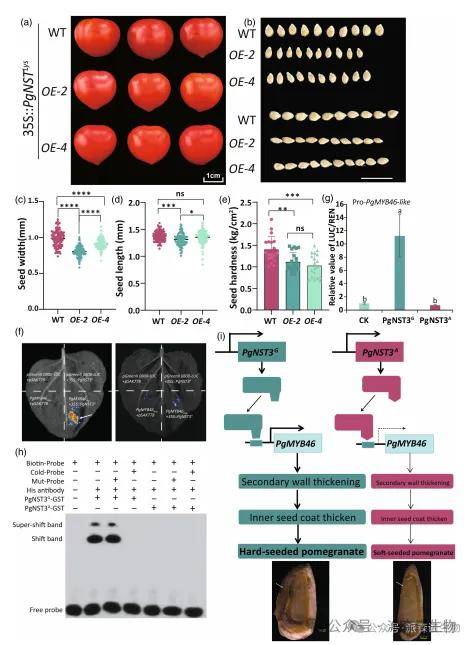
图7|PgNST3A基因的过表达会导致番茄种子变软。
总 结
本研究成功组装了石榴品种‘Moshiliu’的首个端粒到端粒(T2T)参考基因组,并综合多组学分析,揭示了由染色体易位、启动子扩增及关键基因突变所控制的果皮颜色与籽粒硬度等重要经济性状的遗传机制。研究进一步建立了CRISPR-Cas9基因编辑体系,为石榴功能基因组研究与分子育种奠定了坚实的资源基础和技术平台。
参考文献:Chen L, Wang H, Xu T, et al. A telomere-to-telomere gap-free assembly integrating multi-omics uncovers the genetic mechanism of fruit quality and important agronomic trait associations in pomegranate. Plant Biotechnol J. 2025 Jul;23(7):2852-2870. doi: 10.1111/pbi.70107.