
2025-10-31

一、前言
传统动物育种依赖表型选择与标记辅助育种,虽已取得显著成果,但受限于 “群体水平” 研究视角,难以精准解析育种关键经济性状(如高繁殖力、高产肉率、强抗病性)的细胞分子机制,导致育种效率提升瓶颈明显。单细胞测序(scRNA-seq)技术的成熟,为破解这一瓶颈提供了前所未有的强大工具。它允许我们在单个细胞的精度下,全面解析组织器官的细胞组成、基因表达状态和细胞间通讯网络,从而将育种研究从“遗传统计”推进至“细胞功能解析”的新阶段。通过构建肌肉、脂肪、乳腺、生殖腺等关键组织的细胞图谱,我们能够精准鉴定驱动性状形成的关键细胞亚群、揭示其分化发育轨迹、解析其调控网络,最终为分子设计育种提供具有明确功能指向性的新靶标,实现育种效率的跨越式提升。
二、研究目标
1.拟解决的科学问题
(1)细胞异质性:控制重要经济性状(如瘦肉率、产仔数)的核心组织中,存在哪些功能各异的细胞亚群?哪些稀有亚群是决定性状表现的关键?
(2)差异分析:在高性能个体中,这些关键细胞亚群开启了哪些特定的基因表达程序和信号通路?其细胞状态(如增殖、代谢、分化)有何特征?
(3)发育动态:这些细胞如何分化、发育而来?其命运决定的关键节点和调控因子是什么?
(4)互作网络:核心细胞(如肌细胞、卵母细胞)如何与微环境中的免疫细胞、基质细胞进行“对话”,共同协调性状的形成?
2.应用场景
应用场景 1: 解析肌肉发育与提升肉品质

图1. 野猪、莱芜猪和杜洛克猪骨骼肌来源细胞类型的基因表达模式差异较大[1]
应用场景 2: 提升繁殖性能
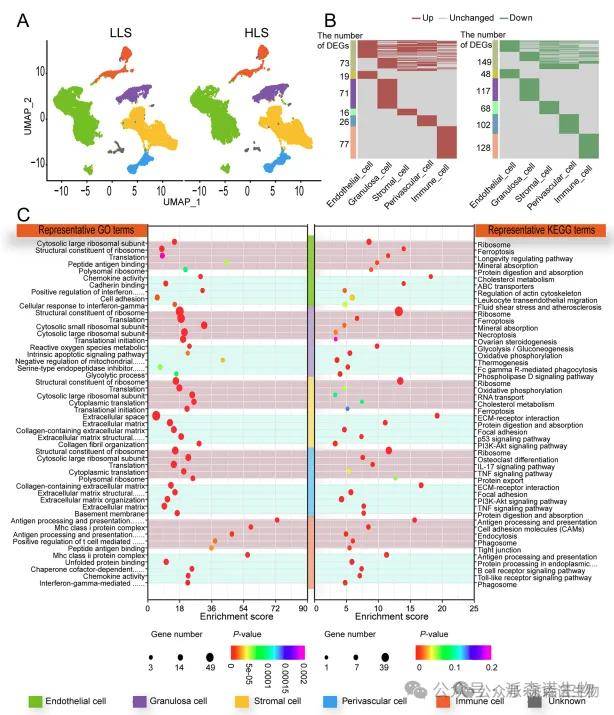
图2. 单细胞测序揭示了初产母羊和多次产仔母羊在生殖方面的差异[2]
应用场景 3: 优化泌乳性能与奶品质
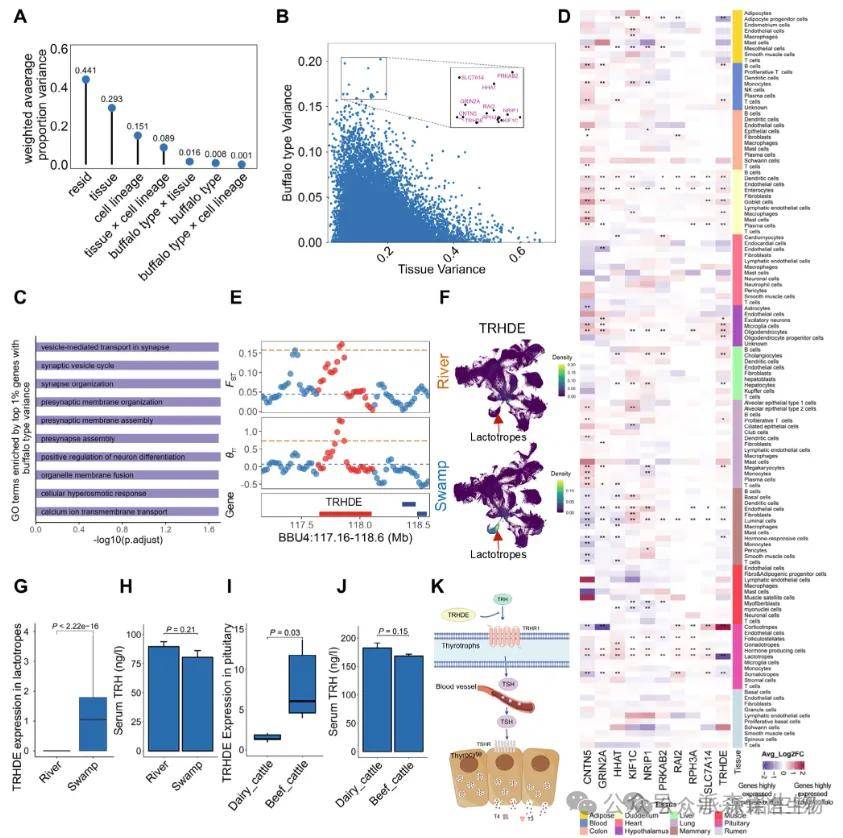
图3. 水牛体内TRHDE特异性下调与高产奶量有关[3]
应用场景 4: 抗病育种与免疫机制解析
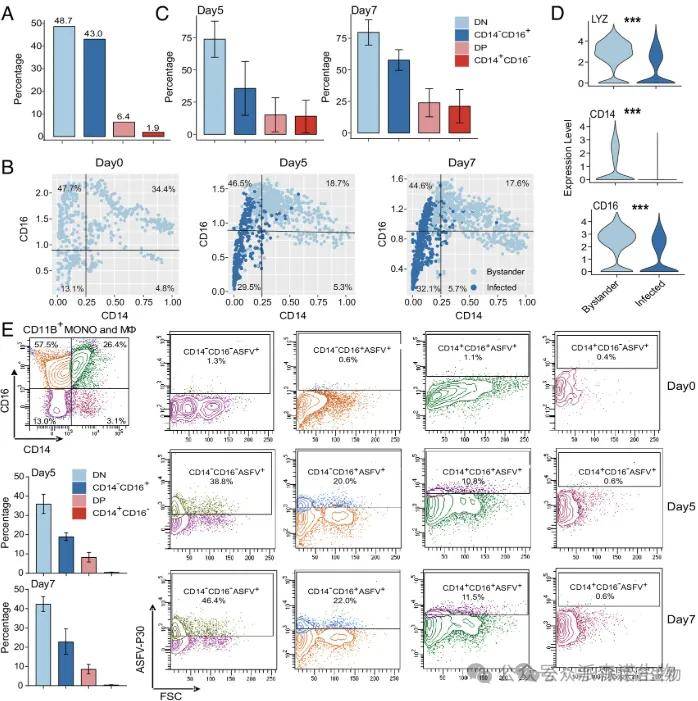
图4. 未成熟的单核细胞比常规单核细胞对非洲猪瘟病毒的感染更具耐受性[4]
三、研究思路与技术路线
1.课题设计
(1)横向设计:选取目标性状差异显著的动物群体,分为 “优系组” 与 “普通组”,横向对比解析固有性状差异的细胞基础。
①示例 1(绵羊繁殖):高繁殖力组(产仔数≥3,n=3)、低繁殖力组(产仔数=1,n=3)的卵巢组织。
②示例 2(猪抗病):耐受组(猪瘟病毒攻毒后存活且无临床症状,n=5)、敏感组(攻毒后发病或死亡,n=5)的肠道、脾脏、PBMC等。
(2)纵向设计:对同一动物个体,在育种关键阶段进行多次采样,纵向追踪细胞动态变化与性状的关联;或同一个动物个体取多组织样本构建动物多种组织的单细胞图谱,研究跨物种的保守型和特异性。
①示例 1(奶牛):采集 泌乳前期(产后 15 天)→泌乳高峰期(产后 90 天)→泌乳后期(产后 210 天)的乳腺组织、PBMC。
②示例 2(猪):采集断奶期(28 日龄)→育肥期(120 日龄)→抗病应激后(攻毒后 7 天)的肠道黏膜、PBMC。
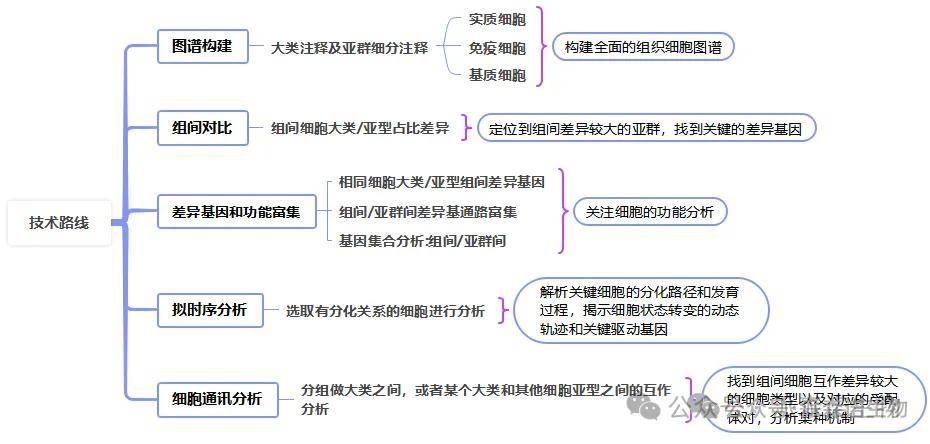
2.技术路线
(1)样本处理:制备高质量的单细胞悬液,针对不同组织类型(如纤维化的肌肉、脂肪含量高的组织)需优化不同的酶解消化方案和时间,并使用活细胞染料(如台盼蓝、DAPI)和自动细胞计数仪严格保证细胞活率(>85%)和浓度,以避免数据质量偏差。
(2)细胞捕获与测序:对捕获得到的高质量细胞进行单细胞RNA测序。
(3)生物信息学整合分析:利用先进算法整合多样本数据,挖掘差异细胞亚群、关键细胞功能、细胞亚群分化轨迹、细胞通讯分析。
四、研究重点分析方法和预期结果
1. 细胞聚类与亚群注释(单细胞图谱构建)
通过标记基因识别主要细胞类型,并进行亚群细分,绘制多组织的细胞组成图谱,发现新的、未知的细胞亚型。
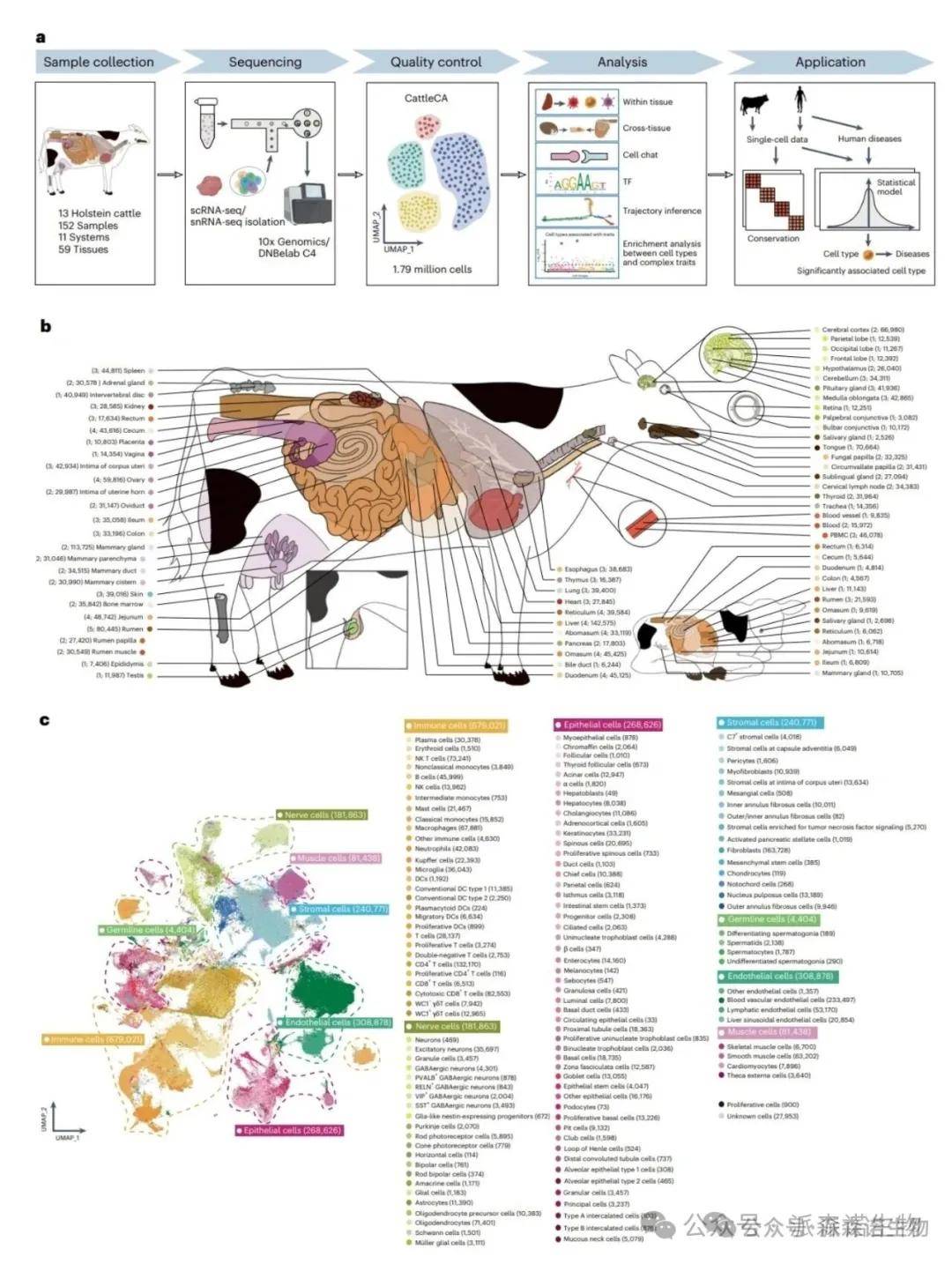
图5. 59种牛组织的单细胞转录图谱[5]
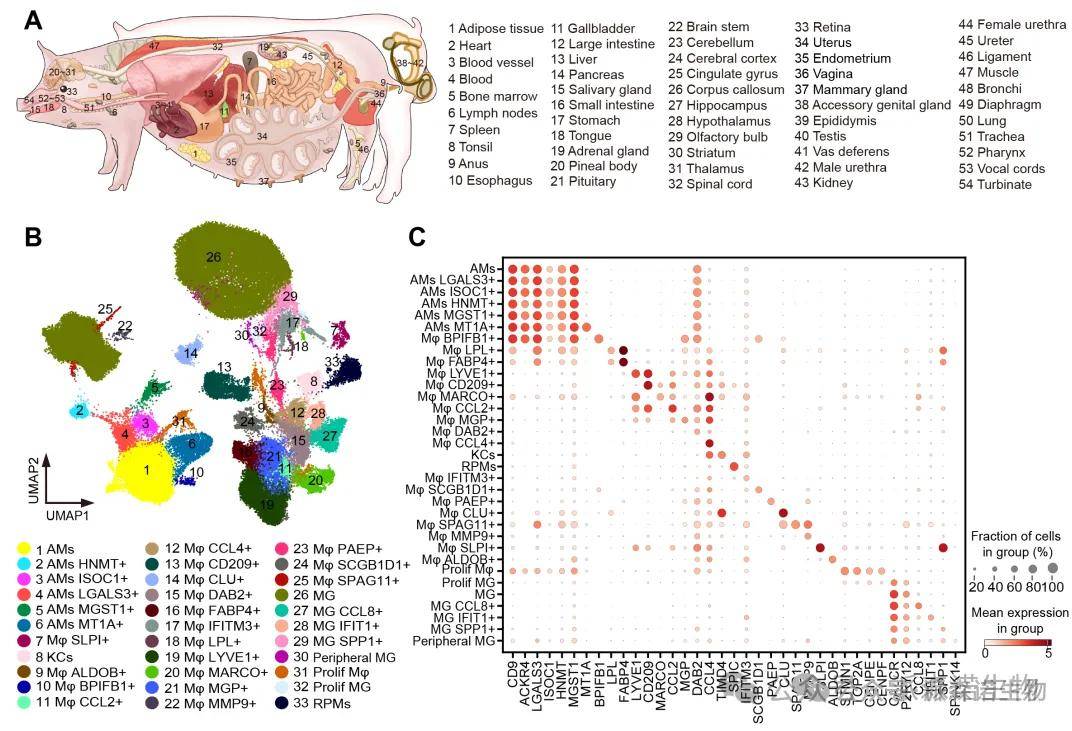
图6. 单个猪体内的 49 块组织进行单细胞转录组分析[6]
2. 差异表达及功能富集分析(关键细胞鉴定)
比较不同组间(如不同品种、不同处理、不同细胞亚型)的基因表达差异,对差异基因进行通路富集分析,解释其生物学功能。精确锁定与目标性状最相关的细胞亚群,如与高产奶量相关的乳腺上皮细胞亚群。这些细胞特异性表达的基因可以作为分子育种标记的候选位点,用于早期选种。
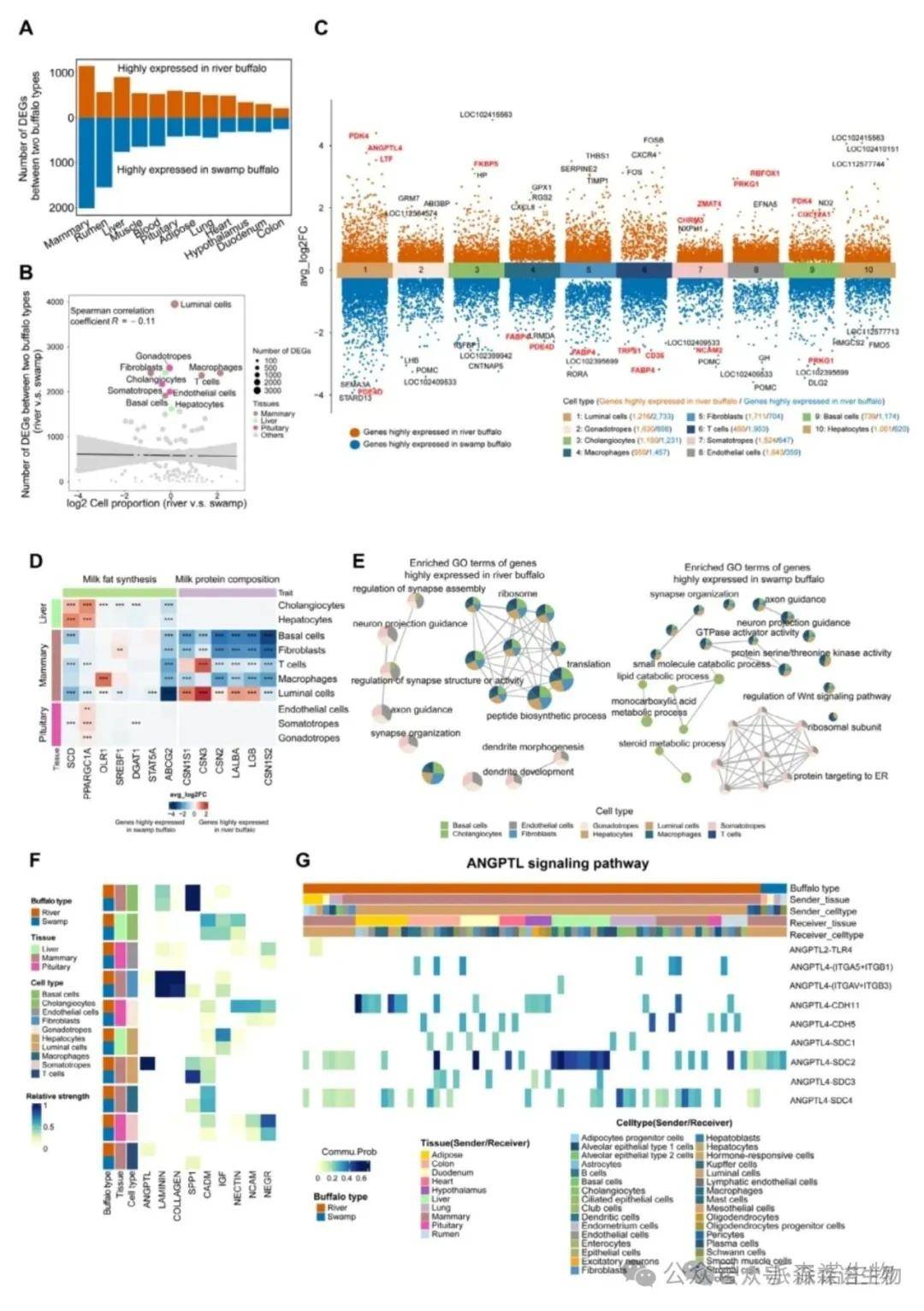
图7. 河流型水牛乳腺腔细胞中,多数乳蛋白基因(如CSN1S1、LALBA)高表达,表明它们在泌乳中发挥重要作用[3]
3. 拟时序分析(动态过程解析)
解析关键细胞的分化路径和发育过程,揭示细胞状态转变的动态轨迹和关键驱动基因。如研究发现猪鼻黏膜细胞组成、分化轨迹与人类高度保守,揭示了猪病毒易感性的原因和机制。
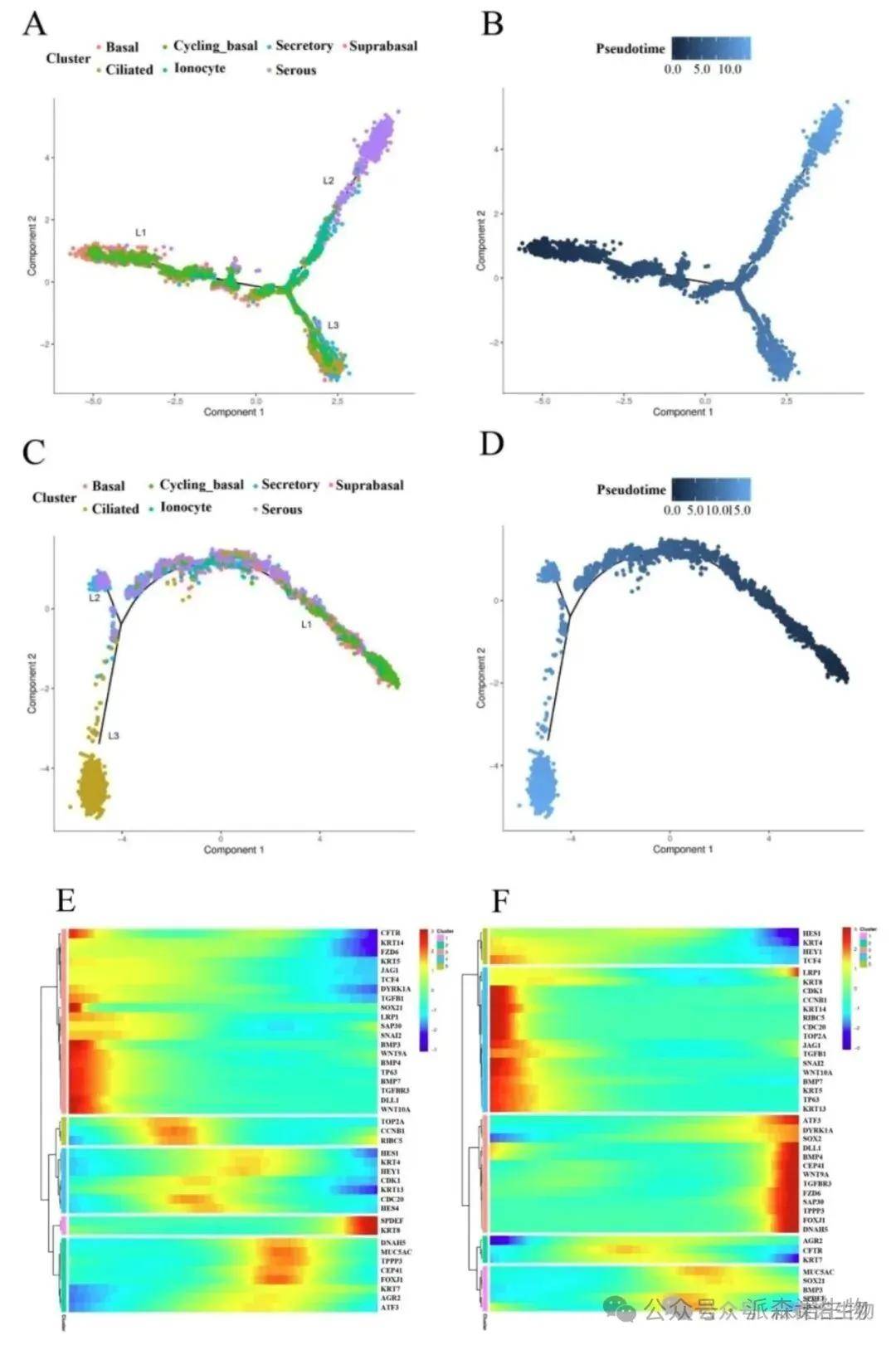
图8. 猪与人鼻上皮细胞的分化轨迹,关键转录因子(如JAG1、TGFB1)在早期分化阶段高表达,保守调控分化过程[7]
4. 细胞通讯分析(细胞间互作关系解密)
预测不同细胞类型之间通过配体-受体对发生的相互作用,可以解析不同细胞类型之间的对话机制。单细胞分析发现绵羊泌乳过程中肌上皮细胞和成纤维细胞在细胞外基质重塑和细胞分化中起着关键作用。关键的信号通路,包括 FGF和NCAM,被发现介导了肌上皮细胞和基质细胞之间的相互作用,影响着乳腺的结构。
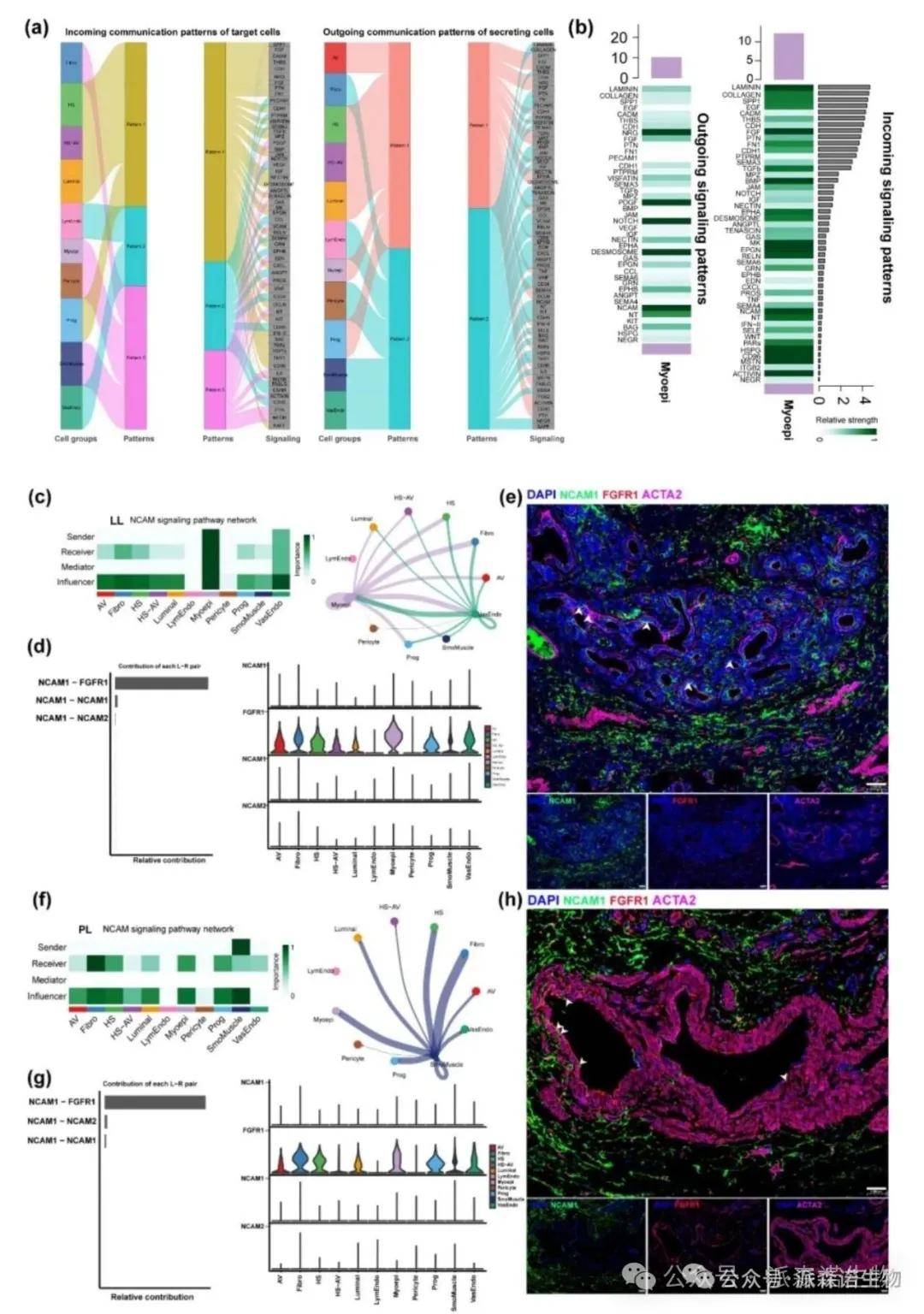
图9. NCAM信号通路在晚期哺乳期的肌上皮细胞中比在早期哺乳期更活跃[8]
5. 跨物种保守性分析
通过比较不同物种(如猪、人、小鼠)中相同细胞类型的基因表达谱,可以判断哪些细胞类型、基因模块或功能通路是进化上保守性和特异性。在资源允许的情况下,进行跨物种比较能显著增强研究的说服力和影响力。
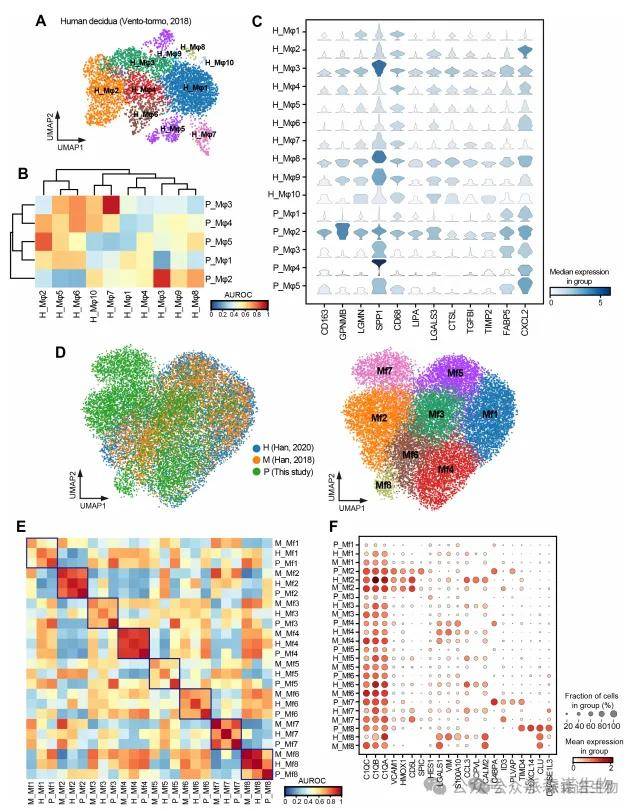
图10. 猪、人、鼠巨噬细胞的跨物种比较[6]
6. 验证关键发现
利用如H&E染色和免疫荧光染色等方法验证单细胞分析得到的预测结果,从蛋白质水平证实scRNA-seq分析发现的分子机制。
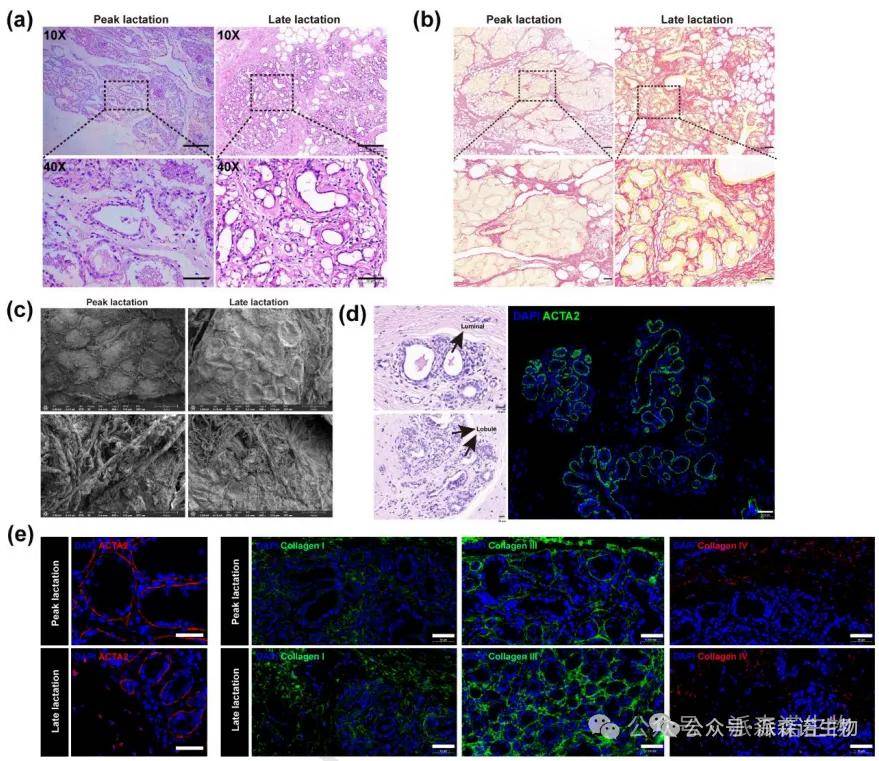
图 11. 乳腺中胶原纤维在妊娠期(PL)和绝经后(LL)的结构重组情况[8]
五、参考文献
[1] Xu D, Wan B, Qiu K, Wang Y, Zhang X, Jiao N, Yan E, Wu J, Yu R, Gao S, Du M, Liu C, Li M, Fan G, Yin J. Single-Cell RNA-Sequencing Provides Insight into Skeletal Muscle Evolution during the Selection of Muscle Characteristics. Adv Sci (Weinh). 2023 Dec;10(35):e2305080.
[2] Ge T, Wen Y, Li B, Huang X, Jiang S, Zhang E. Single-cell sequencing reveals the reproductive variations between primiparous and multiparous Hu ewes. J Anim Sci Biotechnol. 2023 Nov 14;14(1):144.
[3] Dai D, Si J, Jiang L, Han B, Wang K, Wang X, Yan S, Yin Y, Chen W, Mao H, Pauciullo A, Li ST, Fang L, Zhang Y. Comparative Single-Cell Transcriptomic Landscape Reveals the Regulatory Mechanisms of Lactation during Selective Breeding in Asian Water Buffalo. Adv Sci (Weinh). 2025 Jul 11:e08847.
[4] Zhu Z, Mao R, Liu B, Liu H, Shi Z, Zhang K, Liu H, Zhang D, Liu J, Zhao Z, Li K, Yang F, Cao W, Zhang X, Shen C, Sun D, Wang L, Tian H, Ru Y, Feng T, He J, Guo J, Zhang K, Tang Z, Zhang S, Ding C, Han J, Zheng H. Single-cell profiling of African swine fever virus disease in the pig spleen reveals viral and host dynamics. Proc Natl Acad Sci U S A. 2024 Mar 5;121(10):e2312150121.
[5] Han B, Li H, Zheng W, Zhang Q, Chen A, Zhu S, Shi T, Wang F, Zou D, Song Y, Ye W, Du A, Fu Y, Jia M, Bai Z, Yuan Z, Liu W, Tuo W, Hope JC, MacHugh DE, O'Grady JF, Madsen O, Sahana G, Luo Y, Lin L, Li C, Cai Z, Li B, Huang J, Liu L, Zhang Z, Ma Z, Hou Y, Liu GE, Jiang Y, Sun HZ, Fang L, Sun D. A multi-tissue single-cell expression atlas in cattle. Nat Genet. 2025 Sep 5.
[6] Chen X, Lai C, Cai L, Huang L. Cross one single body 49 tissues single-cell transcriptome reveals detailed macrophage heterogeneity during pig pregnancy. Front Immunol. 2025 Apr 2;16:1574120.
[7] Wang W, Liu R, Zhong Q, Cao Y, Qi J, Li Y, Yang Q. Single-cell analysis of nasal epithelial cell development in domestic pigs. Vet Res. 2024 Oct 30;55(1):140.
[8] Liu S, Cao H, Wang Z, Zhu J, An X, Zhang L, Song Y. Single-cell transcriptomics reveals extracellular matrix remodeling and collagen dynamics during lactation in sheep mammary gland. Int J Biol Macromol. 2025 Jun;312:143669.