2019-08-20
超实用干货!如何设计qPCR引物来验证lncRNA测序结果!
在近十余年的生命科学研究中非编码RNA可谓是火的研究领域之一,从2006年获得诺贝尔医学奖的siRNA干扰技术,到近几年异常火爆的microRNA,再到转录调控研究蓝海的lncRNA,可谓如火如荼。长非编码RNA(Long non-coding RNA,lncRNA)是一类长度大于200个核苷酸的非编码RNA。
与其他非编码RNA不同,lncRNA可以折叠成复杂的二级结构或更高级结构,有更大的潜能识别蛋白质和靶标。近些年的文献研究表明,lncRNA参与X染色体沉默,基因组印记以及染色质修饰,转录激活,转录干扰,核内运输等多种重要的调控过程。
目前lncRNA根据其在基因组上相对于蛋白编码基因的位置可以分为五类:antisense lncRNA, overlapping lncRNA, large intergenic noncoding RNA (linc RNA), intronic lncRNA和exonic lncRNA。
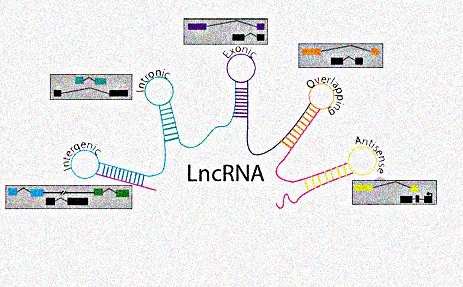
图源网络侵删
在细胞核内的lncRNAs,它们的作用主要是通过引导染色质修饰蛋白(eg.多梳抑制复合物PRC2, 组蛋白甲基转移酶H3K9)到特定的基因组位点。根据目标位点的不同分为cis-acting lncRNAs和trans-acting lncRNAs。cis-acting lncRNAs控制在它们转录位点附近或者同一染色体上长距离的基因的表达。然而trans-acting lncRNAs可以抑制或激活独立位点的基因表达。尽管目前科研人员提出不同的识别机制,但是这两种lncRNAs的作用定位机制仍然没有被完全解释,尤其是关于cis-acting lncRNAs如何保持它们的转录位点和trans-acting lncRNAs如何找到远距离的目标位点。
同时,许多lncRNAs介导的基因调控机制在细胞质中被发现。在细胞质内的lncRNAs,它们的序列与来自同一染色体位点或独立位点的转录本互补。它们通过互补配对来识别目标位点,从而也能调控蛋白质的翻译过程。同样,lncRNAs能增强和降低目标mRNA的稳定性。另一种特殊的lncRNA作用方式是作为竞争性内源RNA(ceRNAs),通过结合或隔离miRNAs来防止目标mRNA的抑制。这代表了一种新的RNA调控回路,不同类型的RNA(编码和非编码)都可以相互交流通过竞争共享的miRNAs。
LncRNA的应用
目前,越来越多关于lncRNA研究的文献出现在Nature、Science、Cell等顶级学术期刊上,研究内容也涉及多个领域,如肿瘤发生,细胞分化,全能性等。越来越多的研究者开始关注lncRNA在生命活动中的重要作用,借助lncRNA高通量测序技术,未来在各领域会有更多的lncRNA调控机制被深入全面地解析。
LncRNA测序技术
LncRNA测序是研究有参考基因组物种的特定组织或细胞在某个特定时期转录出的所有lncRNA和mRNA,所以lncRNA测序既包含对lncRNA的分析也包含了对mRNA的分析。LncRNA测序要满足的两个必要条件:1)必须有参考基因组,常见的包括人、小鼠、猪、拟南芥、玉米等;2)有相应的核糖体去除试剂盒。因为lncRNA建库采用去核糖体建库方式,文库中会包含lncRNA,mRNA和其他RNA,所以推荐12G的clean data/样品,如果希望通过lncRNA测序数据分析circRNA,则需要更多的数据量15-20G。派森诺有专业的实验人员,严格的质量检控,确保我们的数据真实可靠,为您提供优质的测序服务。
分析结果展示图
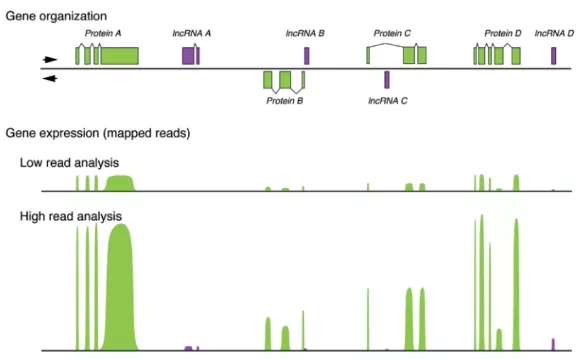
图1:IGV显示的基因结构及表达图
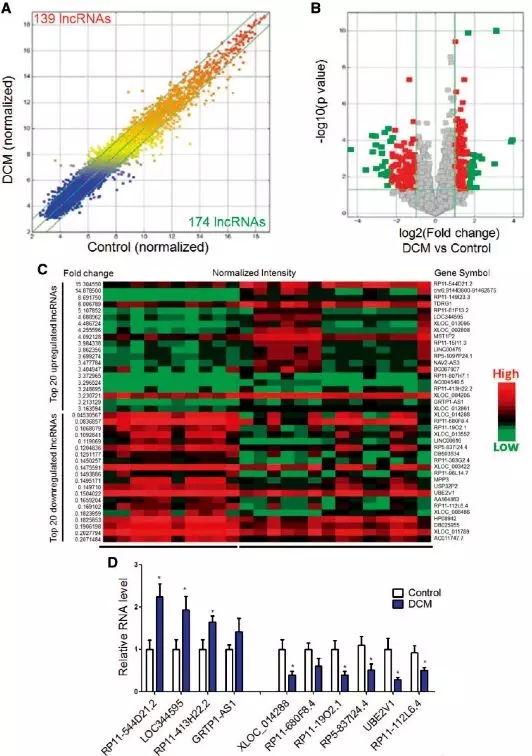
图2:表达量分布图
图3:lncRNA和miRNA的联合分析
lncRNA测序后的qPCR验证
在做完测序之后,大家都会用RT-qPCR来验证测序结果的可靠性。但是很多人会对这些问题有困扰,选哪个lncRNA?变化倍数大的?表达量高的?选lncRNA的哪段设计引物?其它基因有重叠怎么办?下面我们就来为大家梳理一下做qPCR定量实验来验证lncRNA测序的几个关键点:
1. 用和测序同一批次的RNA样品做RT-qPCR,最好是同一管RNA(如果是由公司提取RNA,可以返样);如果要重提,则要用和测序样品同一批次的细胞或同一块组织。
2. 最好选择基因间的lncRNA, 其次选择位于其他基因intron区域的lncRNA,不能选与其他基因exon重叠的lncRNA,否则,RT-qPCR结果就混合了两个基因的表达量,从而导致实验误差较大。
3. 表达量高的lncRNA优于表达量低的lncRNA,更容易做RT-qPCR,Ct值更低,结果更可靠。
4. RNA-seq计算lncRNA表达量和筛选差异基因时,用的是lncRNA全长reads count的总和,不代表每个区段都有表达或表达差异。因此,我们选择在组间有显著表达差异的lncRNA,利用IGV程序可以看到哪个区段表达量峰高,从而针对这个区段进行引物设计做qPCR,能保证万无一失。
最后,由于测序和RT-qPCR是两种技术平台它们的原理也不同,所以RNA-Seq和RT-qPCR计算出来的变化倍数不可比,只要变化趋势相同就算结果一致。


