2020-04-29
“胆管癌(Cholangiocarcinoma,CCA)是一种罕见但致死率极高的恶性肿瘤,往往在诊断时已经处于晚期而失去手术的机会。晚期胆管癌的治疗选择有限,吉西他滨联合顺铂是目前标准的一线治疗方案,但疗效有限且不良反应比较明显,至今尚无推荐的二线治疗方案。”
那么,胆管癌患者在一线化疗后没有其他好的治疗选择时怎么办?
不用紧张,在胆管癌中,有近40%的患者存在潜在的可靶向性的基因突变,具有靶向治疗的可能,比如FGFR2基因融合或重排,使用靶向治疗后的总体受益风险评估是有利的。¹
2020年4月17日,美国FDA加速批准选择性口服FGFR1/2/3抑制剂 Pemazyre(pemigatinib)上市,用于先前治疗过的携带 FGFR2 基因融合或其它重排类型的局部晚期(未扩散)或转移性(已扩散)胆管癌成人患者,这也是FDA批准的首个用于胆管癌患者的靶向药物。²

▲ FDA批准首个用于胆管癌患者的靶向疗法
在胆管癌中,FGFR2基因融合的整体发生率约为 9%~14%,在肝内胆管癌中发生率更高,可达45%。³ pemigatinib是一种选择性口服FGFR1/2/3抑制剂,通过阻断肿瘤细胞中FGFR2介导的信号通路来阻止肿瘤细胞生长和扩散。
Pemazyre的批准上市是基于一项开放标签,单臂II期 FIGHT-202 的试验结果,此研究结果于2020年3月20日发表于《The Lancet Oncology》。⁴
FIGHT-202试验入组条件为至少接受过1次治疗后出现疾病进展的胆管癌成人患者。试验将患者分为三组,A组包括107例FGFR2基因融合/重排的患者,B组包括20例具有其他其他FGF/FGFR基因突变的患者,C组组包括18例无FGF/FGFR基因突变的患者,所有患者均接受口服Pemigatinib 13.5 mg QD治疗(服药2周,停药1周),直到疾病进展或出现不可耐受毒性。
试验结果显示,在17.8个月的中位随访中,携带FGFR2基因融合或重排的A组患者中,pemigatinib的单药治疗使患者达到35.5%的客观缓解率(ORR);中位持续缓解时间(DOR)达到7.5个月。
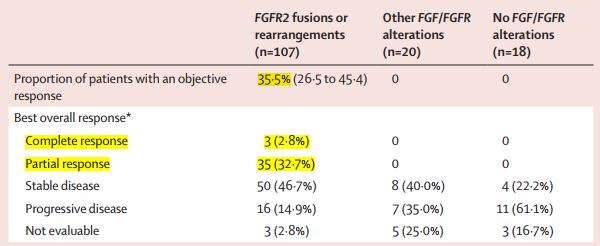
▲ FIGHT-202试验A,B,C三组ORR情况
中位总生存期(OS)为21.1个月(数据截止时,OS尚不成熟,14.8~未达到),相反,在B组和C组中则为6.7个月和4.0个月。
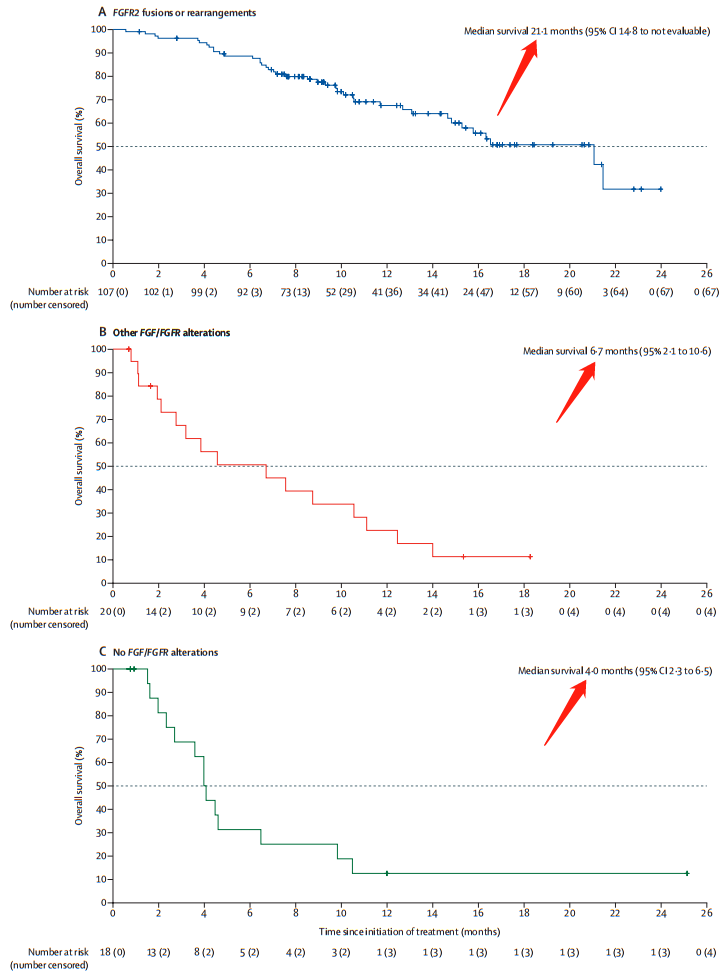
▲ FIGHT-202试验A,B,C三组OS情况
与此同时,FDA已批准基于NGS检测平台的FoundationOne® CDx (F1CDx)作为 pemigatinib 的伴随诊断产品,F1CDx的测序广度和深度将有助于识别受益于pemigatinib治疗的FGFR2融合或重排的胆管癌患者。F1CDx是第一个也是唯一一个经FDA批准用于FGFR2+胆管癌首个靶向药物pemigatinib的伴随诊断产品。⁵
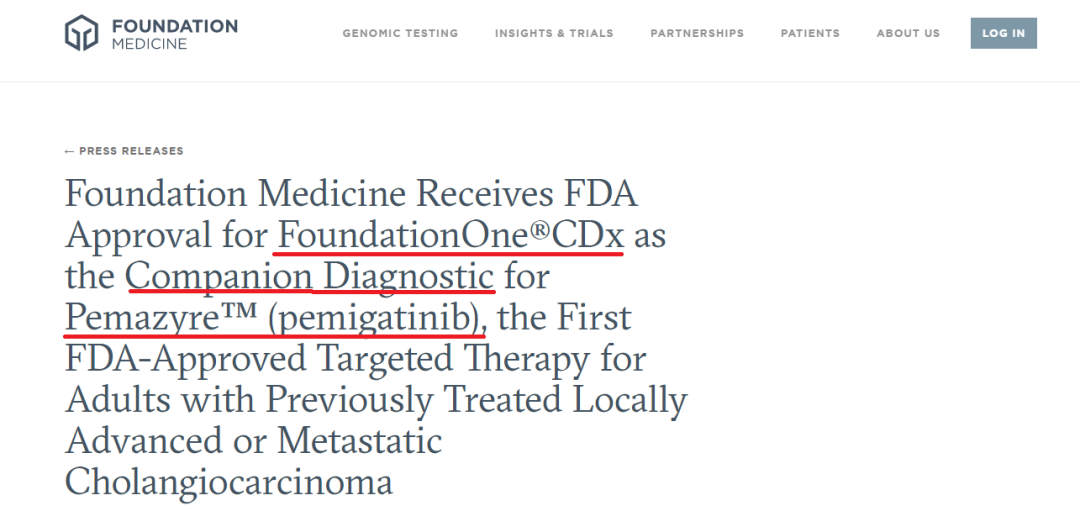
▲FMI官网:FDA已批准F1CDx作为pemigatinib伴随诊断
在2020年3月20日发表于《The Lancet Oncology》的文章中⁴,研究者们强调:鉴于胆管癌的分子多样性,此研究结果强调应将 DNA-NGS 或 RNA-NGS 检测分析方法作为 FGFR2基因融合/重排 的标准方法,检测 FGFR2基因已知、新发融合或重排类型,从而识别出所有可能受益于 FGFR-靶向治疗方法的胆管癌患者。因此,更推荐用NGS方法来检测FGFR2的变异情况。

▲ DNA/RNA-NGS应作为FGFR2基因融合/重排标准方法
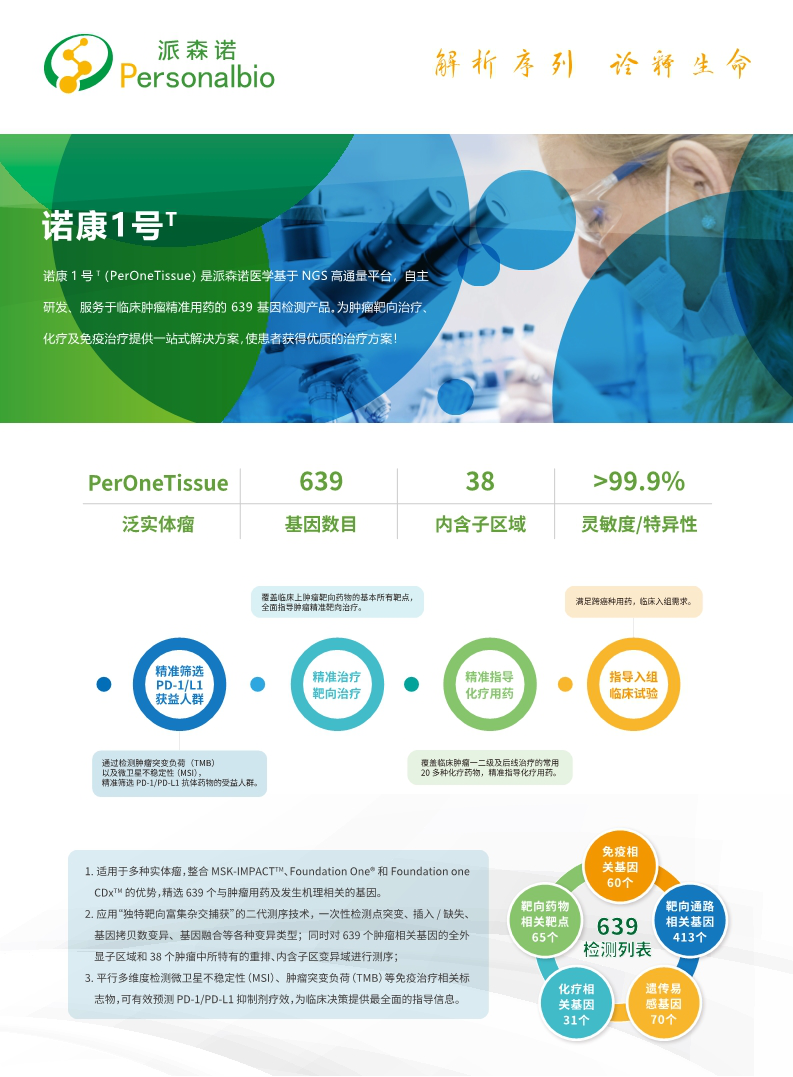
目前,派森诺医学基于NGS平台(Illumina)和自主研发的高效率杂交捕获技术开发出了一系列针对泛实体瘤的NGS Panel,包括 NGS 78基因(血液/组织),447基因(血液)及639基因(组织)产品,覆盖所有靶向用药、化疗药物敏感性及毒性、免疫通路和肿瘤遗传易感相关基因的位点信息。
NGS泛实体瘤 panel 包括 FGFR1/2/3基因全部外显子和部分内含子区域,可有效检出 FGFR2 基因融合或其它重排类型,助力胆管癌患者制定个体化精准治疗方案。
参考资料:
1.Nakamura, H. et al.Genomic spectra of biliary tract cancer. Nat. Genet. 47, 1003–1010 (2015).
2.https://www.fda.gov/news-events/press-announcements/fda-approves-first-targeted-treatment-patients-cholangiocarcinoma-cancer-bile-ducts
3.Katoh Masaru,Fibroblast growth factor receptors as treatment targets in clinical oncology.[J] .Nat Rev Clin Oncol, 2019, 16: 105-122.
4. Abou-Alfa Ghassan K,Sahai Vaibhav,Hollebecque Antoine et al. Pemigatinib for previously treated, locally advanced or metastatic cholangiocarcinoma: a multicentre, open-label, phase 2 study.[J] .Lancet Oncol., 2020, undefined: undefined.
5.Foundation Medicine Receives FDA Approval for FoundationOne®CDx as the Companion Diagnostic for Pemazyre™ (pemigatinib), the First FDA-Approved Targeted Therapy for Adults with Previously Treated Locally Advanced or Metastatic Cholangiocarcinoma. Posted April 20, 2020. https://bit.ly/3aqhNZx. Accessed April 20, 2020.


