
2020-06-30
三十而立,在短短的三十几年里,经历从无到有,从质疑到认可,从寂寂无名到炙手可热,CRISPR-Cas技术可以说是目前生命科学领域发展迅速的技术了。
它究竟是怎么回事?
是怎么一步一步发展起来的?
为什么这么火?到底怎么用呢?
今天小编就给大家简单的科普一下。
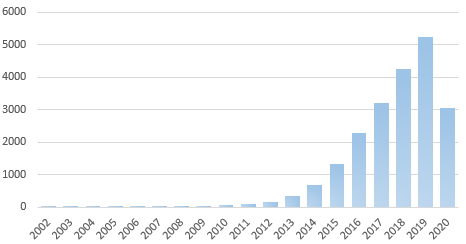
图1 历年CRISPR相关文献统计
基因编辑技术是一种能够对生物体的基因组及转录产物进行定点修饰或者修改的技术,早期基因编辑技术包括归巢内切酶(homing endonuclease, HEs)、锌指核酸内切酶(zinc finger endonuclease, ZFN)和类转录激活因子效应物(transcription activator-like effector nucleases, TALENs),但脱靶效应和组装复杂性限制了这些技术在基因编辑领域的应用。CRISPR-Cas9(Clustered Regularly Interspaced Short Palindromic Repeats/CRISPR-associated proteins)系统最初在大肠杆菌基因组中被发现,是细菌中抵抗外源病毒的免疫系统。CRISPR-Cas9系统由两部分组成,一部分是用来识别靶基因组,长度为20bp左右的sgRNA序列,另外一部分是存在于CRISPR位点附近的双链DNA核酸酶——Cas9,能在sgRNA的引导下对靶位点进行切割,最终通过细胞内的非同源性末端连接机制(NHEJ)和同源重组修复机制(HDR)对形成断裂的DNA进行修复,从而形成基因的敲除和插入,最终实现基因的(定向)编辑。
与前两代技术相比,凭借着成本低廉,操作方便,效率高等优点,CRISPR/Cas9迅速风靡全球的实验室,成为了生物科研的有力帮手。CRISPR-Cas9技术最大的突破是不仅可以对单个基因进行编辑,更重要的是可以同时对多个基因进行编辑,这也为全基因组筛选提供了有效的方法。
CRISPR簇是一个广泛存在于细菌和古生菌基因组中的特殊DNA重复序列家族,充当了防御外源遗传物质的“基因武器”。CRISPR是—成簇的规律间隔的短回文重复序列,分布在40%的已测序细菌和90%的已测序古菌当中。图2展示了完整的CRISPR位点的结构。其中,CRISPR序列由众多短而保守的重复序列区(repeat)和间隔区(spacer)组成。重复序列区含有回文序列,可以形成发卡结构。而间隔区比较特殊,它们是被细菌俘获的外源DNA序列。这就相当于细菌免疫系统的“黑名单”,当这些外源遗传物质再次入侵时,CRISPR/Cas系统就会予以精确打击。而在上游的前导区(leader)被认为是CRISPR序列的启动子。另外,在上游还有一个多态性的家族基因,该基因编码的蛋白均可与CRISPR序列区域共同发生作用。因此,该基因被命名为CRISPR关联基因(CRISPR associated,Cas)。目前已经发现了Cas1-Cas13等多种类型的Cas基因。Cas基因与CRISPR序列共同进化,形成了在细菌中高度保守的CRISPR/Cas系统。
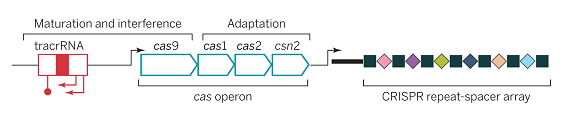
图2 CRISPR位点结构图
CRISPR/Cas9系统的工作原理可以概括为以下几步:
1、外源DNA俘获并添加到基因组的CRISPR序列之中。
2、CRISPR座位转录形成前体crRNA(crisprRNA);
3、Pre-crRNA经过剪接形成成熟的crRNA;
4、crRNA、tracrRNA与Cas蛋白结合,引导Cas蛋白到达目标区域;
5、Cas蛋白剪切目标片段,形成双链断裂(DSB);
6、细胞的修复机制启动,修复DNA,引入突变。
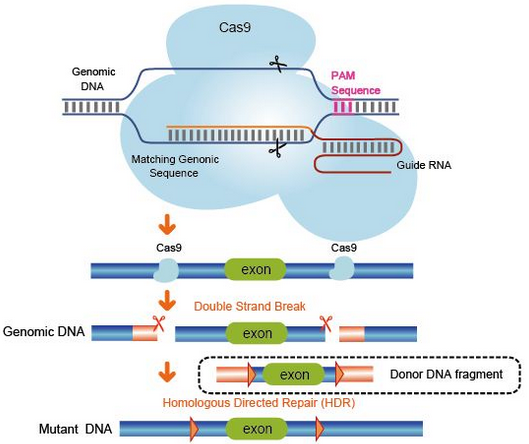
图3 CRISPR工作原理图
当sgRNA靶向单基因时,CRISPR可视为一种高效的基因编辑工具。但当sgRNA靶向全基因组序列时,CRISPR便升级为一种全基因组筛选的工具。基于CRISPR/Cas9筛选的一般流程如下(图4):
1、构建靶向全基因组的基因敲除文库(genome-scale CRISPR-Cas9 knockout, GeCKO)或激活基因sgRNA文库;
2、包装慢病毒文库;
3、以低MOI感染细胞,使sgRNA整合到细胞基因组上,随基因组DNA的复制而复制;
4、用抗生素筛选出感染病毒的细胞;
5、根据表型(耐药性、增殖能力、存活能力、标记基因等)选择细胞;
6、提取细胞核基因组;
7、建库,进行二代测序;
8、利用生物信息学分析获得目的基因。
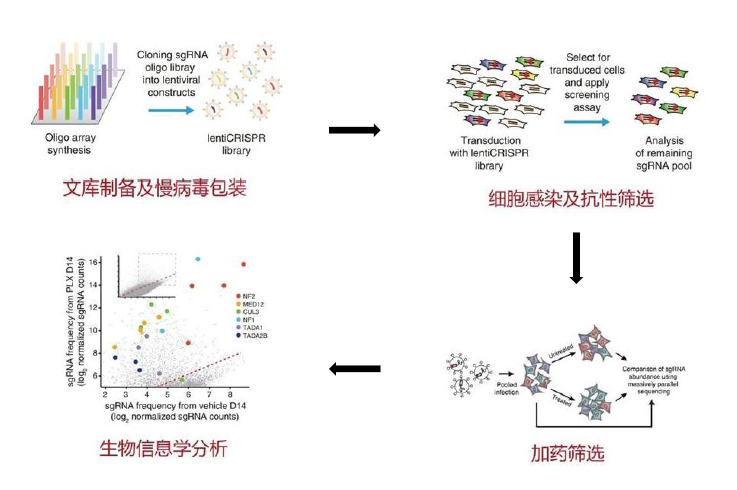
图4 sgRNA文库筛选流程图
1、药物靶点确定与验证
CRISPR-Cas9筛选技术可以应用于药物靶点筛选中,通过大规模筛选技术,可以系统的分析、验证一些与抗药性相关的基因,从而为疾病治疗提供相关数据。美国加州大学圣地亚哥分校的研究人员在国际顶尖学术期刊Nature子刊Nature Cancer期刊上发表的题为“An in vivo genome-wide CRISPR screen identifies the RNA-binding protein Staufen2 as a key regulator of myeloid leukemia”的研究论文,研究人员使用CRISPR技术在白血病细胞中进行全基因组筛选,并识别出了侵袭性慢性髓系白血病的关键调节因子——Staufen2,该分子或可成为治疗慢粒白血病的新靶点。

2、基因环路上下游调控机制分析
CRISPR-Cas9文库筛选技术不仅可以用于编辑人类细胞蛋白编码基因,对于基因组中的调控元件也同样有效,利用这种方法可以对基因环路上游有调控机制进行分析。在Nature上发表题为“CRISPR screen in regulatory T cells reveals modulators of Foxp3”的文章,通过在小鼠Treg细胞中进行CRISPR筛选,发现了新的影响Treg中Foxp3蛋白稳定性的调控因子Usp22和Rnf20,并阐述了其中机制。

3、代谢通路调节机制分析
CRISPR-Cas9技术在人体代谢调控中也有相关成果。来自美国哈佛大学医学院、霍华德休斯医学研究所、Broad研究所及麻省总医院Vamsi Mootha实验室的研究人员在Cell杂志上在线发表了题为“Genetic screen for Cell Fitness in High or Low Oxygen Highlights Mitochondrial and Lipid Metabolism”的研究论文,通过CRISPR筛选技术,系统鉴定了人体基因和通路水平对高低氧环境(即21%、5%及1%O2)的细胞健康(cell fitness)水平的变化,揭示了参与氧感受、代谢的基因及通路。

4、Long noncoding RNA作用机制分析
CRISPR-Cas9文库的建立可以实现基因组的大规模筛选,为了对非编码基因的功能进行验证,Nature biotechnology发表文章“Genome-scale deletion screening of human long non-coding RNAs using a paired-guide RNA CRISPR-Cas9 library”提出构建了psgRNAs文库的方法,这种成对的sgRNA可在同一基因中造成两处断裂,形成大片段缺失,从而影响表型变化,成为研究非编码基因的重要方法。使用慢病毒psgRNA文库,对人源肝癌细胞系Huh7.5OC进行基因组的700个lncRNA和另外5种癌症细胞进行敲除实验,最终筛选到51个lncRNA基因能够促进或者抑制肿瘤的生长。
介绍到这里,大家是不是已经折服于CRISPR的巨大魅力和无限潜力了呢?是不是感觉高分文章在向您招手呢?
派森诺推出的CRISPR文库测序及相应分析的服务,为您进行更全面的数据挖掘,助您直挂云帆,乘风破浪,各位老师赶快来派森诺pick它吧!