
2021-06-03
今天给大家分享一篇于2021年2月发表于《NATURE COMMUNICATIONS》的一篇应用单细胞免疫组技术的文章,文章题目为《Tumour heterogeneity and intercellular networks of nasopharyngeal carcinoma at single cell resolution》。
文章题目简单直接的概括了当今肿瘤研究的热点,TME(肿瘤微环境)与intercellular networks(细胞之间互作)。
接下来小编借着这篇文章与大家分享一下,当今热门的肿瘤微环境等热点研究是如何与单细胞免疫组相结合的。
样本队列
作者一共入组了10例NPC(鼻咽癌)病例,取了肿瘤与血液配对样本,基于10X平台完成了5’ mRNA表达谱测序与TCR测序。 注:小编经验,研究过程中如果不确定所关注的样本里面是否有足够比例的免疫细胞做VDJ seq, 建议可以流式等技术做下确认,并且也方便与后续的单细胞样本细胞比例进行互相验证。
分析内容
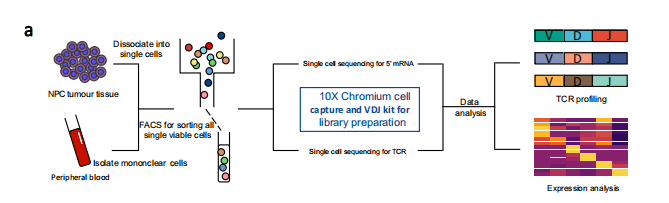
细胞捕获结果:数据量方面,平均每个样本测了380,000,000条reads,大约在120GB左右,数据的饱和度大约在90.75% (75.90%–94.50%)。经过作者严格的质控(多细胞,基因数较少的细胞)之后,一共获得了176447个细胞,其中(82,622 来自肿瘤,93,825来自PBMC)。
常规分析
通过对细胞进行降维,获得细胞亚群。作者选用了主流的R 包 Seurat进行了处理。同时,基于每个亚群高表达的基因与常规的marker作者进行了细胞亚群的注释,CD4T细胞(基因标记:PTPRC、CD3D、CD4)、CD8T细胞(PTPRC、CD3D、CD8A)、骨髓细胞(CD14、用于CD11C的ITGAX)、B细胞(CD19,MS4A1)和NK细胞(FCGR3A和NCAM1)、除此之外,作者还在TME细胞中鉴定到56个成纤维细胞与7个内皮细胞,基于这些分析结果,作者对用不同的展示方式对数据进行了多种描述。
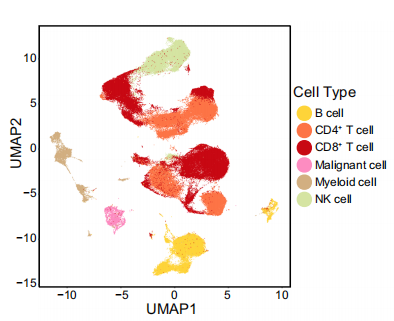
UMAP降维图
(关于umap和tsne的差别可以单开一期细讲,概括来说,TSNE所分出的群和群之间的距离远近是没有意义的,但是UMAP是有的。为了方便客户,我们的标准报告中两种降维方式都提供了。)
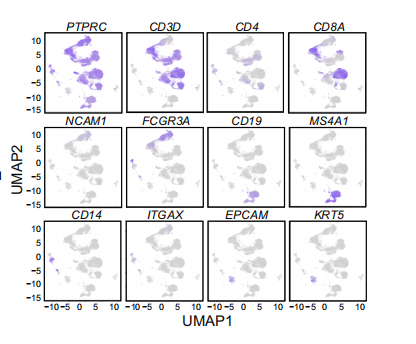
喜闻乐见的marker细胞映射图
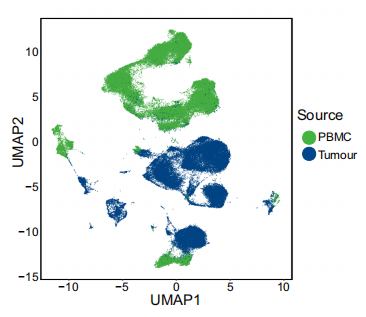
不同来源的UMAP映射图
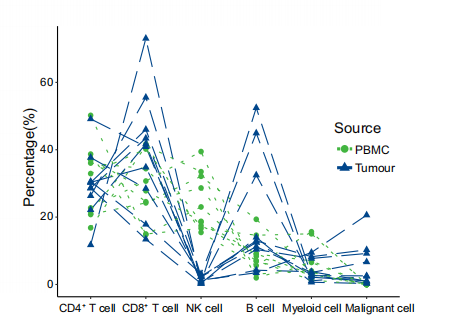
细胞数目占比图
再分群来揭示免疫细胞的异质性与免疫组库的多样性
接下来作者将141,875个NK细胞、T细胞放在一起进行了聚类,一共分成了32个亚群。完成每个亚群的定义之后,作者通过亚群之间的差异分析观察到一系列差异表达的基因,挑选出其中的一些明星基因进行了介绍,例如耗竭相关的exhaustion markers (LAG3, TIGIT,PDCD1, HAVCR2, and CTLA4),效应杀伤性相关的markers effector molecules (GZMB,GZMK, INFG, NKG7, GNLY, and IL2)在某些特定的细胞类群里面高表达,由此可以解释T细胞在TME环境中的抗肿瘤的同时也受抑制等现象。接下来,作者就对其中几个亚群进行了一下描述(比如哪一类亚群表达怎样的特征,表达怎样的基因,在样本间有无数量上的差异. Etc.)。
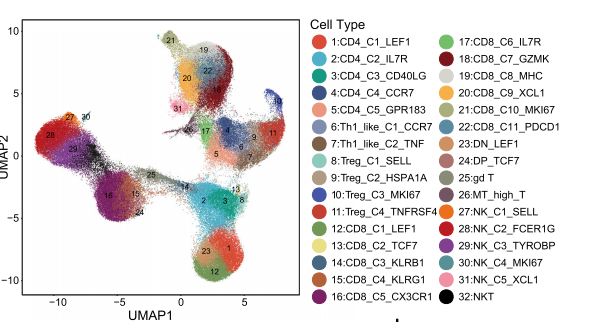
细致的T、NK细胞亚群分类
单细胞免疫组测序不仅包括5'转录组测序,还包含了对于TCR/BCR的测序组装,相对于常规的3'单细胞转录组可以获得更多的信息。所以接下来,作者引入了TCR测序结果,首先作者发现不同样本间没有共享的TCR克隆型。同时,作者发现这些NPC样本都具有一定的VJ偏好性。
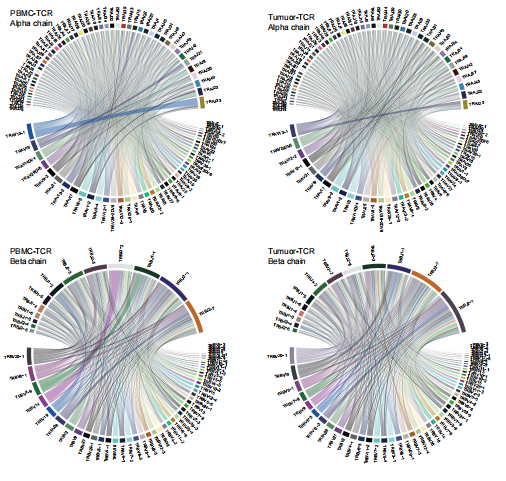
VJ配对圈图
(本公司的报告中也包含嗷)
对于高变的CDR3(免疫组测序可以获得全长序列)的研究发现,CAVRGTGTASKLTF and CASSFSGANVLTF 这两条序列已经被确认与MLANA和EBV抗原有关。同时,与单细胞的亚群分类结果相结合分析,作者发现,CD4和CD8T细胞都有更多的克隆型,而且不同的细胞具有相同的TCR克隆型,这表明在肿瘤抗原连续刺激后,肿瘤浸润T细胞的克隆扩张。
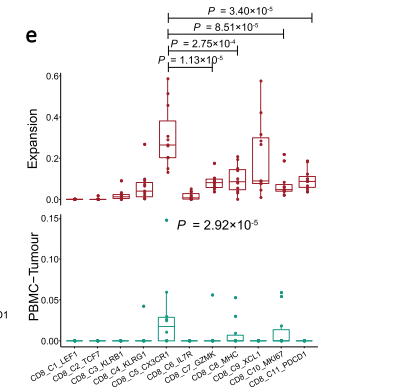
CD8+细胞的多样性与耗竭T细胞的分化产生
接下来,作者主要关注了CD8+T 细胞亚群,常规介绍了这些亚群的表达特征,在不同组别中的分布特点,然后与上文一样,通过差异分析和富集分析开始说明具体的细胞亚群功能,例如,举例肿瘤细胞毒性CD8T细胞簇(CD8_C7_GZMK、CD8_C8_MHC和CD8_C9_XCL1)具有与细胞因子产生和淋巴细胞激活相关的途径富集;CD8_C5_CX3CR1富集在白细胞跨内皮迁移和白细胞迁移相关的途径中。接下来,作者通过拟时序分析来说明CD8+T不同状态下的过度与表达情况。值得一提的是作者使用了TCR、基因表达对T细胞的扩增分布、迁移和转化能力等进行了量化。并且与拟时序分析进行了结合,作者发现肿瘤内耗竭的CD8+T细胞和发挥免疫抑制的调节性T细胞可能分别来源于外周血中的CX3CR1+CD8+T细胞和幼稚的调节性T细胞。CX3CR1+CD8+T细胞不仅具有高细胞毒性和高迁移能力,并且与肿瘤内浸润的CD8+T细胞共享大约10%的TCR克隆型。这些结果说明,CX3CR1+CD8+T细胞具有潜在渗透进入肿瘤组织的能力,并且可以通过TCR识别杀伤肿瘤细胞。这些结果亦提示潜在的细胞治疗策略,即可以通过在体外扩增鼻咽癌病人外周血中的CX3CR1+CD8+T细胞亚群,再回输到病人体内进行细胞治疗;或者利用CX3CR1修饰T细胞来增强T细胞的迁移和进入肿瘤的能力。
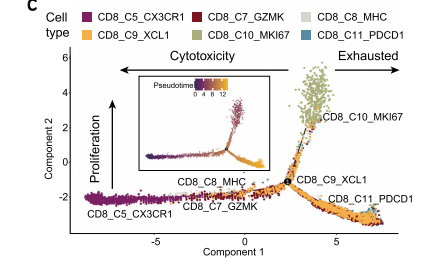
NPC中Treg细胞的多样性和发展轨迹
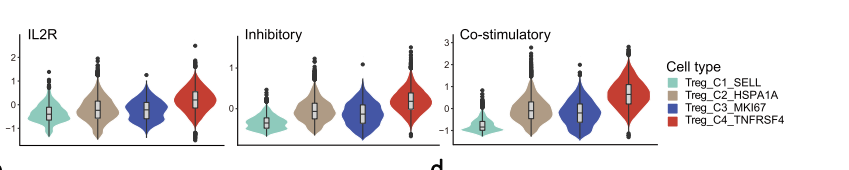
接下来作者运用了与CD8+T 分析类似的方法,首先将11,631个细胞分在了4个细胞簇中,分别为Treg_C1_SELL、Treg_C2_HSPA1A、Treg_C3_MKI67和Treg_C4_TNFRSF4,接下来依旧是比较这些细胞在组间的差异。接下来,作者进一步提出了对每一个细胞计算IL2R scores ,即基于CD25 (IL2RA), CD122(IL2RB), and CD132 (IL2RG)等基因(这三个基因编码跨膜蛋白,形成一个受体复合体,竞争性结合TL2(T细胞生长因子),以抑制效应T细胞)的表达水平来进行计算【派森诺新版高级分析也包括该项目】。然后基于这些细胞的评分比较不同Treg cluster间的差异。
接下来作者继续使用了Monocle2来推断肿瘤内Treg的起源,分析发现 Treg_C4_TNFRSF4作为终末端来源于两种发育轨迹,其一是来源于PBMC的Treg_C1_SELL,其二是来源于肿瘤的Treg_C3_MKI67,同时根据假时间轨迹分析,大多数Treg_C2_HSPA1A细胞都在肿瘤中,起源于Treg_C1_SELL细胞(常驻标记物的缺失表达可能表明最近从PBMC中招募了Treg_C2_HSPA1A细胞。
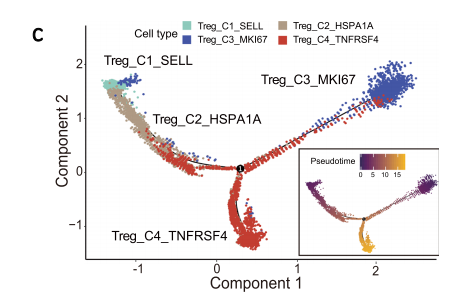
Treg拟时序分析图
作者又结合了TCR对CD4+T 进行了进一步的讨论,在47384个CD4+T细胞中,共有17624检测到了明确的克隆型。其中Treg_C2_HSPA1A和Treg_C4_TNFRSF4克隆下数量中等。值得注意的是,在所有的CD4+T细胞中,Treg_C4_TNFRSF4的克隆细胞比例最大,这意味着克隆更为丰富。同时,Treg_C4_TNFRSF4也是在Treg细胞簇中克隆扩增最多的。同时通过差异基因表达分析可知,Treg_C1_SELL的趋化因子受体CCR4表达很高,这与NPC中CCL5、CCLC17和CCL22所对应。这些观察结果表明,与瘤内细胞的迁移能力和趋化相互作用使外周Treg_C1_SELL细胞有可能向肿瘤募集。接下来作者使用TCR补充了这个验证,观察到来自肿瘤和外周血的Treg细胞之间有少量共享的TCR。总的来说,作者使用了拟时序分析、差异分析、配受体关系与TCR等方法共同验证了这一结论。
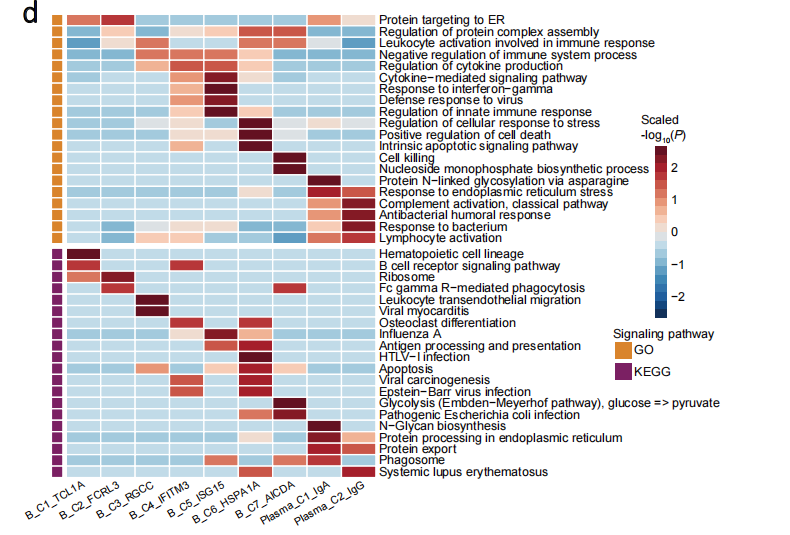
NPC中B细胞的多样性(B细胞亚群分析)
解析完T细胞,作者接下来对B细胞进行了讨论。作者将22892个B细胞分成了9个亚群,其中3个亚群来自PBMC,另外6个来自肿瘤组织。
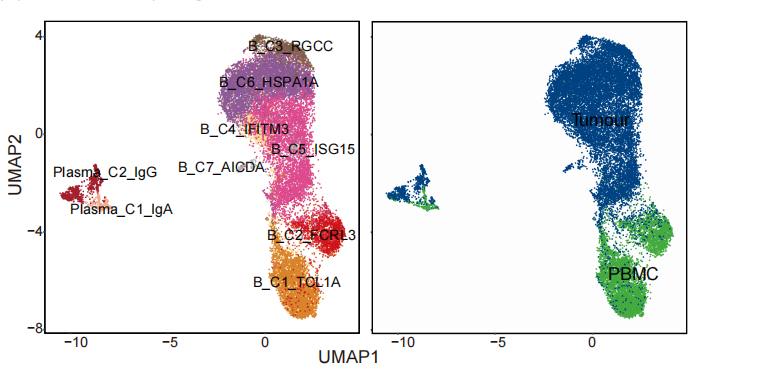
通过差异分析可以发现肿瘤细胞特异表达的一些基因,例如干扰素诱导基因、应激基因等。接下来,作者发现B_C4_IFITM3、B_C5_ISG15和B_C6_HSPA1A等细胞亚群在“EBV感染”、“病毒的防御反应”、“病毒致癌”和“干扰素-伽马的响应” 等途径富集,暗示这三个亚群可能参与EBV感染的免疫反应。
肿瘤相关的LAMP3+DCs在NPC中显示出耐受性表型(髓样细胞亚群分析)
通过对8893个髓样细胞进行聚类分析,共获得10和亚群,其中5个单核/巨噬细胞,三个经典DCs,一个浆细胞样树突状细胞(pDCs)。
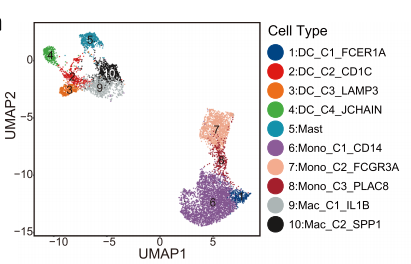
在四个树突状细胞簇中,DC_C2_CD1C、DC_C3_LAMP3和DC_C4_JCHAIN来源于肿瘤,而DC_C1_FCER1A来源于PBMC。
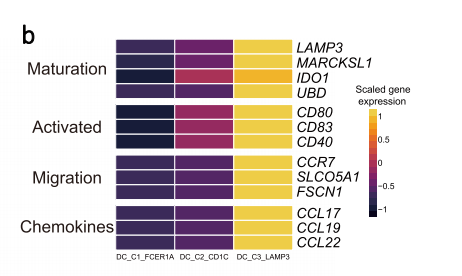
作者将其中高表达与成熟相关的特征基因(LAMP3、MARCKSL1、IDO1、UBD)、激活相关的特征基因(CD80、CD40)和迁移(CCR7、FSCN1、SLCO5A1)的DC_C3_LAMP3拿出来进行了单独的讨论。进一步发现, DC_C3_LAMP3高表达多个趋化因子配体(CCL17、CCL19和CCL22),由此推断可以招募表达相关受体的免疫细胞,根据这些特征,作者定义DC_C3_LAMP3为之前报道过在肿瘤中广泛存在的LAMP3+ DCs。
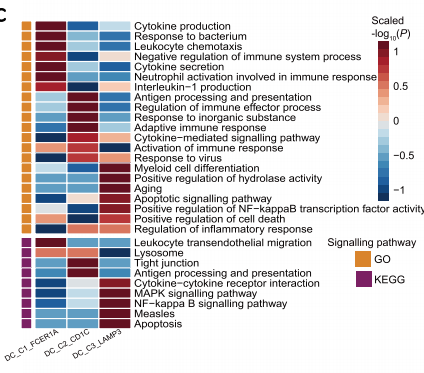
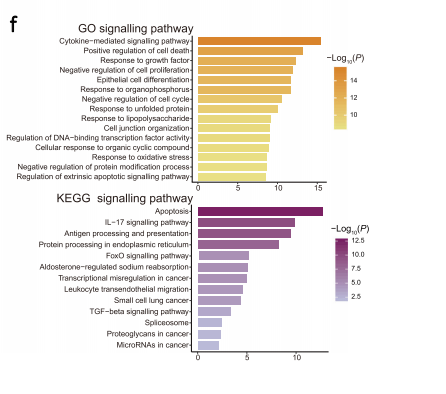
通过GO和KEGG富集分析发现,DC_C3_LAMP3在细胞凋亡、NF-κB和MAPK信号途径以及骨髓样细胞分化等途径均有所上调。
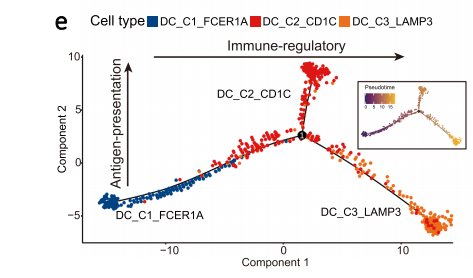
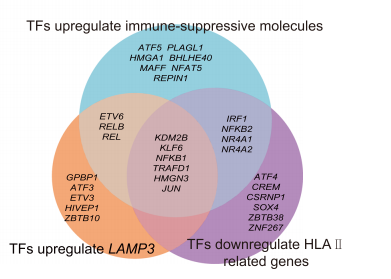
通过拟时序分析发现DC_C1_FCER1A可以发展形成DC_C2_CD1C和DC_C3_LAMP3,其中DC_C3_LAMP3处在终末,说明其处最成熟的分化完全状态。联合转录因子分析,作者构建了鼻咽癌病人外周血与肿瘤微环境之间树突状细胞的迁移、分化和转录因子调控网络,发现了KDM2B、KLF6、NFKB1、TRAFD1、HMGN3和JUN等转录因子对促进LAMP3+树突状细胞的成熟,降低抗原呈递能力和增强免疫调节能力相当重要。通过靶向这些转录因子可能会使LAMP3+树突状细胞重塑为正常的抗原呈递表型,从而使LAMP3+树突状细胞在鼻咽癌患者体内重新发挥激活免疫的功能。
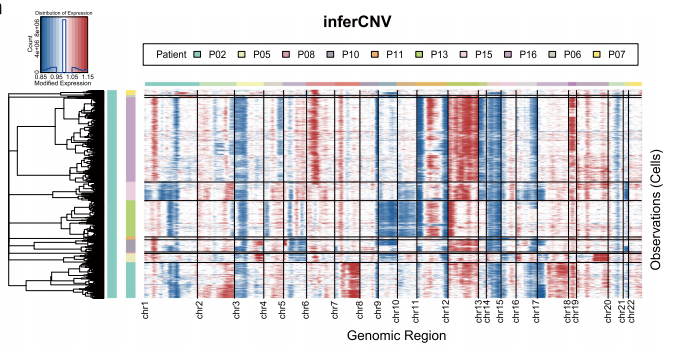
不同EBV感染状态的恶性细胞的异质性(恶性上皮细胞的亚群分析)
作者使用infercnv通过对比正常上皮细胞来检测肿瘤细胞中发生拷贝数变异的上皮细胞(恶性上皮细胞)。
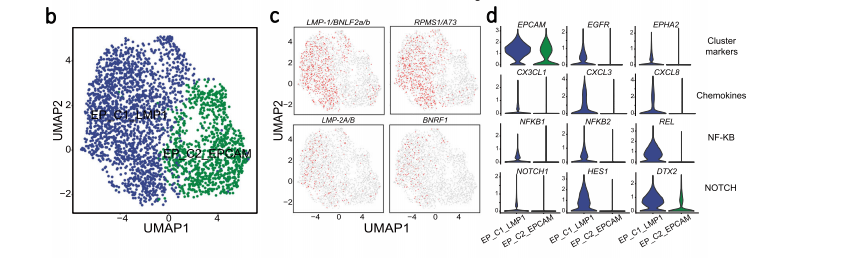
由于EBV是导致NPC恶性转换与肿瘤发生的一个已知因素,作者根据EBV分子((LMP-1/BNLF2a/b, RPMS1/A73, LMP-2A/B, BNRF1)的表达与否将这些恶性细胞分为EBV+(EP_C1_LMP1) and EBV− (EP_C2_EPCAM)。作者观察到,与EP_C2_EPCAM细胞相比,EP_C1_LMP1中涉及NF-κB和Notch通路的主要基因和CX3CL1在内的趋化因子都高表达,并且外周血多种免疫细胞都高表达了CX3CL1的受体CX3CR1。进一步作者使用信号通路富集分析表明,EP_C1_LMP1富集在细胞因子介导、调节细胞死亡、细胞凋亡和癌症相关途径。
接下来作者使用常规的分群将这些细胞分成了五个亚群,并且使用了GSVA来计算每个细胞的通路评分。然后通过差异分析找到每个亚群中的差异通路。这也是可以说明细胞间的异质性的一种方法。
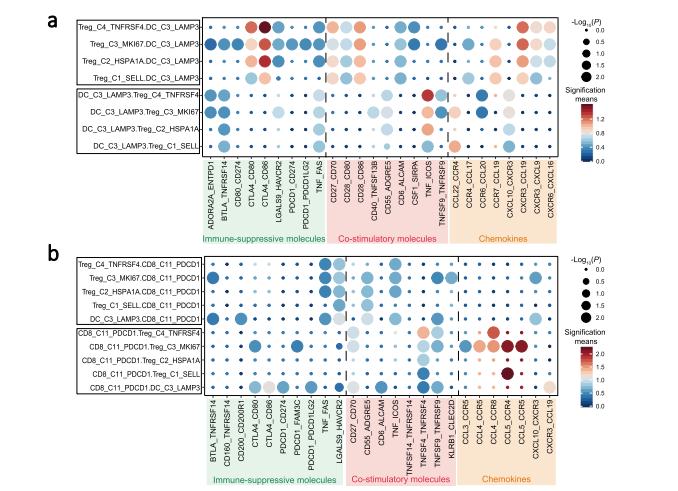
NPC中不同细胞间的通讯
既然上面作者在多个亚群分析里面都或多或少的提了配受体基因的高表达,所以在这一part,作者就详细讨论了细胞亚群之间的配受体通讯。作者使用了CellPhoneDB进行了统计分析。接下来就是详细的描述这些通讯关系了,比如作者观察到DC_C3_LAMP3细胞、Treg细胞和耗竭CD8T细胞(CD8_C11_PDCD1)通过抑制性、共刺激分子或趋化因子之间的密集细胞相互作用,再比如DC_C3_LAMP3细胞亚群可以通过CCL17-CCR4和CCL22-CCR4与PBMC中的Treg_C1_SELL细胞相互作用,CCR4通过将Treg细胞招募到肿瘤组织。Treg_C4_TNFRSF4细胞的CTLA4、ENTPD1和CSF1表达很高,这表明DC_C3_LAMP3细胞上的配体受体与CD80/CD86、ADORA2A和SIRPA结合,可以说明 Treg_C4_TNFRSF4和DC_C3_LAMP3细胞之间有潜在的相互作用。总而言之,根据细胞间通讯可以得到很多有用的信息的,对于了解不同细胞亚群间的互作网络是十分有帮助的。
总 结
通过对NPC队列进行单细胞免疫组测序,基于细胞亚群的再分群,然后对逐个细胞亚群细致的描述与挖掘,结合不同的分析手段(拟时序、GSVA、差异分析、细胞通讯分析)与TCR信息共同验证结论,鉴定了对鼻咽癌肿瘤发生过程中重要的细胞亚群和分子、CDR3序列,把对于鼻咽癌肿瘤的研究推向了更加精细的单细胞层面。
更多新闻资讯请关注派森诺官网:http://www.personalbio.cn