2021-12-02
今天给大家介绍一篇2019年发表在Nature的一篇介绍骨髓微环境的单细胞文章The bone marrow microenvironment at single-cell resolution,解析了单细胞分辨率下的骨髓微环境。
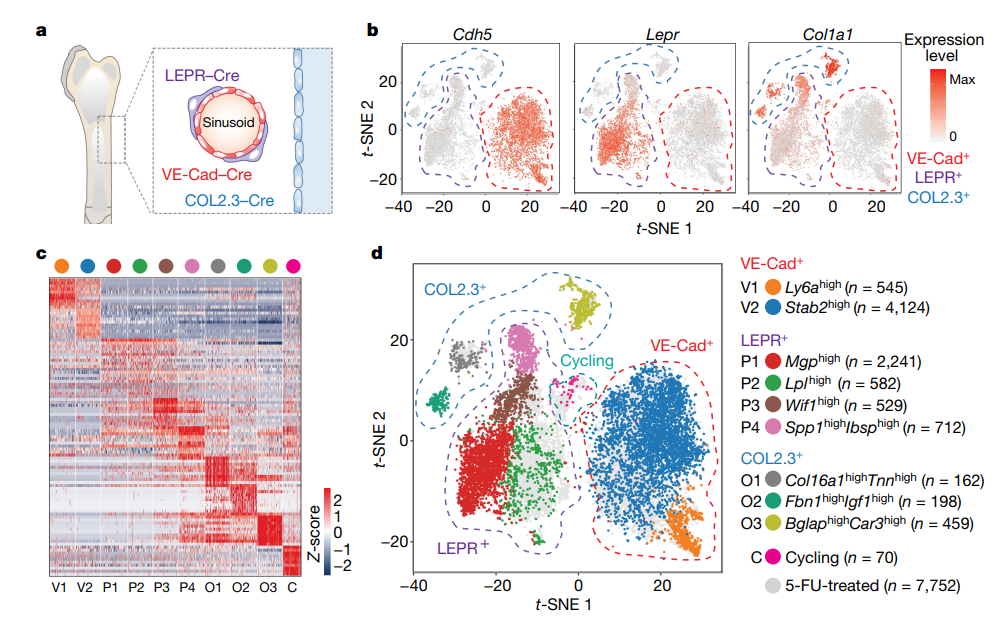
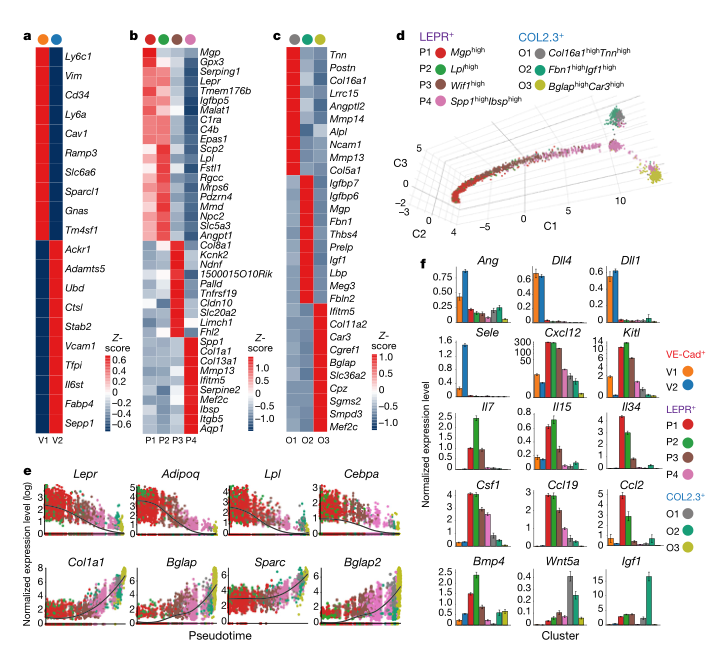
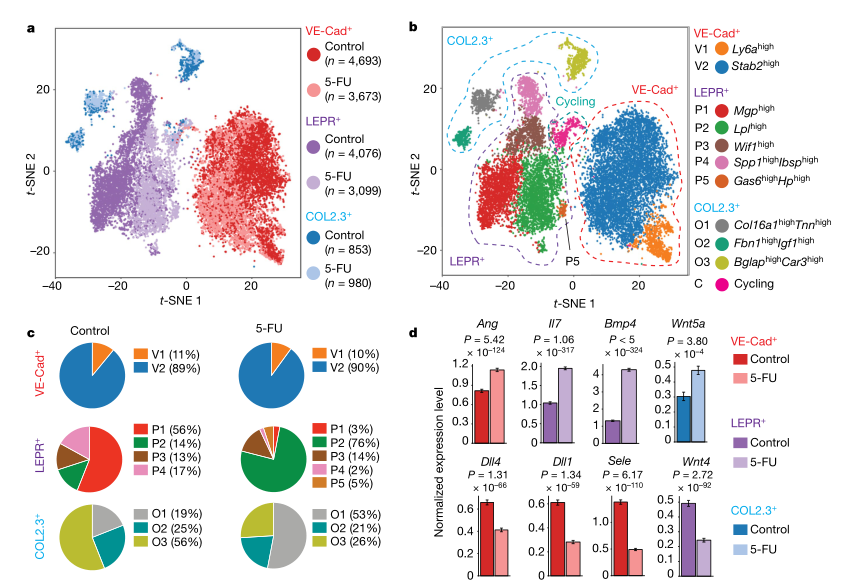
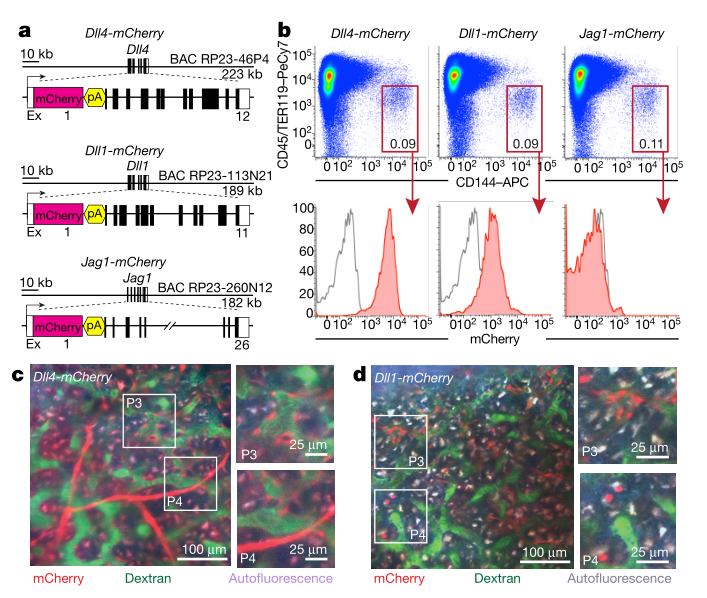
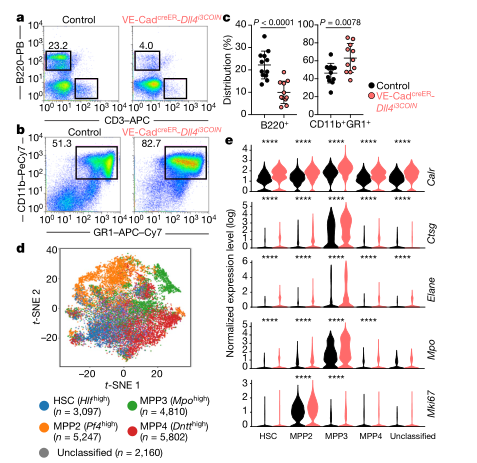
骨髓微环境在调节造血功能方面具有关键作用,但是其分子机制和对压力的反应却尚不明确。作者绘制了在平衡状态下和在应激条件下小鼠骨髓血管、血管周围以及成骨细胞的单细胞图谱。该分析揭示了以前未被认识到的骨髓生态位内的细胞异质性水平,以及原造血生长因子、趋化因子和膜结合配体的细胞来源。 图1:稳定状态下骨髓微环境的scRNA-seq分析 为了可靠地标记骨髓生态位的主要细胞亚群,文章使用了特异性的Cre转基因小鼠并敲入报告基因,对VE-Cad+、LEPR+和COL2.3+细胞进行scRNA-seq (10x Genomics) 研究骨髓生态位群体的转录组多样性,首先证实了Cre表达的相关基因的表达并可以分为3群(图1b);在过滤后的17,374 细胞中,鉴定了2个内皮细胞亚群、4个血管周围亚群和3个骨系亚群(图1c、1d)。 图2:骨髓微环境中亚群细胞的特异性基因表达 通过进一步的亚群分析,在骨髓血管系统中发现了两个主要的细胞群,Ly6a和Stab2分别在v1和v2中高表达,并通过免疫荧光进行了进一步的证实。在血管周围群体中由于其多系分化潜能和间充质干细胞活性,其更加具有异质性,研究获得了4个细胞群体,P2表达脂肪形成相关标记,在正常状态仅证实了P1、P3和P4的存在,在应激造血的情况下出现了额外的P2细胞亚群,这表明一种平稳的前脂肪生成状态,而不是不同的祖细胞。在成骨群体中发现了3个群体,通过转录组分析和免疫荧光获得并验证了其特有的细胞表达特征。由于LEPR+骨髓细胞同时产生成骨细胞和脂肪细胞,作者还通过拟时序分析研究了其分化关系,结果表明 LEPR+细胞状态是一个连续转录状态,其中已知的成脂和成骨标记朝着这个范围的相反两端上升(P1和P2相对于P3和P4)。最后作者对这些细胞群体的原造血因子进行了验证,表明LEPR+细胞是骨髓生态位中一个主要的前造血因子库,COL2.3+ 细胞亚群O2表达IGF-1可能是恶性肿瘤和B细胞发育的关键影响因素(图2)。 图3:化疗应答骨髓生态位的单细胞转录组分析 为了评估急性应激条件下骨髓生态位的动态分子和形态学变化,通过5-FU处理后,在LEPR+细胞中出现了脂肪细胞启动簇P5,不同细胞群体也出现了相应细胞比例的变化,同时观察到与脂肪形成相关的通路显著上调,与骨谱系相关的基因表达整体减少。最后检测了造血因子的变化,这些变化表明了亚群之间转录水平的变化,以及Wnt和Notch等关键通路的信号强度发生了变化,因而化疗应答中骨髓微环境的存在相当大的分子重编程(图3)。 图4:血管内皮细胞是骨髓中Dll4和Dll1的主要来源 由于靶向造血细胞中的Notch受体信号在造血中具有重要的作用,Notch配体的身份和作用仍不清楚。Notch配体Dll1和Dll4在VE-Cad+细胞中特异性表达,Dll1和Dll4的表达在应激条件下动态下调(图4),为了进一步了解Notch配体在骨髓中的表达,通过免疫荧光和流式细胞术,证实Dll4在血管内皮细胞中表达高水平,Dll1在血管内皮细胞中表达中等水平,Dll4在整个骨髓血管腔室的表达,Dll1在NK1.1+的造血细胞亚群中表达,总的来说,这些数据提供了整个骨髓中Dll4和Dll1表达的综合图谱(图4)。 图5:血管内皮细胞表达的Dll4可防止造血祖细胞的髓系偏斜。 为了进一步研究血管Dll4在正常造血过程中的作用,通过对Dll4构建特异性敲除小鼠,并对HSC以及多能祖细胞进行单细胞转录组测序,同时使用基因集评分,研究结果表明在缺少血管Dll4的情况下,造血系统发生了完全的重构,这导致了所有HSPC组分显著朝髓系细胞偏倚。进一步验证表明,血管Dll4(而不是Dll1)是控制早期造血分化潜能的关键Notch配体(图5)。 本研究结果通过展示骨髓生态位的不同血管、血管周围和骨系成分的详细转录组图谱,扩大了对骨髓生态位的理解。通过将造血因子与其细胞来源进行匹配,结果表明,血管内皮表达的Notch配体Dll4的丢失会使骨髓造血向HSPC的转录重编程和髓样启动倾斜。未来可以研究骨髓微环境对异常干细胞功能的影响,如免疫缺陷、造血系统恶性肿瘤和衰老,靶向微环境中相关因子可能干扰疾病的发生和发展。