2022-01-27
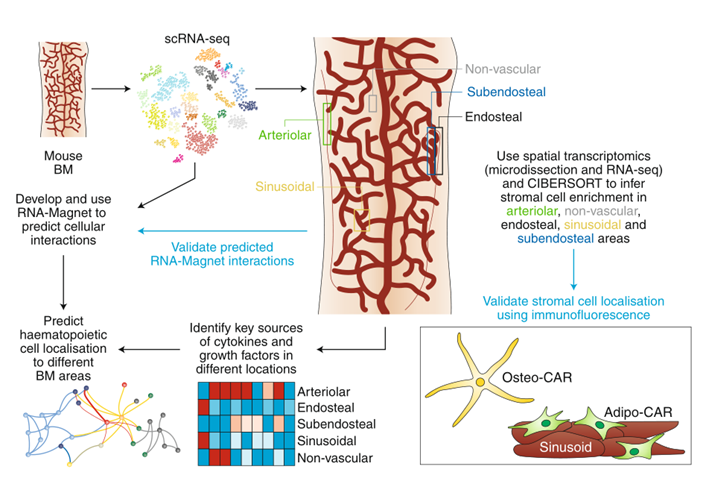
造血干细胞和先祖细胞产生主要血液谱系细胞,离不开骨髓中间质细胞的支持。这些间质细胞组成多细胞的微生态,产生细胞因子(cytokines),趋化因子(chemokines),粘附分子(adhesion molecules)和其他的因子,调节血液细胞的自我更新和分化。因此定义微环境的细胞组成,它们在组织中的位置以及它们分泌的信号因子对于理解骨髓如何保障造血平衡是比较重要的。对骨髓微环境的细胞组成和结构的深入研究主要集中在对造血干细胞生态位的研究。在这些研究中,荧光报告被用于观察HSC的定位以及它们相关的候选生态位细胞,以及对特定的间质细胞进行条件消融或者细胞特异性敲除调控因子来鉴定关键的因素。在这些和其他研究中,现在认识到大部分HSCs位于窦(sinusoids)和巨核细胞(megakaryocytes)附近,少部分位于小动脉(arterioles)和骨内膜(endosteum)附近。内皮细胞(endothelial cells)的不同亚型、血管周细胞(perivascular cells) 和其他间质和造血细胞已经被鉴定为这些HSC生态位的组成成分,并且对生态位的作用具有重要贡献。然而,对于窦、小血管和骨内膜的细胞组成和一些重要调控细胞因子(如CXCL12和SCF)的来源仍然存在争议。尽管该领域的主要焦点一直是HSC生态位的鉴定,但也有证据表明存在特定对于谱系化的先祖细胞的生态位,但是这些问题仍然不清楚。这篇文章结合单细胞和空间解析转录组学来系统地绘制了不同骨髓微环境的分子、细胞和空间组成,以及对主要的骨髓细胞类型进行转录组分析,确定它们的细胞定位和阐明造血因子的来源。
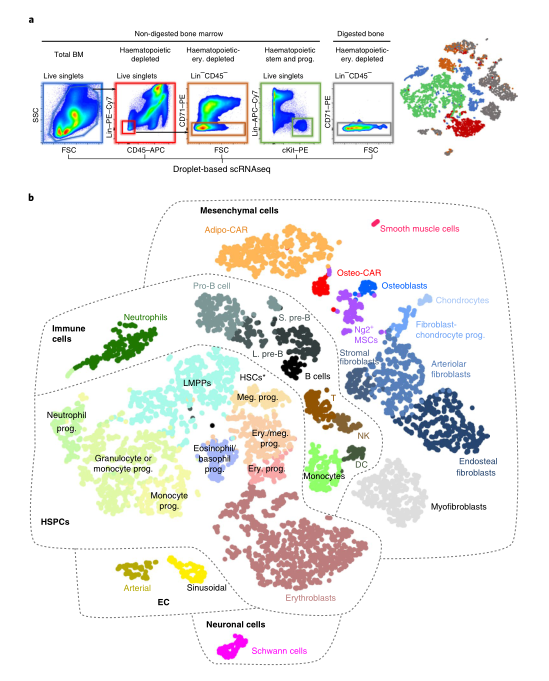
首先是通过单细胞RNAseq来鉴定和刻画BM常驻细胞类型。通过基于液滴的单细胞RNA测序(droplet-based RNAseq)刻绘了骨髓的细胞组成,通过流式分选对稀有细胞的优化,最终捕获到了7497个细胞,获得了32个不同细胞类型和分化阶段的细胞图谱(fig1),包括免疫细胞群体、HSPC、间充质细胞群体。针对稀有的细胞亚群,作者也进行了进一步的鉴定,鉴定出了两个内皮细胞亚群(endothelial cell,EC),包括高表达Encb的窦(sinusoidal)EC和Ly6a的小动脉(arterial)EC(fig2a、2b)。进一步研究主要集中在主要的造血干细胞和间质细胞谱系。这些初步分析解释了骨髓间质细胞的高度异质性。
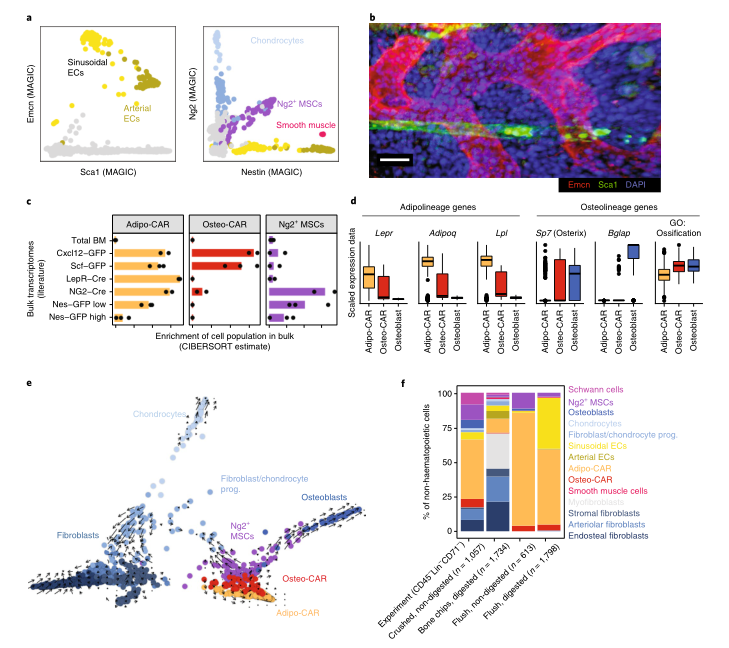
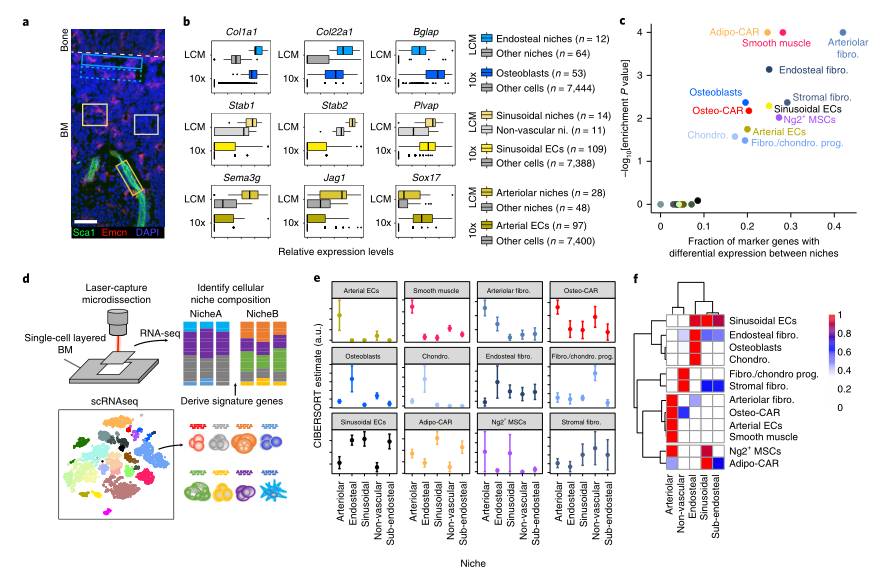
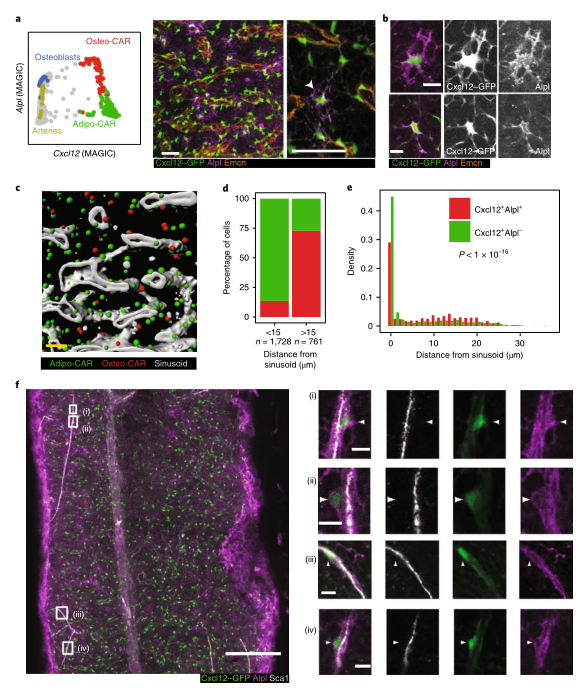
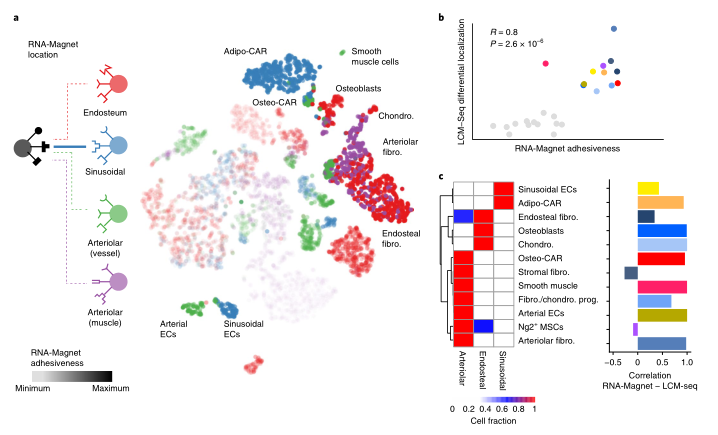
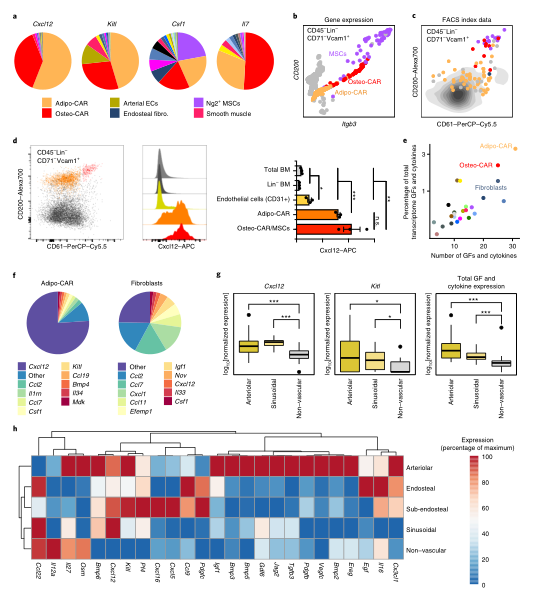
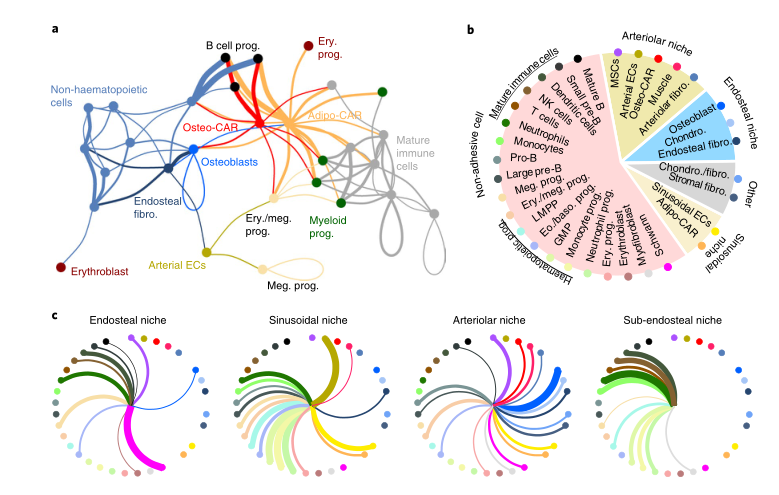
Fig1:scRNAseq鉴定BM常驻细胞类型 之前的研究表明,血管周围间质细胞形成三维网络,包裹和支持骨髓血管。这一群体中的细胞已在Cxcl12-gfp报告小鼠中被鉴定为CAR(CXCL12丰富的网状)细胞,在Nestin-gfp报告小鼠中被鉴定为Nestin - GFPdim细胞,在LepR-cre小鼠中被鉴定为LepR+细胞。这些血管周围间质细胞是造血干细胞生态位的关键组成成分,并产生调节性细胞因子,例如CXCL12和SCF,维持HSC功能。作者在CAR群体中发现了两个不同的亚群,进一步了解这些小生境的复杂性。基于脂肪细胞(adipocyte)和骨遗传(osteolineage)基因的差异表达,他们将这些群体分别称为Adipo-CAR和Osteo-CAR细胞。值得注意的是,Adipo-CAR细胞显示了与LepR+细胞相似的基因表达模式,这表明它们是相同的群体(Fig2)。 Fig2:间质细胞解析 接下来作者结合单细胞和空间转录组学研究细胞的空间定位。开发了一种名为激光捕获显微解剖测序(LCM-seq)(Fig3d),使用这个方法,解剖了窦、小动脉、骨内、骨下和非血管区域,进而确定不同区域的间质类群的分布。Adipo-CAR细胞在窦中富集,而空间转录组数据表明,Osteo-CAR细胞优先定位于小动脉和非血管的生态位。为了进一步验证这一发现,作者确认了Osteo-CAR细胞表达碱性磷酸酶(Alpl),并表明与ALPL-Cxcl12+Osteo-CAR细胞相比,ALPL+Cxcl12+Osteo-CAR与窦的联系不那么紧密,与小动脉的联系更加紧密。使用相同的策略,作者还证实了小动脉存在平滑肌细胞(smooth muscle cells)和平足蛋白(PDPN)阳性成纤维细胞(fibroblasts),PDPN+COL1Alow成纤维细胞则局限于骨面骨内膜区域。作者进一步能够从他们的LCM数据中区分单个细胞群和它们的丰度通过使用CIBERSORT和使用流式细胞术和bulk-RNAseq来进一步实验验证(Fig3)。作者还通过骨切片免疫荧光成像验证了不同间质细胞在各自骨髓区域的位置(Fig4)。 Fig3:整合单细胞和空间转录组学研究 BM细胞类型的空间定位 Fig4:使用免疫荧光技术确定CAR细胞亚型的定位 作者在鉴定了这些以前未被发现的骨髓成分及其定位后,发现每个骨髓区域都有一个独特的细胞因子特征。也就是说,Osteo-CAR和Adipo-CAR细胞是骨髓中造血细胞因子的主要来源,表明不同骨髓区域的造血先祖暴露在不同的细胞因子环境中,进而向不同谱系特化。为了进一步支持这一假设,作者开发了一种计算方法称为RNA-Magnet,以推断间质细胞和造血细胞之间的相互作用。RNA-Magnet根据细胞黏附受体和相关配体的基因表达,绘制了单细胞群体与“吸引”细胞群体之间的物理相互作用。通过这么做,作者可以为两个群体分配权重,描述它们的相对粘附性和相互作用的方向。该算法证实了作者提出的Adipo-CAR和Osteo-CAR群体的小生境定位,以及之前被证明的细胞群体的小生境定位(Fig5)。 Fig5:RNA-Magnet从单细胞基因表达数据 推断细胞相互作用 骨髓中发生的关键生物过程被认为是由一系列不同的细胞因子和生长因子协调作用介导的。然而,对于窦、小血管和骨内膜的细胞组成和一些重要调控细胞因子(如CXCL12和SCF)的来源仍然存在争议。通过在单细胞数据集和流式细胞术证实了CXCL12由Adipo- and Osteo-CAR产生,而不是内皮细胞。CAR细胞群也是B细胞和髓系所需的关键细胞因子的主要生产者,如Il7和m-CSF。在所有的BM细胞类型中,CAR细胞群产生的独特的细胞因子和生长因子数量最多,Osteo-CAR和Adipo-CAR细胞是骨髓中造血细胞因子的主要来源,窦和小动脉附近的小生境是骨髓中重要的造血细胞因子的区域。(Fig6) Fig6: BM中关键细胞因子的细胞和空间来源 为了系统研究骨髓中分子和细胞相互作用,作者通过RNA-Magnet分析观察到,成熟免疫细胞和非造血细胞分化为两簇;与免疫细胞相比,HSPC群体经常接收非造血细胞的信号。CAR两群细胞都是骨髓和淋巴祖细胞感知信号的重要来源,BM中的生物学过程是由特定的小生境分泌的信号介导的。(Fig7) Fig7:BM中的相互作用分析 在这项研究中,通过结合单细胞和空间转录组,构建了所有主要的BM细胞类型的转录组图谱。同时表明调节骨髓造血的关键细胞因子的细胞和空间来源。关键的HSC因子,如Cxcl12和Scf,主要有两个独特和之前不被重视的细胞亚群,通过基因表达图谱定义为Osteo-和Adipo-CAR细胞。CAR差异地地位于窦和小动脉表明,局部充当细胞因子分泌细胞,从而建立血管周微环境。重要的是,使用RNA-Magnet算法,可以从单细胞转录组数据准确地推断出骨髓的三维组织。研究揭示了骨髓生态位的细胞组成和空间组织,提供了一个系统的方法(Fig8)来解剖整个器官的复杂组织。