
2022-08-18
近年来,单细胞测序的应用范围不断延伸,在应用领域从基因组测序、转录组测序、ATAC开放染色质到甲基化测序、空间转录组测序,在物种方面从人、小鼠扩展到拟南芥、玉米等植物及多种多样的非模式物种。作为当下比较火的研究领域,微生物和单细胞测序如何强强联合,碰撞出火花呢?
早在2016年11月Nature Biotechnology发表了《Single-cell microbiology》对单细胞微生物研究进行了展望【1】。文中提到虽然微生物学家们已经掌握了从bulk population获得有意义的生物学结果的方法。但是bulk的研究始终掩盖了细胞间异质性。细菌的自然种群包括各种各样的单个细胞;病毒种群可以形成成群的突变体,统称为准种;同时这些微生物感染的真核细胞也不相同。单细胞技术可以解释感染动力学、耐药性产生以及微生物影响人类代谢等过程中的单个细胞表型。不可否认的是,单细胞测序在微生物中的广泛应用还面临几个问题, mDrop-seq(Single cell RNA-seq (scRNA-seq) of microbes)的开发者也介绍了微生物单细胞转录组测序所面临的难题:
细胞壁:虽然哺乳动物细胞可以使用标准去垢剂在水滴中溶解,但目前还没有微生物单细胞溶解技术。微生物细胞壁由几丁质、β-葡聚糖和甘露糖蛋白组成,这一点尤其具有挑战性。例如,为了裂解白色念珠菌(一种真菌原核生物),需要结合使用化学和酶裂解方式以及严格的热循环。
缺乏多聚腺苷酸化的 mRNA:由于 mRNA 中不存在 3' polyA 尾,则需要设计一种新的转录捕获方案,以及还需要去除基因组 DNA 和核糖体 RNA 以降低测序的方法费用。
较小的转录组:微生物转录组通常很小,每个 mRNA 仅表达几个拷贝。由于缺乏选择性剪接机制,与哺乳动物细胞相比,表达的转录本数量也较少,因此需要相应地提高捕获效率。
以上只是单细胞转录组面临的挑战,可以看出单细胞在微生物中的研究还是任重道远的。
接下来,我们为大家介绍一篇单细胞在微生物研究中的应用:
2021年2月,在Science上发表了《Microbial single-cell RNA sequencing by split-pool barcoding》,作者开发了microSPLiT的微生物单细胞测序技术,可以对革兰氏阴性和革兰氏阳性的细菌进行高通量scrna测序。作者使用microSPLiT应用于在不同生长阶段取样的>25,000个枯草芽孢杆菌细胞,除了常见的细胞状态,作者还还确定了意想不到的基因表达状态,包括细胞亚群中生态位代谢途径的异质激活。
microSPLiT的开发
microSPLiT基于SPLiT-seq,SPLiT-seq是一种真核生物的scRNA-seq方法,在SPLiT-seq中,细胞被分布到一个96孔板中,并使用特异性的条形码引物,利用细胞内逆转录(RT)反应产生cDNA。因为每个孔都可以包含不同的生物样品,所以在一个实验中可以对多达96个样本实现多路复用。具体的示意图如下:
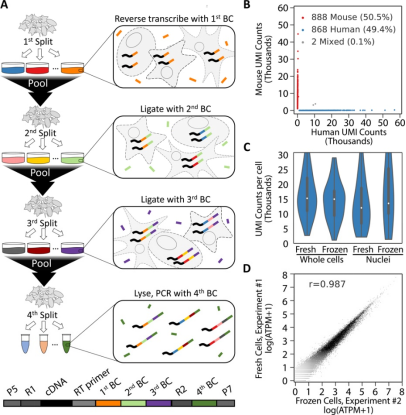
SPLiT-seq示意图【3】
因为SPLiT-seq不需要细胞隔离,所以它与广泛的细胞形状和大小兼容,这也避免了小尺寸在微流控单细胞中分离不理想的情况。作者首先直接将SPLiT-seq应用于微生物中,发现UMI数和mRNA的捕获都十分不理想。接下来,作者优化了细菌的样品处理步骤。考虑到SPLiT-seq的多路复用能力,作者测试了一系列细胞壁去除和膜通透的方法。作者发现使用温和去垢剂Tween-20和溶菌酶组合的方案对革兰氏阳性枯草芽孢杆菌和革兰氏阴性大肠杆菌的捕获效率最高。为了实现mRNA的富集,作者用E. coli Poly(A) Polymerase 大肠杆菌poly(A)聚合酶 (PAP) 进行多聚腺苷化;以及加入5'-磷酸核酸外切酶;用核糖体rna特异性探针进行RT,然后使用RNase H进行降解。作者发现,用PAP处理固定细胞和通透细胞后,mRNA reads的富集量最高(约为2.5倍,约占总RNA的7%)。同时作者还优化了固定方案以及下游的酶促反应。同时作者还提醒到,使用RT会导致细胞聚集,并且在这一步之后的轻度超声处理对于可靠地获得单细胞悬液是必要的。
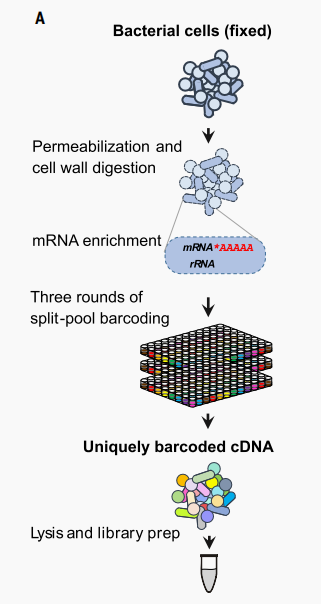
microSPLiT步骤示意图
测试MicroSPLiT的可靠性
为了测试microSPLiT性能,作者将大肠杆菌MW1255和枯草芽孢杆菌PY79细胞培养到600nm (OD600) = 0.5 (OD0.5),并将每个培养物的一半进行短暂的47°C热休克。
作者对这2682个混合细菌进行了单细胞测序,并且将其比对至大肠杆菌和枯草芽孢杆菌的合并基因组上,结果发现转录本(UMI)的分配比较明确,细胞混合的情况比较少,其中大肠杆菌每个细胞的中位数为235个mRNA转录本,枯草芽孢杆菌为397个,约占估计总mRNA的5-10%,需要说明的是在真核生物中这种捕获水平也是很不错的了。并且两种细菌均捕获到了rRNA, 中位数分别为3753和6033条reads。去除多重比对的reads后,枯草芽孢杆菌的mRNA reads比例增加到90.5%,大肠杆菌为28.2%。,而每个细胞的mRNA UMI计数没有受到特别大的影响。
接下来,作者试了microSPLiT是否可以检测到对热休克的转录反应。无监督聚类识别出5个不同的亚群,使用t-SNE进行降维可视化,可以看出根据处理与两个细菌类别亚群呈现了清晰的分布,并且经典热休克基因在大肠杆菌和枯草芽孢杆菌热处理簇中富集。
比较有趣的是亚群5,作者发现这个亚群来自对照和热处理的大肠杆菌细胞,这些细胞表达了DEAD-box解旋酶家族诱导以及冷休克基因cspA对cspG的特征,与对冷的转录反应一致。作者解释其为大肠杆菌亚群可能对甲醛固定前第一步的短暂冷离心步骤表现出非常快速的反应,因此可能是工作流程的人为因素。
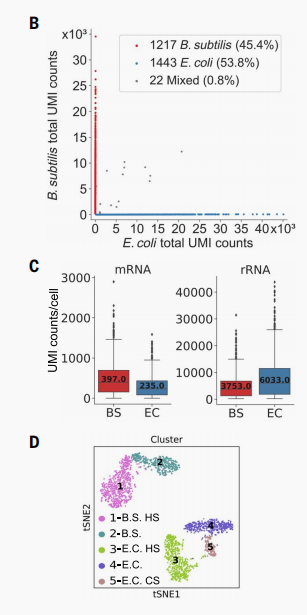
枯草芽孢杆菌在富培养基中生长时的转录模式
相对于模式物种等真核生物的单细胞,微生物的单细胞分析手段虽然都是类似的,但是其中可以获取的信息确实相当新颖的。作者接下来使用microSPLiT应用于在富培养基(LB)中枯草芽孢杆菌不同生长节点的转录状态。作者对实验室菌株PY79的生长曲线采样10个OD点,OD值从0.5(早期指数阶段)到OD值为6.0(早期稳定阶段),并且对四个节点取了重复。并且使用第一个条形码用于记录样本身份(即OD),经此产生了25,214个细胞,亚群聚类获得了14个细胞群,其中多数可以和OD一一对应。最显著的例外是两个较小的细胞群,包含细胞从多个OD,亚群9,包含OD2、OD3.2,差异表达肌醇代谢途径基因,亚群13,只包含36个细胞,来自于五个不同的OD点,差异表达的基因与缺陷PBSX噬菌体有关。接下来作者主要分析了sigma因子的表达变化,以及各自调控因子的基因表达中推断出所选择的转录调控因子的活性谱,这部分的分析主要可以证实microSPLiT捕获了已知的调控程序,并揭示了广泛的细胞通路的异质性。
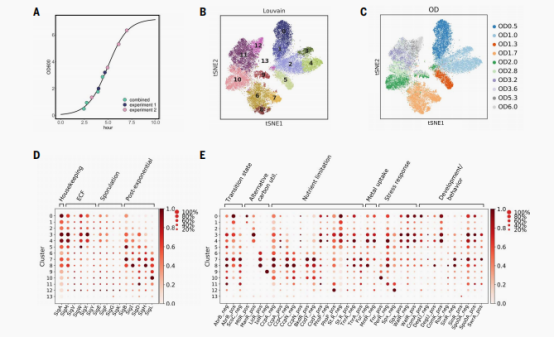
MicroSPLiT检测枯草芽孢杆菌生长过程中的整体转录状态
中心碳代谢的变化和替代碳利用途径的短暂激活
由于作者在转录调控因子分析中观察到的碳利用调控的变化,作者从而对每个簇中富集的碳代谢基因进行了更全面的检查。当葡萄糖和其他首选糖存在时,它们在糖酵解过程中转化为丙酮酸,这是这些糖丰富时的主要代谢途径。在这些促进快速生长的条件下,丙酮酸通过发酵转化为乳酸、醋酸、乙酸、乙酰酯和其他副产品。在首选糖耗尽后,细胞将发酵副产物重新在三羧酸(TCA)循环中代谢,生成额外的三磷酸腺苷(ATP)和二氧化碳。
作者观察到,在对应早期OD的亚群种(亚群0到4),高表达的基因参与糖酵解如葡萄糖渗透酶(ptsG)和基因参与快速生长和发酵,如乳酸脱氢酶(ldh)、丙酮酸脱氢酶(pdhA)和醋酸激酶(ackA)。在OD值为1.7时,细胞似乎经历了从糖酵解到糖异生的剧烈转变,在亚群7和亚群8中激活了来自糖异生途径的多个基因。此外作者还发现了一种不同的丙酮酸生产和利用模式,以及另一种发酵产物乙酰蛋白的分解代谢,以及额外进入三羧酸循环的营养通量。
基于这些基因的表达模式。作者还发现了不同碳源的吸收和利用途径的表达,当首选的碳来源被耗尽时,替代碳利用途径的主要抑制因子CcpA变得不活跃,允许细胞分解多种碳水化合物。作者推断,这些通路的激活和抑制发生在每个OD样本中细胞的不同比例中,并且似乎遵循一个时间顺序。
中间生长阶段肌醇分解代谢途径的异质性激活
肌醇是土壤中丰富的资源,枯草芽孢杆菌能够以肌醇作为其唯一的碳源来生存。虽然LB介质通常不需要含有肌醇,但是作者在两个独立LB生长实验中,在亚群9(OD3-3.2)中观察到有一小部分细胞异质肌醇利用途径的激活。作者推测这些结果来自于LB培养基中存在的微量肌醇,可能来自酵母提取物,因为酵母能够产生肌醇作为必要的膜成分磷脂酰肌醇的前体。有三个操纵子参与肌醇的利用:iolT(主要转运体),iolRS (第一个基因是抑制因子,第二个基因是脱氢酶-like)以及iolAJ(代谢酶),iolRS和iolAJ通常是由sigma A进行转录。在葡萄糖存在时,CcpA抑制iolAJ操纵子。值得注意的是,作者观察到通路抑制基因iolR基因在簇9的内外表达更广泛。为了验证发现,作者构建了肌醇代谢途径中所有三个操纵子的荧光报告基因[转录报告基因PiolA-YFP和PiolR-CFP和蛋白质基因融合IolT-mScarlet-I],作者观察到在肌醇作为唯一碳源的存在下,所有三个操纵子的广泛表达。在LB中生长的细胞在OD2时有22.7%表达PiolA-YFP,在 OD4时44%的细胞有PiolA-YFP的异质表达。而在LB中生长到OD0.7的细胞,PiolA-YFP有更强的表达。虽然microSPLiT数据显示,细胞表达肌醇代谢基因(属于亚群9)从OD3.2的5%到OD5.3的0.3%,YFP在OD4的表达还呈现积累状态,这与荧光蛋白成熟的延迟和荧光蛋白的高稳定性相一致,荧光蛋白主要在细胞分裂过程中通过稀释从细胞中清除。总结而言,通过转录组学和荧光报告数据表明,在LB中生长的对数生长期和稳定期初期的细胞亚群中,肌醇代谢途径中的基因转录以异质方式被激活。激活分子的来源以及这种行为背后潜在的基因调控网络仍有待确定。
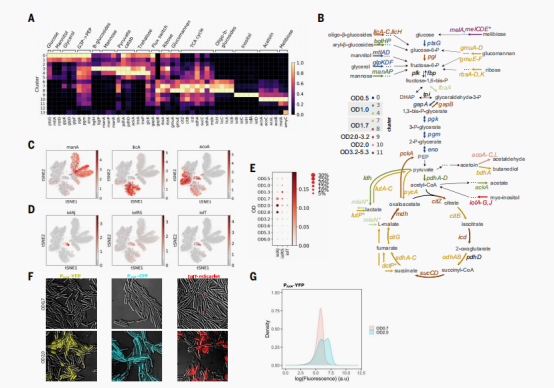
枯草芽孢杆菌生长过程中中心碳代谢的变化和替代碳源的利用
运动性、抗菌素、应激反应和金属相关基因
细菌普遍产生肽和小分子抗菌素,旨在针对密切和远缘的生物体。作者观察了至少三种广谱抗菌素:枯草杆菌素、杆菌素和铂素在ODs的不同细胞中的表达。在最后三个ODs中,作者还发现了孢子杀灭因子基因(skf)和孢子延迟蛋白基因(sdp)的增加。接下来作者观察到部分细胞表达运动性基因(有hag编码的操纵子和鞭毛蛋白),在OD6.0时显著下降,同时表面actin蛋白(srfAA~srfAD)在OD值为6.0时几乎百分百表达。作者还发发现,参与未折叠蛋白反应的基因:如clpp相关蛋白酶(clpP、clpC、clpX和clpE)、McsA和McsB激酶(mcsA和mcsB)以及伴侣蛋白(groEL和groES)在OD1.7达到峰值,与细胞从糖酵解转换为糖异生时相同,这些基因的表达是由正常指数生长过程中调节sigma B活性的瞬时增加而导致的。除此之外,作者还分析了与金属相关的基因的表达,如铁载体杆菌动蛋白(fhbA)与相关转运体(mntA)和锰转运体(mntA到mntD)。
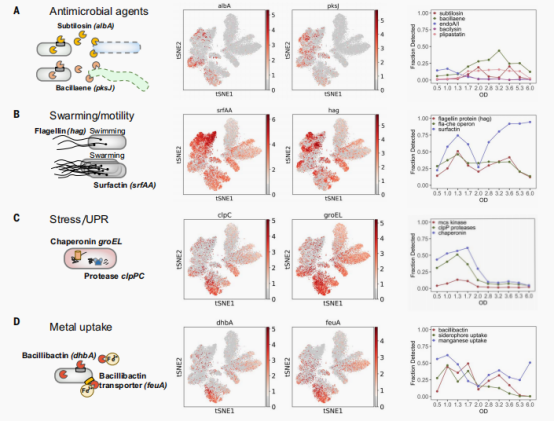
内在的应激反应和发育性基因的表达
MicroSPLiT量化了一种罕见的应激反应
亚群13 (36个细胞,总细胞的0.142%,代表ODs在0.5-2.8)包含一个罕见的表达PBSX原噬菌体基因的细胞亚群。PBSX元件是一种有缺陷的噬菌体,是非传染性的,在诱导后导致噬菌体样颗粒的释放,其中包含13kb的随机片段染色体DNA。原噬菌体基因的表达是由DNA损伤诱导的,在指数生长过程中在一小部分细胞中被激活, 13亚群中差异表达的大多数基因代表已知的PBSX噬菌体基因,其中包括PBSX噬菌体溶解(xlyA和xlyB、xhlA和xhlB)、噬菌体释放(xepA)和噬菌体复制(xtmA和xtmB),以及许多功能未知的PBSX相关基因。作者不仅鉴定了一个罕见的处于原噬菌体诱导状态的细胞亚群,而且还捕获了主要的原噬菌体相关操纵子的表达。同时还鉴定了11个在PBSX原噬菌体簇中表达的已知或假定功能的宿主基因。其中5个基因先前已被证明仅在含有枯草芽孢杆菌的PBSX菌株中被诱导。其他的基因中还包含 化学受体蛋白(mcpC),atp结合盒转运体(liaL),细胞壁结合蛋白(ykuG),铵转运体(amtB),蔗糖6磷酸水解酶(sacA)和同源重组调节蛋白(recX),这些以前没有被认为与噬菌体诱导有关。
MicroSPLiT捕获了一种罕见的随机诱导的发育状态
在胁迫或营养限制下,一小部分(2-5%)枯草芽孢杆菌细胞经历随机短暂分化为自然能力状态,其特征是能够摄取细胞外DNA并将其整合到染色体。主调控因子ComK通过正反馈调节被激活,并且诱导一系列基因的表达,并参与多种细胞过程。作者分别对最后两个OD点(OD5.3和OD6.0)进行了亚聚类。在UMAP图上,可以看到一个小的亚群(62个细胞,占OD5.3和OD6的细胞的4.6%)表达了一个独特的感受态或k态的转录特征,与之前的研究类似,最丰富表达的基因是comGA,其次是琥珀酰辅酶A结合酶(sucCD),同时作者还观察到编码DNA摄取机制的基因的富集:comF和comE操纵子;反应调节器(rapH),它抑制活性细胞的产孢发育,以及处理单链DNA加工所需的基因,如recA,以及单链DNA结合蛋白SsbA和SsbB。总的来说,实验捕获到了与之前报道能力相关的基因,并且还发现了四个新的未报道与该状态相关的基因。
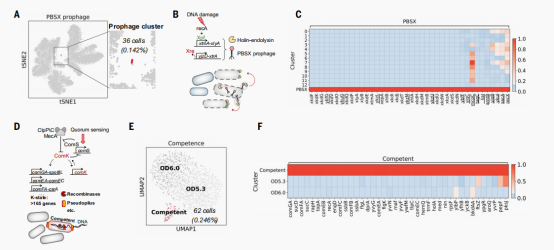
细胞应激诱导的罕见发育状态
以上就是这篇文章的大致介绍了。可以看出,单细胞在微生物中具有广泛的研究前景,可以做的研究简直是太多了。
希望在自然菌群中完成单细胞测序及分析研究的那一天早日到来~
正如路易斯·巴斯德所说,“Dans les champs de l'observation le hasard ne favorise que les esprits préparés.” -- 在观察的领域中,机遇只偏爱那种有准备的头脑。
参考文献:
[1] None. "Single-cell microbiology." Nature Biotechnology 34.11(2016):1077-1077.
[2] Basu, A. . "mDrop-Seq: Massively Parallel Single-Cell RNA-Seq of Saccharomyces cerevisiae and Candida albicans." Vaccines 10(2021).
[3] Rosenberg, Alexander B , et al. "Single-cell profiling of the developing mouse brain and spinal cord with split-pool barcoding." Science 360.6385(2018):eaam8999.