2022-09-07
背景介绍
近年来,基因编辑技术、RNAi技术、合成生物学等转基因新技术飞速发展,特别是2020年获得诺贝尔化学奖的基因编辑技术——间隔规律成簇短回文重复序列及关联蛋白(clustered regularly interspaced shortpalindromic repeats/CRISPR‐associated proteins,CRISPR/Cas),已经成为最热门的转基因工具,为基因功能研究开创了新局面。 基因编辑依赖于经过改造的核酸酶,核酸酶在基因组中特定位置产生位点特异性双链断裂(double strand break,DSB),诱导生物体通过同源重组(homologous recombination,HR)或非同源末端连接(non-homologous end joining,NHEJ)的方式来修复 DSB(如下图所示)。HR修复的效率很低,因为需要有同源片段的存在,以其为模板才能进行修复。而 NHEJ修复,不需要模板,修复过程容易出错,从而实现靶点的碱基替换、缺失以及插入等。同时相比于转基因产品而言,基因编辑技术在受体生物内留下的痕迹较少,传统的转基因检测技术很难满足基因编辑产品的检测,特别是NHEJ这类只涉及少量碱基改变的产品。因此,需要加强检测新技术的研究,建立针对基因编辑产品等新技术产品的检测方法。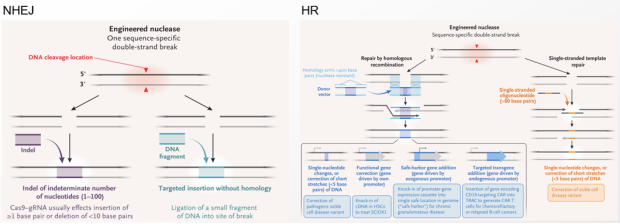
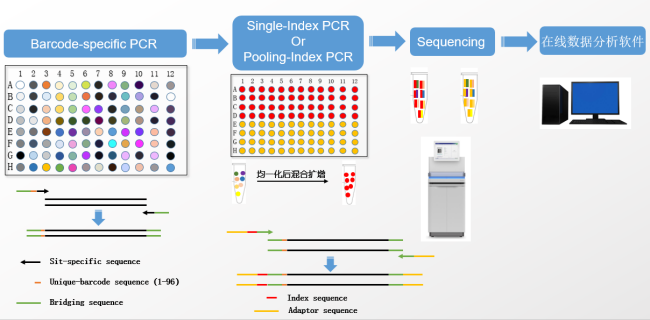
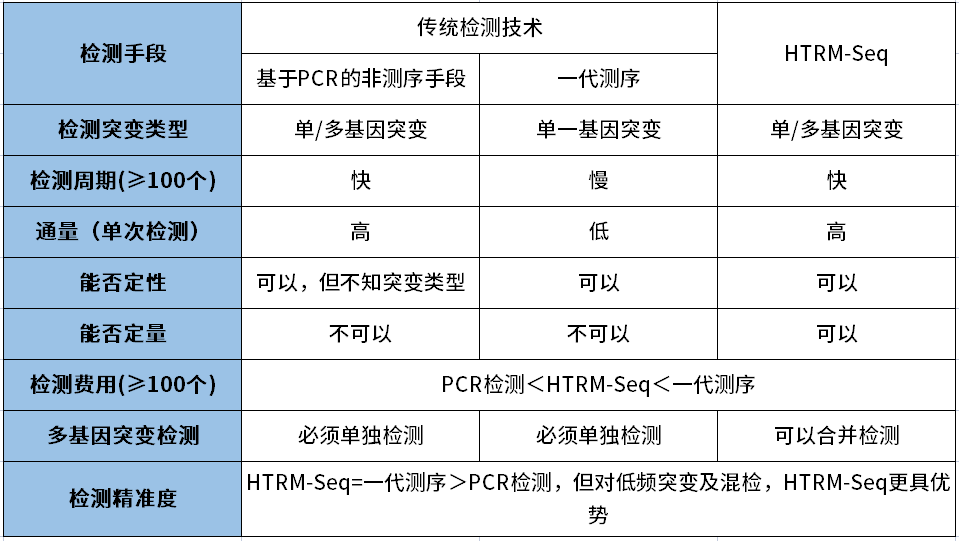
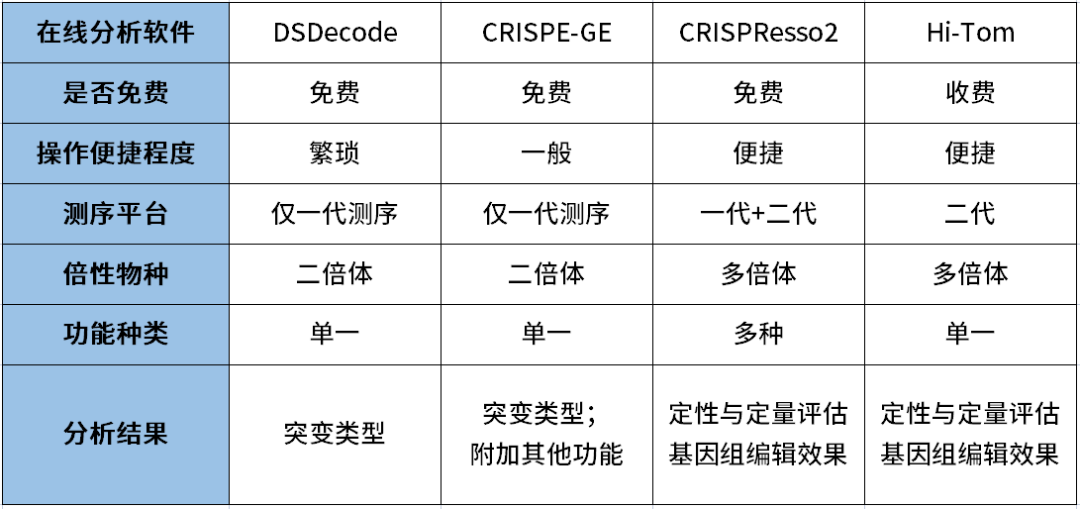
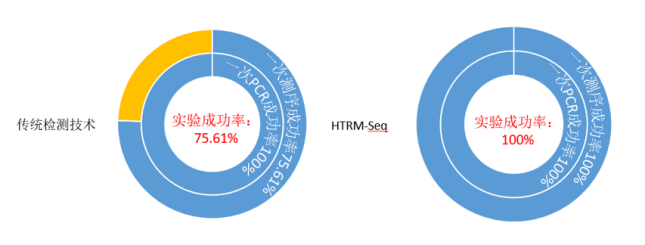
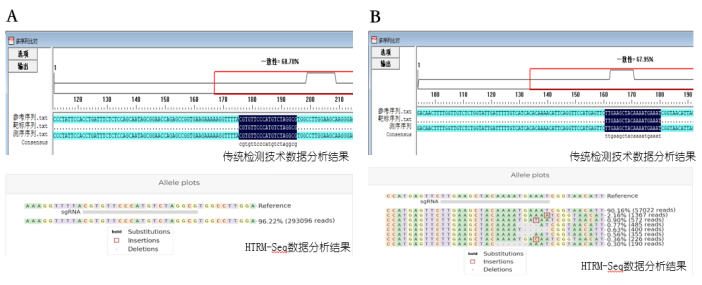
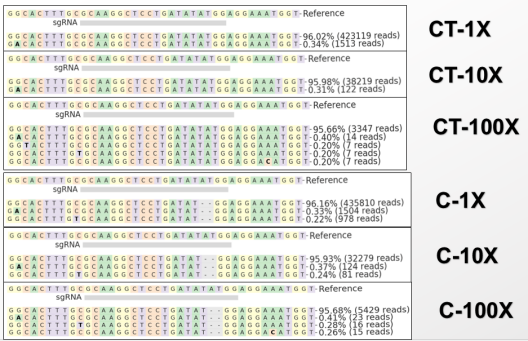
派森诺基于目前基因编辑技术的特点以及现有传统检测技术的局限性,开发了一种基于二代测序的高通量检测变异位点类型的检测技术- HTRM-Seq。 技术路线如下图: 技术优势如下表: 在编辑位点与序列已知的情况下,与目前的检测方法比较分析: 数据分析优势如下: 推荐使用CRISPResso2分析,若需要更加深入或个性化分析,我们可以提供更加专业的生信分析平台。 HTRM-Seq实测案例如下: HTRM-Seq:实验成功率比较分析 我们选取了41份单基因突变的烟草转基因植株,使用相同提取方法进行提取,分别使用基于一代测序的传统检测技术以及HTRM-Seq对样本进行扩增检测测序(备注:模板投入量、扩增酶、扩增体系扩增程序均相同)。其中传统检测技术,41份DNA均一次扩增成功,平均的PCR产物浓度3-5ng/ul,上一代测序平台31份有数据产出,10份由于荧光信号弱测序失败;而HTRM-Seq,41份DNA均一次性建库成功且有数据产物,平均PCR产物浓度1-3ng/ul(如下图所示)。由此可以得出,前期不管是传统检测手段还是HTRM-Seq,扩增成功率均基本一致,但是对测序前PCR产物的浓度要求,HTRM-Seq比传统检测手段要更低,进而提高样本的转化效率。 HTRM-Seq:测序精准度比较分析 我们选取了纯野生型烟草种子以及混合种子(野生型+突变型,野生型占多数),使用相同提取方法进行提取,分别使用基于一代测序的传统检测手段以及HTRM-Seq对样本进行扩增检测测序(备注:模板投入量、扩增酶、扩增体系扩增程序均相同)。数据分析结果显示:对于纯野生型的检测,HTRM-Seq与传统检测结果一致(如下图-A);但是对于低频突变或混合检测,HTRM-Seq能够区分不同的突变类型,而传统检测不行(如下图-B)。从而可以得出:对于高频率的纯合突变类型来说,HTRM-Seq与传统检测精准度基本一致;但是对于低频率的突变类型或混样来说,HTRM-Seq更具有优势。 HTRM-Seq:大批量样本检测的快速性 我们选取了纯野生型烟草(CT)与纯合突变型烟草(C),使用HTRM-Seq对样本进行扩增检测测序,上机时对同一批次样本进行梯度(1x、10x、100x稀释)上机。数据结果分析发现,HTRM-seq技术在不影响检测精度的前提下,有效数据量可以降低到一定范围内,提高了检测的通量,大量的样本也可以一次性检测,进而可以进一步缩短项目周期。 综合上述,相比较传统检测技术,可以发现HTRM-Seq不管是在检测精准度的方面,还是在数据分析的便捷性以及适用性范围方面,均占据一定的优势,是检测大批量基因编辑样本的不二之选。