2022-09-22
单细胞转录组技术作为目前科研领域的一大热门,可以以高分辨率对数百万个单细胞的转录信息进行分析,研究单个细胞的特性和功能的多样性、细胞间的异质性等问题,使我们能更深入地了解复杂的生物系统。今天我们就对近期发表的《Cell Stem Cell》文章进行解析,看单细胞数据如何揭示肝脏的再生过程。

研究背景
肝脏是一个高度异质的器官,具有代谢、解毒、造血、分泌胆汁等功能。肝脏由无数大小、形态相似的肝小叶(Liver lobule)组成,其中门静脉(PV)位于邻近肝小叶间的连接处,富含营养的血液经门静脉由肠道进入肝脏,而耗尽养分及氧气的血液则经中央静脉(CV)排出。正常情况下,肝脏通过其组织内的成千上万的肝小叶完成其复杂的功能。血液首先进入小叶的角落,称为“门脉节点”,并通过窦性通道流入引流的中央静脉 (CV)。这种极化的血流与肝细胞的连续消耗和分泌相结合,产生氧气、营养物质和激素的梯度分布,导致高度异质的微环境,因此肝脏中不同位置的细胞在基因表达上呈现显著差异,约一半的肝细胞基因是呈带状分布的,例如糖异生和蛋白质分泌等过程是由门静脉周围肝细胞负责,其他过程如药物解毒则由中心周围肝细胞发挥功能,该现象称为“肝脏分区”,目前尚不清楚这种空间异质性如何影响肝脏病理和再生过程。 此外,肝脏也是再生能力最强的器官之一。在急性剂量的药物作用下,试图解毒这些外来物质的中心周围肝细胞被有毒中间体淹没而死亡。剩下的肝组织进入再生模式,导致受损的小叶层迅速愈合和替换。分区再生涉及一系列相互协调的过程,对反应有严格的时空控制要求。死亡的肝细胞需要被有效清除,防止多种新抗原暴露以诱导适应性免疫系统。细胞外基质需要被快速构建以支持组织支架,但一旦新细胞形成就要分解,以防止持久的纤维化。最重要的是,起源于小叶区表达特征截然不同的肝细胞需要快速生成和重新编程,以接管中心周围肝细胞的关键功能。目前,在整个分区再生过程中,肝脏组织各细胞类型的协调反应的时空动力学仍亟待探索。 本文利用单细胞转录组、转录组联合空间转录组测序技术解析急性损伤后肝脏不同区域再生的时空程序性调控过程,发现肝细胞在小叶内增殖以迅速产生缺失的细胞,新进的中心周围肝细胞在分区内重新编程,改变形态,提高蛋白质周转并上调癌胚基因。非实质细胞通过区域相关的因素对该过程进行协调。本研究的开展促进了人类对于肝再生过程的区域性协调程序的理解。
研究思路
研究结果
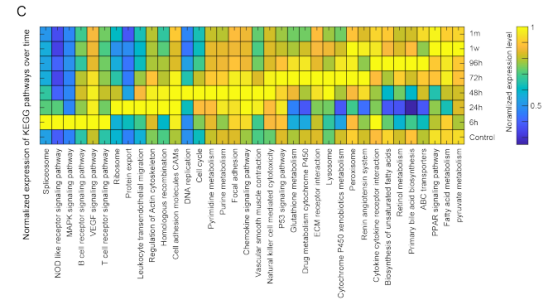
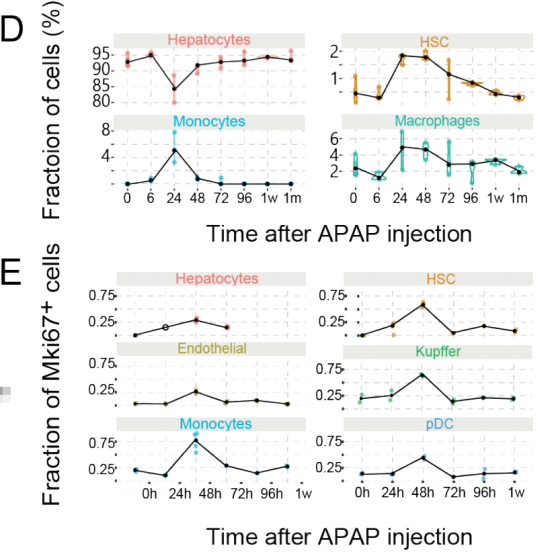
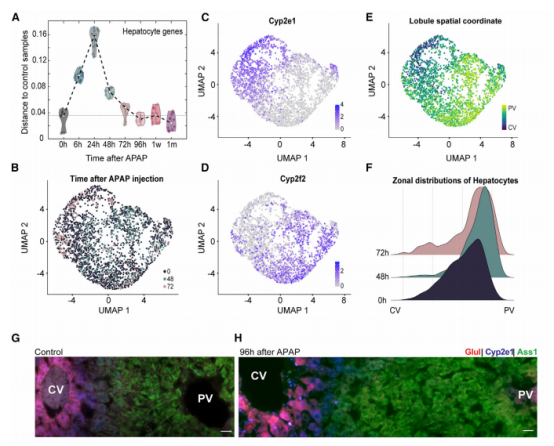
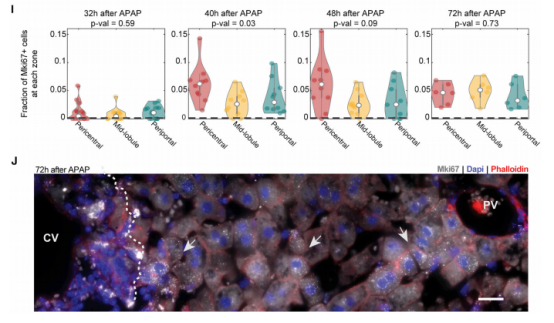
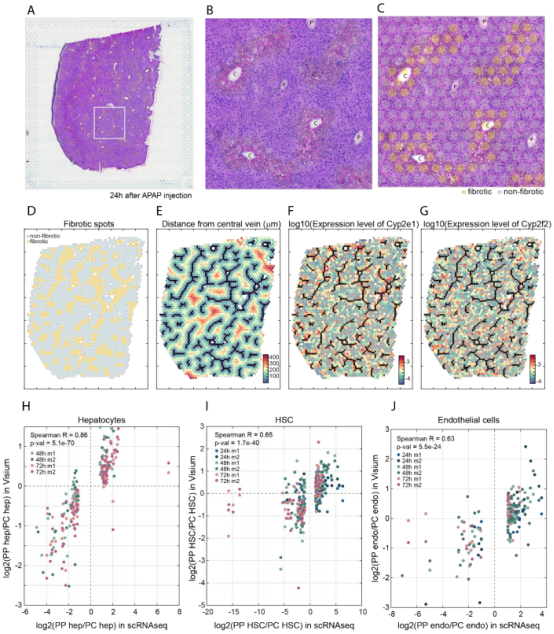
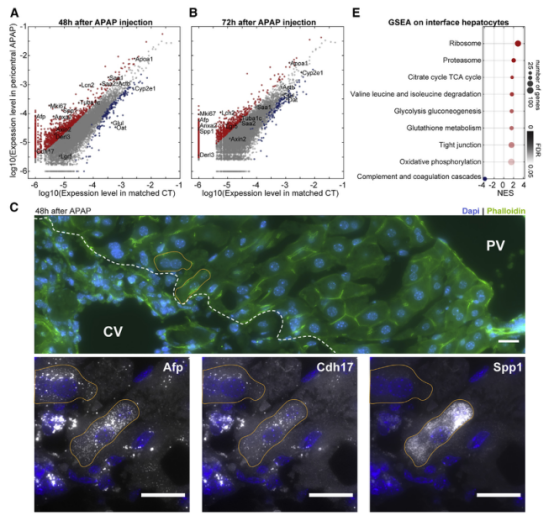
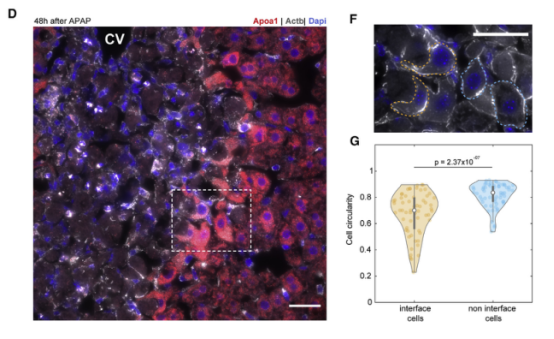
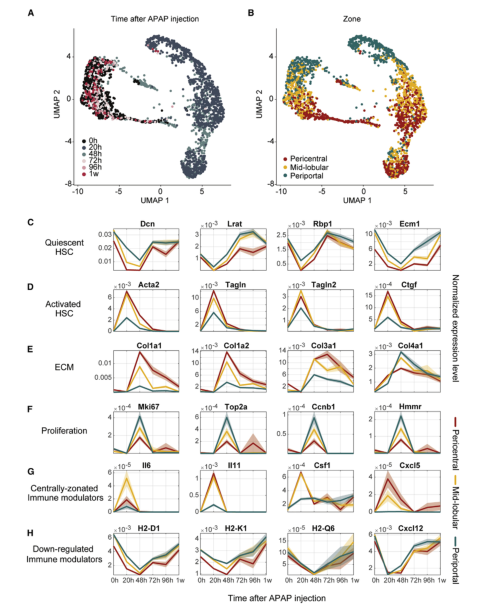
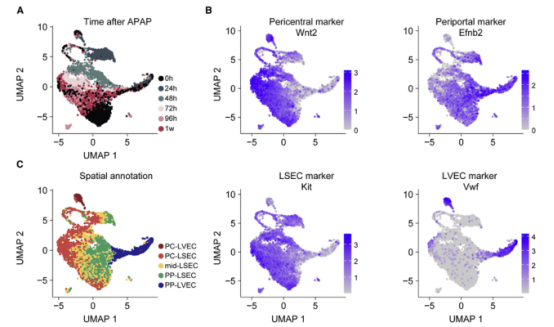
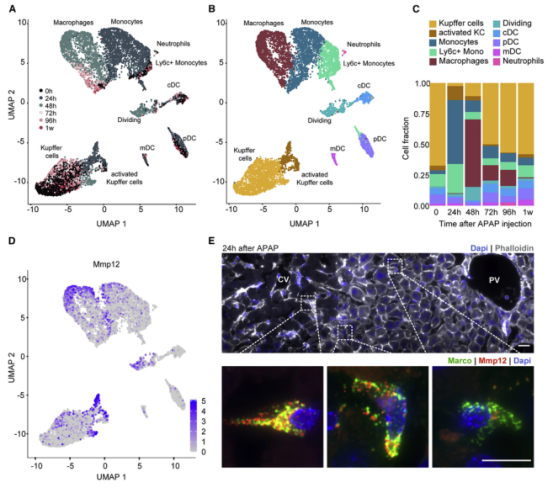
一、肝脏组织再生的细胞图谱 本研究在小鼠体内注射乙酰氨基酚(APAP,急性肝脏损伤诱导剂)后以引发小鼠肝脏损伤模型,并在多个时间点对肝脏进行采样,通过RNA测序(bulk RNA-seq)、单细胞RNA测序(scRNA-seq)、Visium空间转录组学分析以揭示肝脏组织再生的分子机制(图1A)。bulk转录组分析了不同时间点的生物学通路变化、并且利用单细胞数据解卷积bulk数据分析细胞比例的变化,空间转录组分析细胞的位置变化与空间基因特征。通过注射APAP后不同时间点的肝小叶成像发现,大量的中心周围坏死在48小时后达到峰值。损伤的中心周围区域在72小时后出现收缩,出现新的中心周围肝细胞,在96h后完全取代坏死组织(图1B)。 bulk RNA-seq数据的通路分析显示,早期免疫信号的诱导,在APAP后6和24小时达到峰值,增殖通路在APAP后48 h达到高峰。肝脏代谢功能,如谷胱甘肽和细胞色素P450代谢,以及静止的造血干细胞功能,在APAP后72 h重新出现(图S1C)。 本研究从6个时间点(control、24h、48h、72h、96h和1w)的28只小鼠的肝脏中共获得 23944个单细胞,注释为11种细胞类型(包括肝细胞、内皮细胞,肝星状细胞,Kupffer细胞,单核细胞,巨噬细胞等)(图1C1D),利用单细胞数据解卷积bulk数据量化肝脏损伤再生过程中细胞组成比例的动态变化,发现在APAP注射48小时后肝细胞数量显著降低、细胞坏死达到峰值,然而注射96小时后可逆转到正常水平。相反,肝星状细胞,单核细胞和巨噬细胞的数量随着损伤逐渐增加,到注射24-48小时后达到峰值,随后又慢慢恢复到正常水平(图S1D)。Kupffer细胞和内皮细胞在48小时时增殖达到高峰,但并没有出现细胞丰度的增加,提示可能除了肝细胞外,一些Kupffer细胞和内皮细胞在急性损伤期间死亡,并通过增殖来维持数量(图S1E),该分析显示出肝脏基因表达和多种肝细胞类型比例的重大变化,在损伤后4天就迅速恢复到控制水平。 Figure 1. 肝脏组织再生的细胞图谱 Figure S1. 肝脏组织再生过程中的时间动态变化 二、肝细胞再生过程中区域性重编程和跨肝小叶的广泛增殖 中心周围和门静脉周围肝细胞在未受干扰的肝脏中表现出明显不同的基因表达模式,Bulk RNA-seq数据分析表明,肝细胞特异性基因的转录在早期时间点偏离对照,但在注射APAP后96小时恢复到对照水平(图2A)。单细胞数据中包括来自对照、APAP 注射后 48 和 72 小时的 2,770 个肝细胞(图2B)。通过进一步深入分析损伤后肝细胞的转录组和空间转录组数据(图S2H),获得了肝细胞再生过程肝小叶带状分布的不同空间位置的坐标基因,从而将沿肝小叶轴空间分成三个带状区域:中心周围区(pericentral)、小叶中区(midlobular)和门静脉周围区(periportal zones),并重建了肝细胞再生过程的基因空间带状表达图谱。正如预期一样,中心周围肝细胞在48小时被耗尽。在72小时,带状坐标的分布接近损伤前的模式(图2C2D2E2F)。进一步利用单分子荧光原位杂交(smFISH)验证了该肝细胞再生带状图谱的带状基因,如中心区的Glul和Cyp2e1以及门静脉周的Ass1,在损伤再生过程存在明显的带状模式(图2G2H)。 为了研究呈带状分布的不同肝细胞亚群对于损伤再生的增值响应能力是否有差异,使用smFISH定量检测增殖标记物Mki67在其中不同肝细胞中的比例:在整个再生过程中,距离受损组织区域很远的小叶中部和门静脉区的肝细胞呈Mki67阳性(图2I2J)。不同小叶区增殖和非增殖肝细胞之间的差异表达分析表明,增殖肝细胞中的肝细胞代谢功能降低。肝细胞在整个小叶轴的广泛增殖可能有助于产生有丝分裂压力,从而快速替换受损区域的细胞,这种有丝分裂压力将小叶中部肝细胞带入中心周围区,需要对其转录状态进行重编程。 Figure 2. 重建肝细胞再生过程基因空间带状表达图谱 Figure S2. 空间转录组数据集分析 三、界面肝细胞基因表达模式及形态特征 为了进一步研究有丝分裂压力如何将小叶中肝细胞通过重编程带入中心区,本研究继续对注射APAP后48h和72h的中心周围肝细胞及对应区域的对照组肝细胞的转录本做差异分析,这些肝细胞存在于损伤与未损伤界面处,因此命名为“界面肝细胞”,发现这些细胞具有明显的基因表达特征,包括胚胎期肝脏和肝细胞癌中高表达但在成人肝细胞中不表达的基因,例如Afp(编码胎儿血清蛋白的甲胎蛋白),Spp1(编码骨桥蛋白),Cdh17(肝细胞癌中编码与Wnt信号激活相关的钙粘素蛋白)(图3A3B),并使用smFISH来验证这些基因的特异性表达(图3C3D)。通过GSEA分析发现界面肝细胞上调包括核糖体和蛋白酶体在内的通路(图3E)。此外还发现界面肝细胞呈间充质样形状,细长的突起延伸到损伤区,与非界面肝细胞相比,圆形度较低(图3F3G)。这些结果表明,界面肝细胞不会简单地从门静脉周围/小叶中状态转变为中央周围状态,因为它们被推入中央周围区域。相反,其细胞特性的变化与胚胎期基因的瞬时表达、蛋白质翻译和降解的升高以及细胞形态的改变有关。 Figure 3.界面肝细胞基因表达模式及形态特征 四、肝星状细胞(HSC)的空间分工模式 完善的组织再生往往需要组织内部细胞间的高度协作。肝星状细胞(HSC)在肝脏损伤再生过程中也起非常关键的作用。本研究联合前人已发表的单细胞数据集进一步重建了HSC沿肝小叶轴的空间带状分布模式(图4A),发现HSC具有明显的空间分工模式:中心周围区(pericentral)、小叶中区(midlobular)和门静脉周围区(periportal zones)(图4B)。通过与空间转录组数据集比较,验证了HSC基因的时空动力学(图S2I)。肝星状细胞静止基因如视黄醇结合蛋白(Rbp1)和卵磷脂视黄醇酰基转移酶(Lrat)的表达水平在所有区域都下降,并在96小时后恢复到对照水平(图4C)。相反,参与肝星状细胞激活的基因,如平滑肌肌动蛋白基因(Acta2),在20h达到表达高峰,主要在中央周围区的肝星状细胞中表达(图4D)。在APAP诱导的损伤和再生过程中,细胞外基质基因的表达在48h以空间依赖的方式发生了实质性的变化,最显著的是在中心周围的HSCs,与受损区域所需的基质积聚行为相一致(图4E)。肝星状细胞增殖基因在48h达到高峰,且门静脉周围区和小叶中区比中央周围区有更高的表达(图4F)。综上,可以推出中央周围的HSC快速响应APAP诱导的损伤,激活并产生ECM,并与免疫细胞相互作用,而门静脉周围的HSC优先增殖,生成可迁移到受损区以支持主动再生过程的备用HSC。大多数HSC激活配体起源于单核细胞和巨噬细胞、内皮细胞和HSC本身。本研究发现了区域特异性HSC表达模式,这些模式可能促进急性APAP损伤后肝脏表现出的免疫招募、ECM积聚和分解的时间协调过程。 Figure 4. 肝星状细胞的空间分工模式 五、肝脏内皮细胞在再生过程中出现带状分布特征 肝脏内皮细胞是肝功能的重要调节细胞,主要功能是清除内毒素、细菌和其他化合物,调节宿主对病原体的免疫反应以及呈递抗原等。研究表明,与肝细胞和肝星状细胞相似,肝脏内皮细胞同样表现出沿着肝小叶轴呈现带状分布特征。为了进一步研究肝脏内皮细胞亚群支持肝脏再生的机制,本研究将肝脏内皮细胞分成5个带状分布细胞亚群,包括:中心区肝血管内皮(PC-LVECs),中心区、小叶中部和门静脉周肝窦内皮(PC-LSECs, mid-LSECs, PP-LSECs),门静脉周肝血管内皮(PP- LVECs)(图5A5B5C)。并进一步通过空间转录组数据集验证了肝脏内皮细胞的带状空间分布模式(图S2J)。 Figure 5.肝脏内皮细胞在再生过程中出现带状分布特征 六、髓系免疫细胞亚型在再生过程中的动态变化 髓系细胞同样在急性肝损伤后的再生过程中发挥着重要作用。本研究鉴定了10种不同的髓系免疫细胞类型,其中单核细胞比例在24小时达到峰值,而巨噬细胞在48小时达到峰值,提示该巨噬细胞分化来源于单核细胞。Kupffer细胞和单核细胞在所有时间点都形成不同的细胞亚群,表明急性肝损伤过程死亡的Kupffer细胞是通过存活的Kupffer细胞的增殖而被替代,而不是来源于单核细胞(图6A6B6C)。 在激活的Kupffer细胞中上调最多的基因是Mmp12(编码弹性蛋白酶基质金属肽酶12的基因),Mmp12在24小时的表达水平是对照组的637倍,值得注意的是,Mmp12在巨噬细胞中也表现出上调的情况(图6D)。当使用smFISH对MMP12的表达进行成像时,发现它在位于损伤区域的髓系细胞中表达(图6E)。 Figure 6. 髓系免疫细胞亚型在再生过程中的动态变化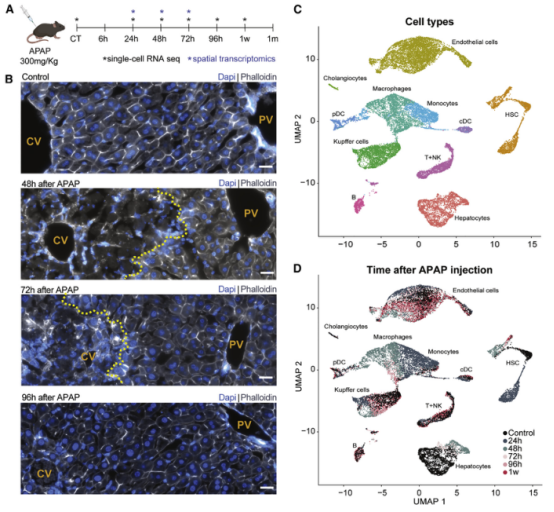
研究总结
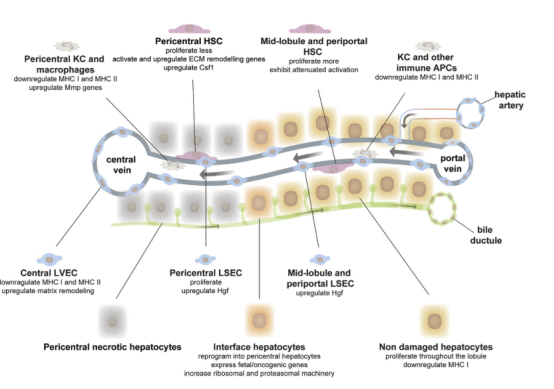
肝脏组织再生可通过多种细胞类型精准的协调来实现。本研究利用单细胞分析手段研究了小鼠肝脏急性损伤后再生过程的细胞时空动态调控过程。发现肝细胞在肝小叶内增殖,产生有丝分裂压力,使坏死的中心区迅速再生。位于再生界面的部分肝细胞会在重新编程到中心周围状态过程中,短暂上调胚胎特异性基因。而空间带状分布的内皮细胞、肝星状细胞(HSC)和巨噬细胞群体在免疫募集、增殖和基质重塑中存在差异。其中可观察到大量的暂时性骨髓细胞浸润,但淋巴细胞丰度与抗原呈递能力整体都呈现下降趋势。本研究促进了人类理解肝再生过程的区域性协调过程(图7)。 Figure 7. APAP诱导的肝损伤和再生过程总结