
2022-10-13
一、研究背景
冠心病驱动的急性心肌梗死是心血管死亡的最大原因,而心血管死亡又是全世界范围内人类死亡的主要原因之一。心肌梗死的急性治疗方面目前已有实质性进展,主要集中在经皮冠状动脉介入治疗以降低急性死亡率。然而,心肌梗死后左心室心脏重构引起的发病率和死亡率仍然高得令人无法接受。了解从急性缺血事件到慢性心脏瘢痕形成的心脏重构过程的确切细胞和分子机制将是开发新的治疗方法的关键。 在多细胞器官中,如人类心脏,正常的细胞功能和组织稳态依赖于邻近的单个细胞类型之间的相互作用。单细胞技术可以描述不同细胞类型的分子异质性和在疾病期间发生的变化。然而,在没有空间背景的情况下,尚不清楚这些不同类型的细胞如何在空间中相互作用以协调组织功能。
二、实验材料 总计来源于23个患者的31个样本用于后续实验和分析,其中包括4个来源于非移植供体心脏的对照组样本以及来源于急性心肌梗死患者的临床症状后不同时间点的27个样本,其中包括急性期的12个坏死中心(缺血区,IZ)样本、3个邻近区域(边界区,BZ)样本、6个未受影响的左心室心肌(偏远区,RZ)样本和6个心肌梗死后期的纤维化区域(FZ)样本。 冷冻心脏样本组织进行10µm的冷冻切片做10x Visium 空间转录组;剩余冷冻组织提核并使用细胞核荧光分选技术(FANS)获取用于snRNA-seq和snATAC-seq的细胞核样本。过滤掉低质量细胞核后,用于snRNA-seq的细胞核共有191795个,平均每个细胞核有2020个基因;用于snATAC-seq的细胞核共有46086个,平均每个细胞核28066个片段;空间转录组数据集中共有91517个spots,平均每个样本有3389个spots,每个spot有2001个基因,组织学定量检测显示平均每个spot中含有4个细胞核。
三、研究思路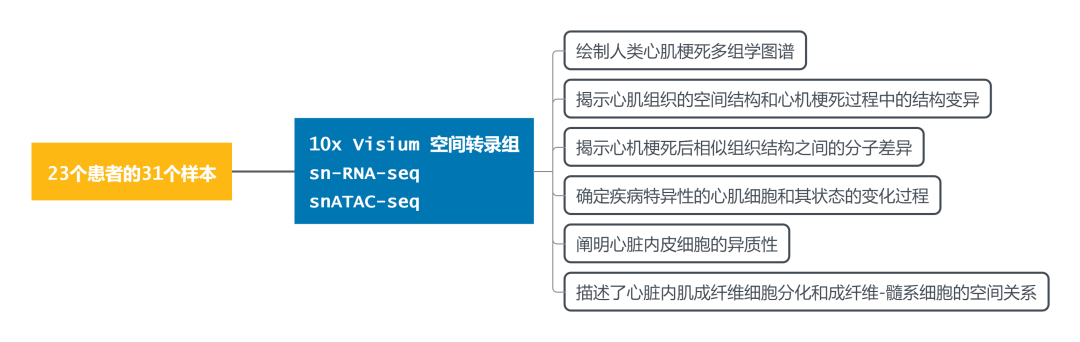
四、研究结果
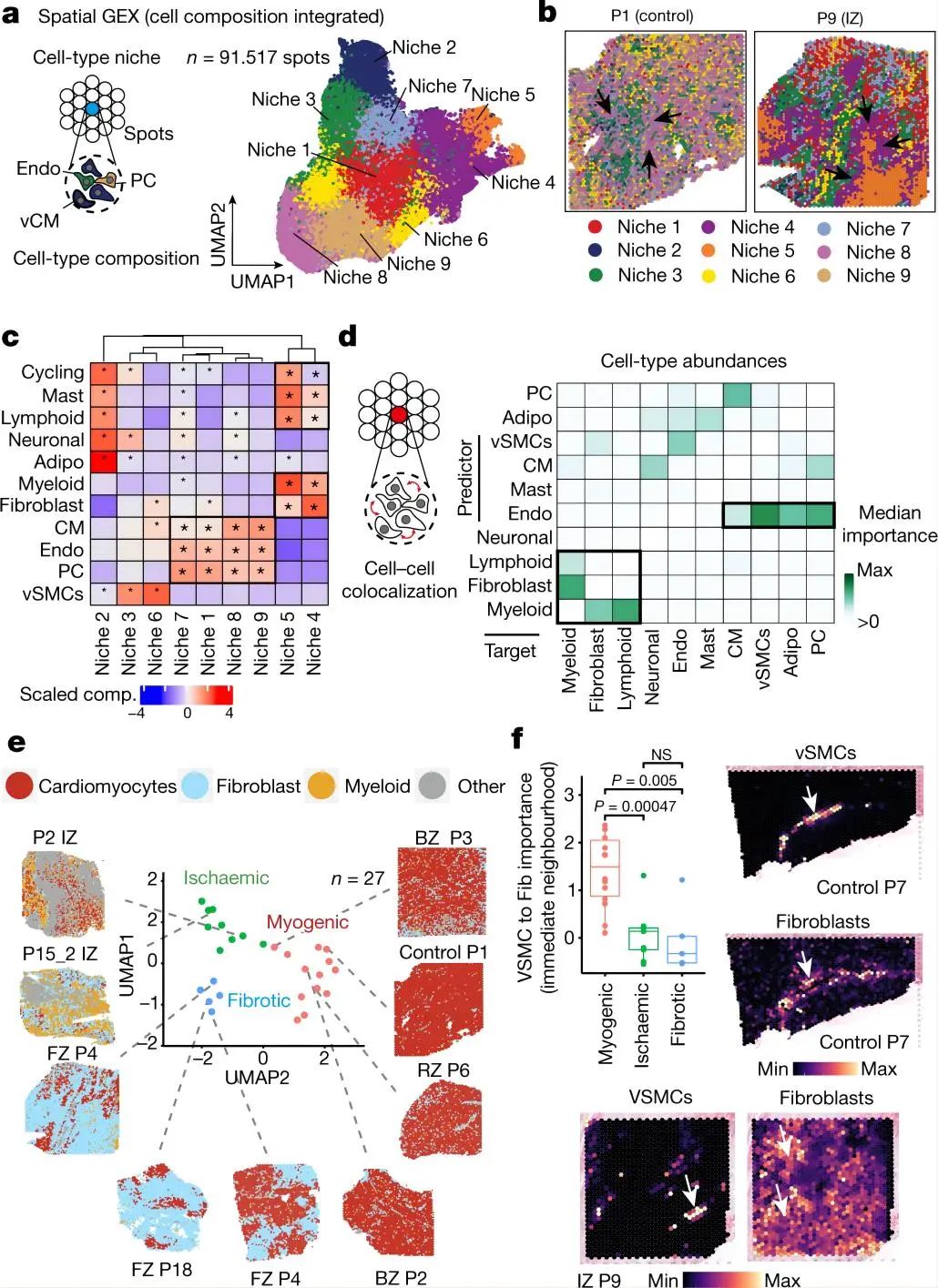
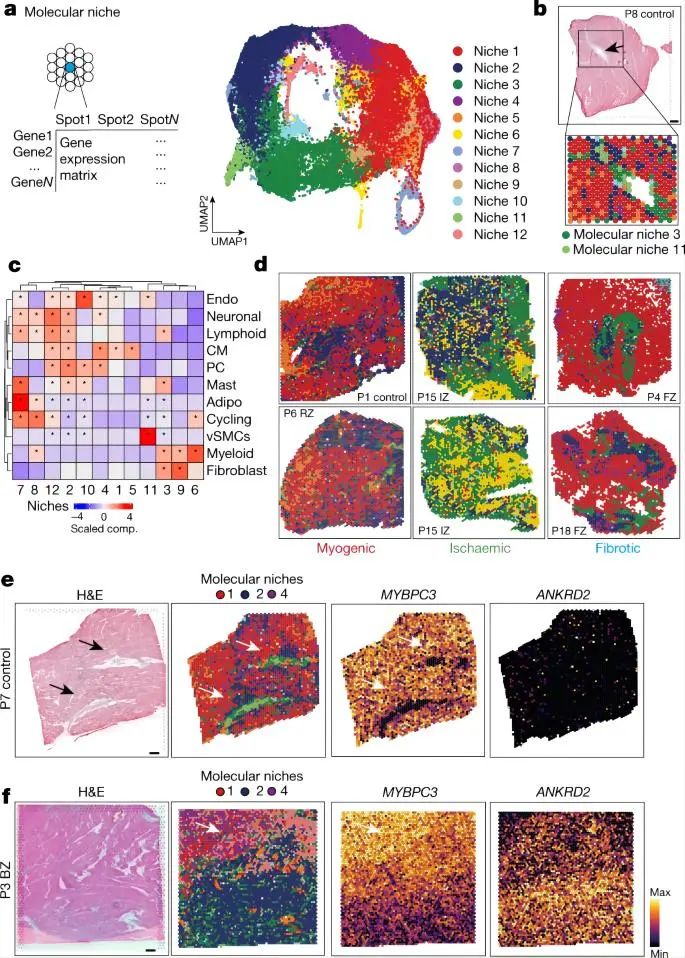
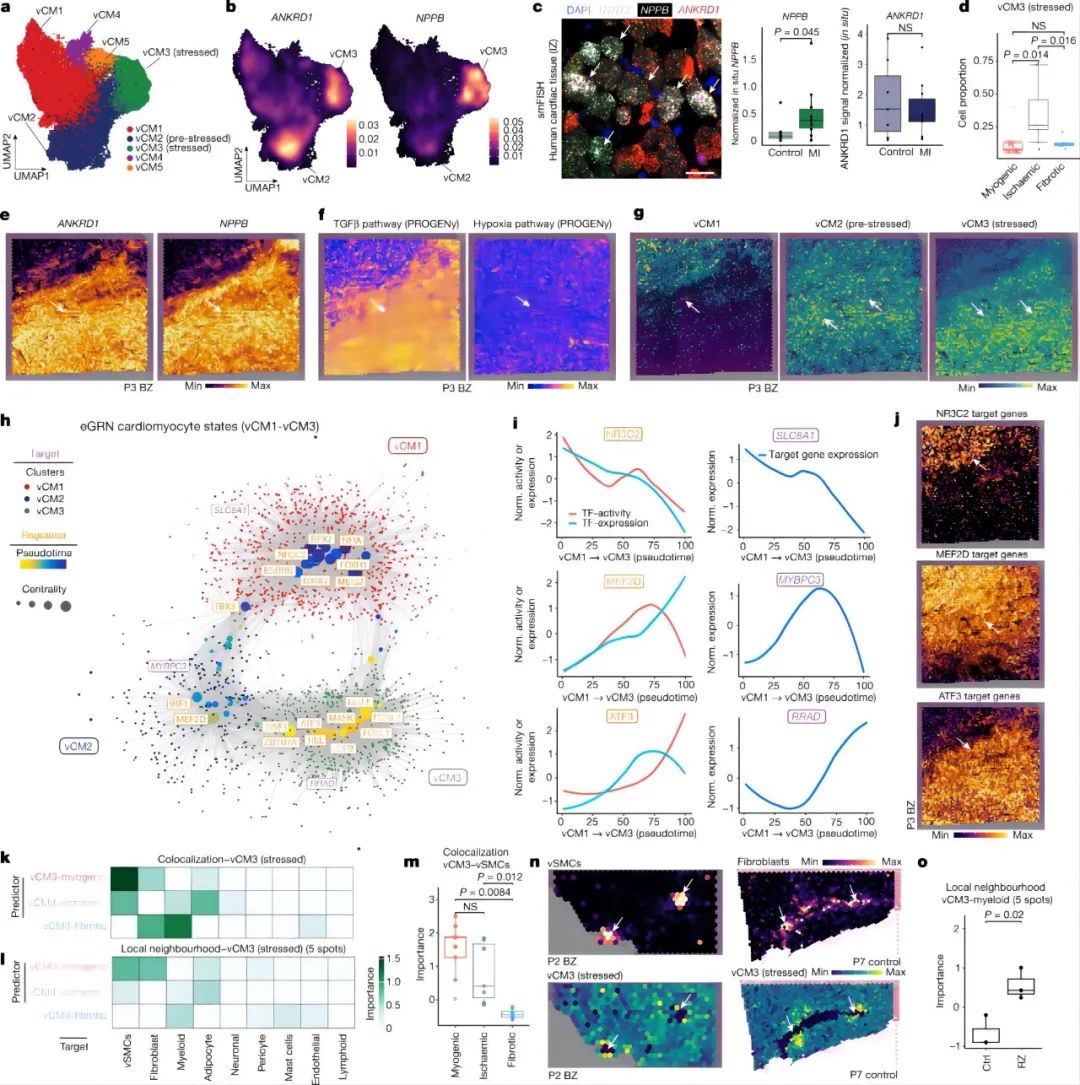
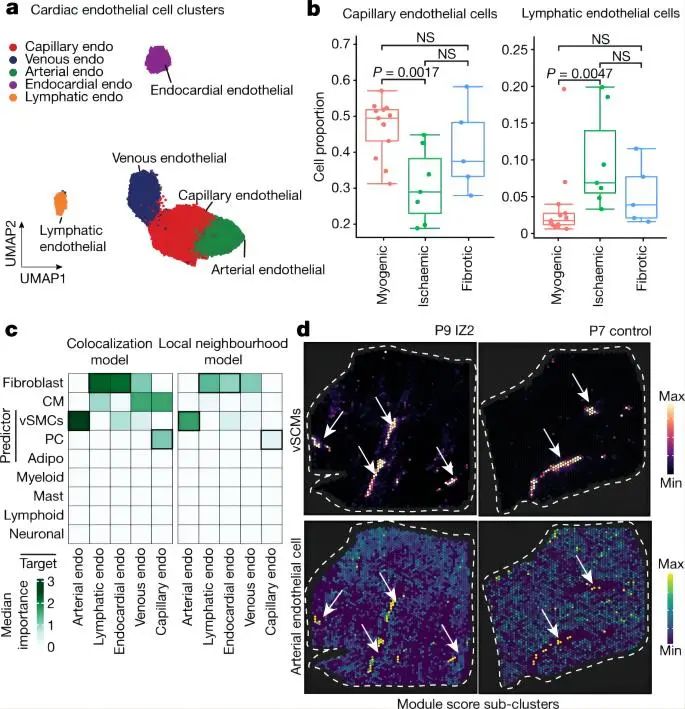
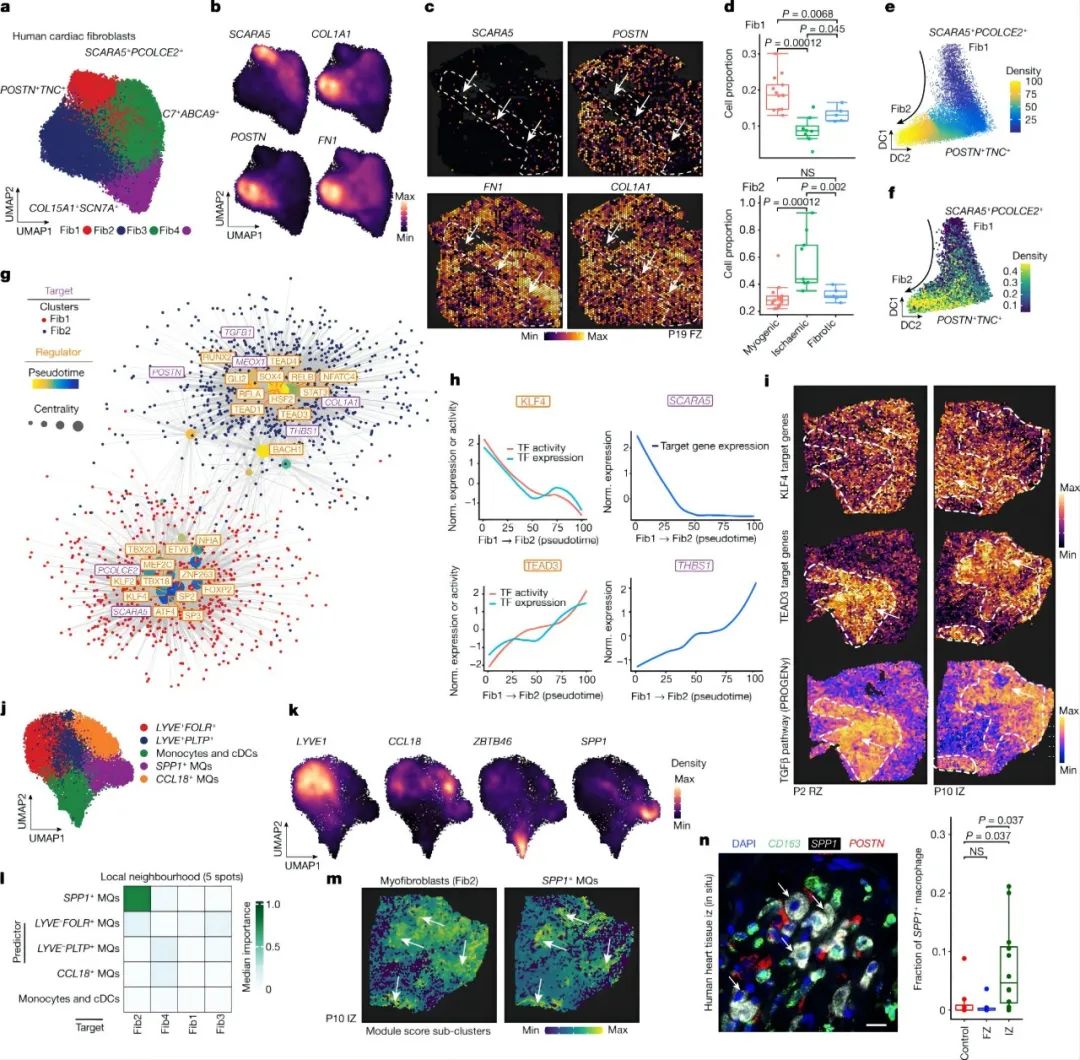
4.1 snRNA-seq和snATAC-seq和空间转录组绘制人心机梗死图谱 作者使用snRNA-seq数据对细胞进行聚类和注释,鉴定到10种主要的心脏细胞类型以及1个富含细胞周期marker基因 MKI67的细胞群。类似的,作者也对snATAC-seq数据进行聚类和注释,鉴定了8种主要的细胞类型,除了两种罕见的细胞类型(即肥大细胞和脂肪细胞)外,其余细胞类型与snRNA-seq数据相匹配。这说明两种模式之间的注释是一致的,且snRNA-seq和snATAC-seq之间的细胞组成存在高度相关性。 接下来,作者对空间转录组数据也进行了分析。首先使用空间可变基因确定了每个主要组织形态学区域(对照组、偏远区、边界区、缺血区和纤维化区)的过表达的生物过程,包括对照组和偏远区域的心肌细胞收缩、缺血区域和邻近区域的自适应免疫过程、以及纤维化区域的生成过程。其次,作者根据来自同一样本的snRNA-seq数据对空转数据进行了解卷积,用PROGENy方法从空间基因表达数据中评估每个spot的信号通路活性。通过将空间定位的通路活性与对应位置的细胞丰度进行比较,可以将空间细胞组成信息与细胞功能联系起来。最后,作者又将从snATAC-seq数据中获得的信息映射到空间,获得了基于空间分辨率的转录因子结合活性印迹,例如与心肌细胞相关的转录组因子 MEF2C 基因、髓系细胞相关的 CEBPD 和 ATF1 基因等、成纤维细胞相关的 FOS-JUNB 基因、血管平滑肌相关的SRF基因等。 综上,作者通过多组学数据绘制了一个包含细胞类型丰度、信号通路活性、转录因子结合活性和GWAS信号的图谱,为人类心肌梗死后的组织重塑过程提供了一个深入研究的视角。 Fig. 1 | Spatial multi-omic profiling of human myocardial infarction. 4.2. 心肌组织的空间结构和心肌梗死过程中的结构变异 作者对所有样本的spots的细胞组成类型采用无监督聚类分群得到了9个细胞类群,并将他们定义为主要的细胞类型生态位(niches),并发现一些niches与所在的样本状态非常相近,例如niche 8在对照样本玻片平均分布,而niche 5则定位于缺血区的特定位置。然后,作者检测了来自snRNA-seq的注释细胞类型在所有niches中的表达情况,并观察到4个肌原细胞类型生态位。 接下来,为了测试spot内主要细胞类型的丰度是否可以通过其邻近空间区域的细胞类型组成来预测,作者使用MISTy评估了三种不同大小的邻近区域:(1)一个spot内(共定位)(2)临近区(半径为1个spot),(3)扩展区(半径为15个spots)。结果显示,内皮细胞最能预测所有spot内的vsmc、周细胞、脂肪细胞和心肌细胞的丰度,这可能反映了血管系统的细胞类型之间的依赖性。淋巴细胞和髓系细胞在免疫细胞浸润和炎症区域之间表现出强烈的依赖性—都同样被细胞类型的生态位niche 5捕获。值得注意的是,髓系细胞和成纤维细胞之间有很强的依赖性,二者共同在niche 4中强烈共富集,这与已知的巨噬细胞在成纤维细胞激活和成纤维细胞在巨噬细胞吸引中的关键作用一致。在临近区和扩展区之间,心脏血管相关的细胞(vsmc、内皮细胞、周细胞和成纤维细胞)之间有更强的依赖性,这表明心肌血管网络主导着心脏组织结构。 为了探究心肌梗死过程中的结构变异,作者将样本分为3个主要的样本组:肌原性富集组(包括对照组、边界区和偏远区)、纤维化富集样本(包括所有纤维化区样本,除一个除外)和缺血富集样本(包括所有缺血区样本)。接下来,作者分析了不同样本组间细胞类型的组成差异、空间依赖性差异和细胞类型生态位差异。结果表明,空间转录组数据与主要的组织形态学样本注释和捕获心肌梗死后的组成特征相一致。阐明了心脏血管系统在定义整体心肌结构和成纤维细胞以及髓系细胞的独特的空间依赖性方面的重要性,这有助于获得疾病特异性空间组织重构的分子见解。 Fig. 2 | Characterization of tissue organization using spatial transcriptomics data. 4.3 心肌梗死后的分子差异 为了研究相似组织结构之间的分子差异,作者基于基因表达的spots聚类产生了一组分子生态位(niches)。鉴定得到了12个分子生态位,包括与炎症和纤维化过程的niche 3,6和9 ,vSMC 相关的niche 11和肌源性区域相关的niche 1,2,4,5和12等。富含心肌细胞的分子niches在缺血性富集的样品中被耗尽,而纤维化和炎症的分子niches在富含肌原性的样品中被耗尽。分子niche 1,2和4具有不同的分子特征,这三个分子生态位主要富集在心肌细胞中。此外,分子生态位使我们能够区分边界区、偏远区和对照样本,而主要细胞类型生态位无法区分。总体而言,分子niche 1在对照和偏远区样本中富集,niche 2在边界区样本中的受损组织区域富集 ,表明这些组之间也可能存在心肌细胞表型和功能的差异。 Fig. 3 | Characteristic tissue structures inferred from spatial transcriptomics data. 4.4 疾病特异性的心肌细胞状态和其状态的可变性 为了了解心肌梗死后心肌细胞的分子异质性,将来自心肌细胞的snRNA-seq和snATAC-seq数据进行整合并降维聚类,揭示了心室心肌细胞的五种细胞状态(vCM1-5)。差异基因表达分析显示,在vCM2和vCM3中,ANKRD1均显著上调,而 NPPB 在 vCM3中显示出明显的上调和染色质开放度增加,并通过单分子荧光原位杂交(smFISH)验证了这个结果。样本组间的细胞组成比较显示,vCM1与肌原性富集样本相关,而vCM3与缺血富集样本显著相关。这在一个使用原位杂交的独立队列中得到了验证,表明这些心肌细胞状态代表了急性心肌梗死期不同的细胞应激状态(即vCM1,“非应激”;vCM2,“预应激”;和vCM3,“应激‘”)。 因为边界区的空间重构与心脏功能的恢复作用密切相关,作者查看了边界区样本vCM marker基因的表达情况,发现ANKRD1 和 NPPB 在空间中具有广泛异质的基因表达模式。对空间基因表达数据的通路分析表明,损伤区域(右下)内的TGFβ信号活性增加,但缺氧通路活性分布均匀。边界区样本细胞状态和空间和空间位置的映射结果显示,vCM1只位于左上角,vCM2位于中间区域,作为一个从受伤向远程心肌的过渡区,vCM3主要位于过渡区在受伤区域。值得注意的是,在另一个边界区样本中也观察到这种空间分布模式,显示出类似的重构过程。 接下来,作者将 snATAC-seq 和 snRNA-seq 数据之间的细胞配对,并研究了从 vCM1到 vCM3的细胞连续体的基因调控变化,构建了一个基于增强子的基因调控网络(eGRN)。基于此网络,作者发现盐皮质激素受体( NR3C2 )作是 vCM1状态的主要调节因子。随着vCM1至 vCM3分化在拟时序上的推进,转录因子结合活性和基因表达降低,而 NR3C2 的靶基因也显示表达降低,这些靶基因在邻近区域与vCM1状态保持一致。同时作者还观察到与心肌细胞分化预应激阶段相关的转录因子(TBX3和MEF2D)。对于vCM3(应激心肌细胞),作者鉴定出ATF3是GTPase和Ca2+调节基因RRAD的调控因子。 进一步的分析发现,在肌源性和缺血样本中,vsmc在预测vCM3方面的重要性增加,而成纤维细胞和髓系细胞在纤维化样本中有更大的作用(图4k)。vCM3的局部邻域模型显示,与纤维化样本相比,成纤维细胞的丰度更好地解释了肌源性样本中的 vCM3。综上表明,应激心肌细胞 vCM3可以在富集了vSMC,成纤维细胞,脂肪细胞或髓样细胞等组分的不同的邻近空间区域中找到。 Fig. 4 | Sub-clustering of cardiomyocytes 4.5 心脏内皮细胞的异质性 snRNA-seq 和 snATAC-seq 数据的联合分析鉴定了来自血管床的5种内皮细胞亚型,包括毛细血管内皮细胞,动脉内皮细胞,静脉内皮细胞,淋巴和心内膜内皮细胞。对肌原性富集、缺血富集和纤维化富集样本中的细胞比例进行分析显示,缺血样本中的毛细血管内皮细胞减少与静脉内皮细胞的一致增加有关。此外,淋巴管内皮细胞在缺血区域显著增加,表明在心脏损伤后调节免疫应答的淋巴管丰度增加。总之,本部分内容解析了所有主要的内皮细胞状态,并将它们定位在空间中,描述了它们的空间依赖性。此外,还发现了一个在毛细血管内皮细胞中具有复杂代谢和信号变化的空间生态位。 Fig. 5 | Sub-clustering of endothelial cells. 4.6 心脏内肌成纤维细胞分化和成纤维-髓系细胞的空间关系 为了分析人类心脏纤维生成的分子和细胞机制,我们使用整合的snRNA-seq和snATAC-seq数据对所有成纤维细胞进行了聚类,并注释确定了4个亚群(Fib1-4)。空间转录组数据marker基因的可视化结果表明,Fib1和Fib2在损伤后心脏互斥区域富集。此外,我们观察到Fib1在肌原性富集样本中所占比例最高,而Fib2(肌成纤维细胞)在缺血样本中显著富集,Fib3在缺血样本中则略有减少。 PDGFRβCreER-tdTomato小鼠的谱系追踪实验和scRNA的数据分析结果表明,随着时间的推移,Fib2群体、胶原蛋白和ECM基因总体增加,而Fib1比例下降,表明小鼠从SCARA5+成纤维细胞(Fib1)向肌成纤维细胞(Fib2)的分化轨迹,ECM富集评分增加进一步支持了这一观点。为了了解这些基质细胞分化过程的调节机制,作者推断出一个成纤维细胞 eGRN 。该 eGRN 包含两个模块,每个模块对应于不同的成纤维细胞状态 。并基于此网络确定了肌成纤维细胞分化的潜在调节因子,如调节 Fib1模块的转录因子KLF4,调节Fib2模块的转录因子TEAD3等。 为了了解髓系细胞在心肌梗死后的心脏重塑中的作用,作者对所有心肌梗死样本中的髓系细胞进行分群注释,得到了5个亚群,并使用三个急性人心肌梗死样本的独立snRNA-seq数据集作为验证参考,确定基于标记基因表达的髓系细胞群具有很高的一致性。细胞比例分析显示,在缺血样本组中,由SPP1表达定义的巨噬细胞群体丰度增加,而CCL中18+巨噬细胞在纤维化样本中增加。作者使用空间转录组学数据模拟了它们marker基因的表达,并观察到与其他骨髓细胞状态相比,SPP1 + 巨噬细胞能更好地预测所有肌成纤维细胞状态,在单个spot内和邻近区域具有更高的重要性。为了验证 SPP1+巨噬细胞与 Fib2的空间相互作用,作者使用独立组织队列(n = 26名患者)的人类心肌梗死后的心脏组织进行了 RNA 原位杂交实验,并使用正交方法证实了SPP1+巨噬细胞与 Fib2在空间上的相互作用和富集。综上所述,该部分结果解码了成纤维细胞和髓系细胞的异质性以及纤维-髓系细胞状态的空间模型,揭示了SPP1+巨噬细胞与肌成纤维细胞在人类心脏组织重构的不同阶段的独特相互作用。 Fig. 6 | Characterization of mesenchymal–myeloid interaction.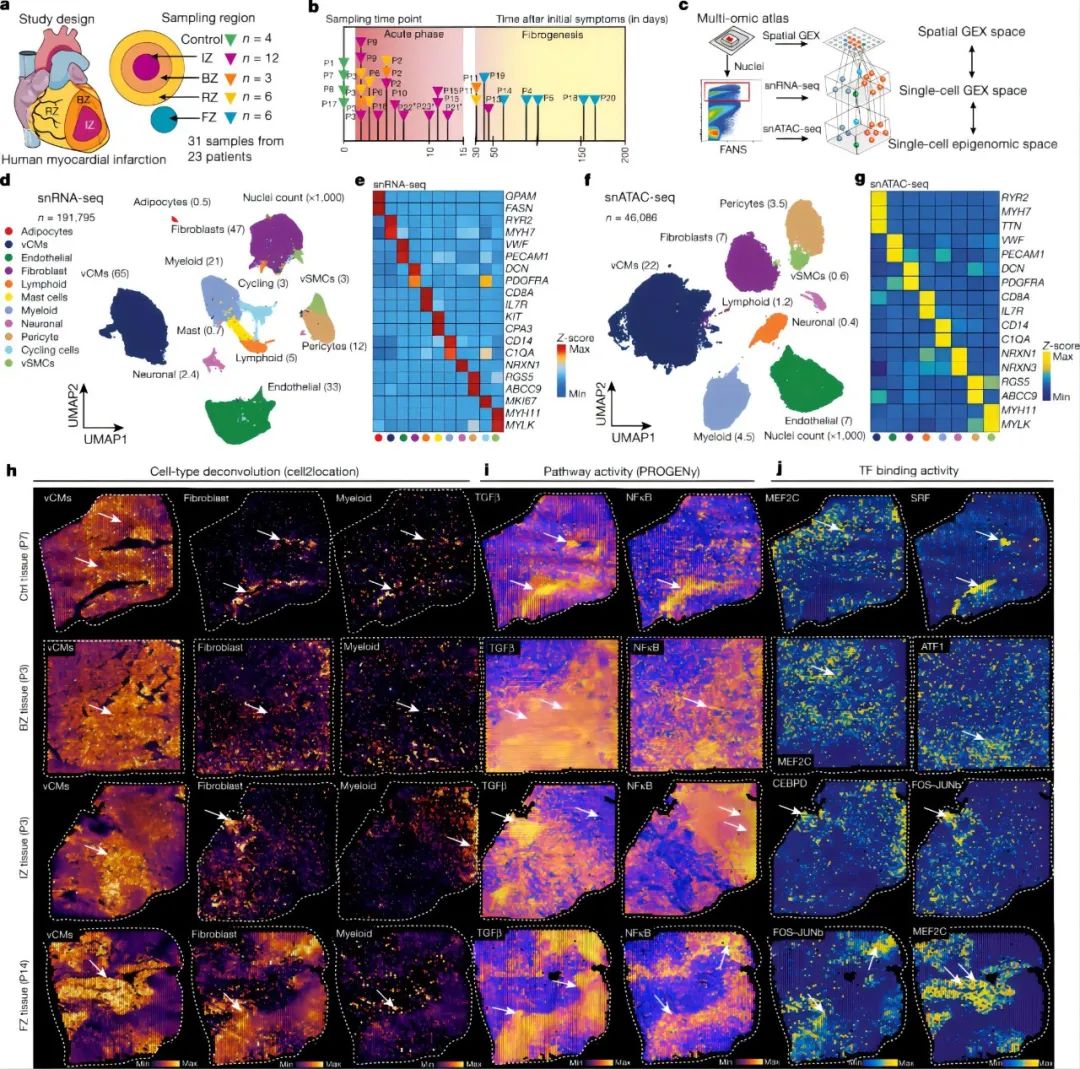
五、研究结论
在这里,作者通过整合空间转录组学、单核基因表达和染色质可及性数据,以更高的分辨率评估心脏细胞类型组成,通过识别损伤、修复和重塑的不同组织结构,深入了解心脏转录组和表观基因组的变化。同时还鉴定并验证了主要细胞类型的疾病特异性心肌细胞状态,并在其空间背景下分析了它们,评估了它们对其他细胞类型的依赖性。此外还描述了成纤维细胞向肌成纤维细胞分化从而驱动心脏纤维化的机制。综上,本研究提供了一个关于人类心肌梗死的整合分子图谱,为人类心肌梗死研究提供了重要的参考,并为心脏疾病的先进机制和治疗性研究铺平了道路。