2022-12-01

思路
介绍
帕金森(PD)是在老年人群中继老年痴呆症(AD)后的第二大精神退行性疾病,帕金森病的特征是黑质多巴胺能神经元的丧失。导致严重的进行性运动障碍,包括运动迟缓、休息性震颤、僵硬和各种非运动症状,如情绪障碍,影响与冷漠,和认知功能障碍。全世界有超过1000万人患有PD, 80%的PD患者最终会发展成痴呆。 越来越多的证据表明,免疫失调在PD的疾病进展中发挥了关键的作用,包括与自身免疫疾病、细胞和体液免疫功能障碍的临床和遗传联系,PD实验模型中炎症细胞激活和免疫调节障碍的影像学证据。这一复杂的疾病可能起源于自身的免疫紊乱,尽管已有大量文献,但许多问题仍未得到解决。一方面,有研究表明PD患者的外周血中存在T细胞比例的变化,但每个细胞亚型对疾病病因的相对贡献仍不清楚;另一方面,据报道,CD8+和CD4+ T细胞在死后人PD标本和PD小鼠模型中都能侵入大脑,但人外周血和脑脊液中T细胞亚型的组成和相互作用以及它们渗入中枢神经系统的潜在能力尚不清楚。 单细胞测序是揭示复杂器官异质性的一把利刃,单细胞转录组能提供每个细胞的表达谱,单细胞TCR测序能提供每个细胞的TCR序列,相同的TCR序列暗示了T细胞的克隆扩增模式和T细胞谱系,这对识别由主要组织相容性复合体(MHC)呈现的内源性和外源性抗原至关重要。最近,单细胞转录组和TCR测序被应用于分析阿尔茨海默病和多发性硬化症患者的免疫细胞,揭示了T细胞的扩增特征及其与神经系统炎症的关系。淋巴细胞的大规模单细胞测序可能有助于我们更好地了解PD的适应性免疫反应。 本研究联合了单细胞转录组和TCR测序来系统的描述PD患者的外周血和脑脊液中T淋巴细胞的组成,功能和谱系之间的关系。总共从103,365个T细胞中鉴定出21个具有不同功能的T细胞亚群。对单细胞基因表达和TCRs的综合分析揭示了这些亚型的连通性和潜在分化轨迹,并提供了PD患者血液和脑脊液中巡逻的T淋巴细胞克隆扩增的新证据。这种空前大规模的T细胞转录组和免疫分析数据可作为研究PD基本特征的宝贵资源,并可能指导有效的免疫治疗策略。
结果
1. PD患者和健康对照组T细胞的单细胞转录组和TCR测序 我们对PD患者血液和脑脊液中T细胞的单细胞转录组和TCR谱进行了全面分析。采集8例PD患者和6例健康对照者的新鲜血液样本。用流式细胞术对CD3+ T细胞进行分类,在10×平台(10× Genomics, CA, USA)上制备单细胞5’基因表达和V(D)J文库。另外7个健康对照的单细胞数据集从公开的数据集下载。此外,我们还比较了脑脊液中公开的单细胞免疫分析数据集,包括6名PD患者和9名健康对照,以更好地了解PD中淋巴细胞T细胞的克隆扩增。我们总共获得了103,365个T细胞的单细胞转录组数据和113,690个T细胞的单细胞TCR测序数据,其中84,384个细胞同时具有基因表达和TCR谱数据。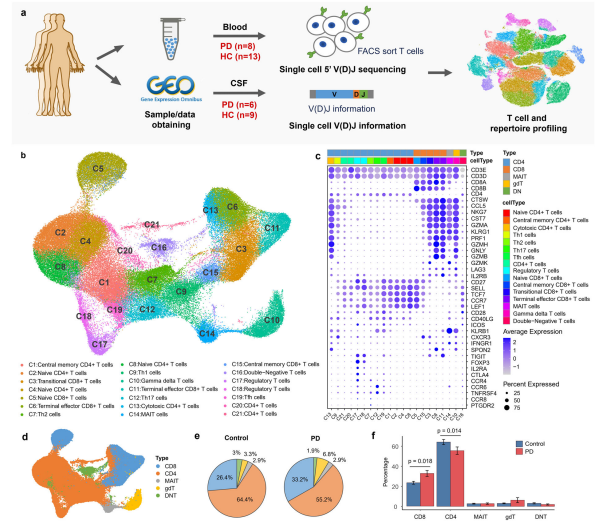
2. PD中T细胞表现出特定的组成和转录组 识别出21个不同的集群,代表不同的细胞类型,包括11个集群的常规CD4+ T细胞,2个集群的调节性CD4+ T细胞,5个集群的CD8+ T细胞,1个gamma delta T细胞集群,1个MAIT细胞集群和1个双阴性T细胞集群。通过评估经典标记基因的表达及其与纯化的bulk RNA-seq数据集的表达相似性,注释细胞类型。主要包括5种细胞类型,包括CD8+ T细胞(CD8)、CD4+ T细胞(CD4)、黏膜相关不变T细胞(MAIT)、伽马δ T细胞(gdT)和双阴性T细胞(DNT)。 对于CD4+ T细胞,3个聚类(C2、C4和C8聚类)被注释为naïve CD4+ T细胞,其特征为naïve T细胞标记SELL、CCR7、TCF7和LEF1;通过与纯化免疫细胞的海量RNA-seq数据集的相关性分析,将C1、C9、C7、C12和C19分别注释为中央记忆CD4+ T细胞、经典的Th1、Th2、Th17和Tfh细胞。C13被注释为细胞毒性CD4+ T细胞(CD4 CTL), CD4和细胞毒性基因GZMA、GZMB、PRF1和NKG7高表达;C17和C18被注释为高表达Treg标记FOXP3、CTLA4、TIGIT和IL2RA的调节性CD4+ T细胞;由于证据不足,C20和C21未被指定为特定的CD4+ T细胞类型。 对于CD8+ T细胞,C5簇被注释为naïve CD8+ T细胞,高表达naïve细胞标记SELL, CCR7, TCF7和LEF1;2簇(C6和C11)被注释为末端效应CD8+ T细胞,其特征为效应标记物,如GZMA、GZMB、PRF1、NKG7;C3簇被注释为高表达过渡标记基因GZMK的过渡CD8+ T细胞,C15簇被注释为高表达CD27、SELL和CCR7的中央记忆CD8+ T细胞(TCM)。 其余T细胞形成3个簇,其中gamma - delta T细胞簇1个,MAIT细胞簇1个,双阴性T细胞簇1个。C10标记为Vd2 γ δ T细胞,其中93%的细胞高表达TRDV2和TRGV9基因,93%的细胞未检测到αβTCR。总的来说,来自C10的69%的细胞被纯化的大量RNA-seq数据集注释为Vd2 gd T细胞。C16被注释为双阴性T细胞,其中超过60%的细胞既不表达CD4也不表达CD8,C14以TCRα链中TRAV1-2和TRAJ33基因片段重组比例的绝对优势被注释为MAIT细胞;相关分析也显示与纯化的MAIT细胞最相似。 为了了解PD患者是否遵循报道的T淋巴细胞变化10,我们比较了PD患者和健康对照组血液中CD4+ T细胞和CD8+ T细胞的比例。在我们的单细胞转录组分析中,PD患者血液中CD8+ T细胞的比例明显高于健康对照组(T检验,p值= 0.018),而CD4+ T细胞的比例明显低于健康对照组(T检验,p值= 0.014)。PD患者的总CD4/CD8比值(比值= 1.66)明显低于健康对照组(比值= 2.44)(t检验,p值= 0.0048)。已发表的研究表明,健康成人外周血中CD4/CD8比值约为2:1,比值的改变表明疾病与免疫缺陷或自身免疫相关。CD4/CD8比值显著降低可能提示PD患者存在免疫紊乱。
3. PD患者血液和脑脊液中克隆扩增的T细胞 为了深入了解PD中T细胞的克隆扩增,我们对PD患者和健康对照组的scTCR-seq数据进行了比较分析。TCR α-链和β-链CDR3序列相同的细胞被定义为相同的克隆型。我们从单细胞TCR测序数据中检测到113,690个细胞,形成87,832个独特的克隆型,其中4458个克隆型包含至少两个细胞,表明T细胞克隆扩展。PD患者血液中的T细胞多样性明显低于健康对照组(T检验,p值= 6.87E−3)。与健康对照组相比,PD患者具有相同克隆大小的克隆型数量显著增加(100个随机抽样试验,中位p值= 5.98e−7)。这些结果表明PD患者血液中存在T细胞克隆扩增。 在脑脊液中,PD患者的T细胞多样性较健康对照组略有降低,统计学p值不显著,这可能与检测细胞数量少、样本数量少有关(T检验,p值= 0.076,补充图S2a)。然而,与健康对照组相比,PD患者脑脊液中具有相同克隆大小的克隆型数量显著增加(100例随机抽样试验,中位p值= 6.25e−3)。PD患者脑脊液中克隆大小为> 2的T细胞比例明显高于健康对照组(T检验,p值= 0.033)。这些结果表明,PD患者的脑脊液中也存在T细胞克隆扩增。 克隆扩增的T细胞广泛分布在每个簇中,特别是CD8+ T细胞,每个血液样本中按克隆大小分布的T细胞组成(NA, = 1,≥2,≥20,≥100,NA表示这些细胞中未检测到TCR)。与健康对照组相比,PD患者血液中克隆大小≥2和≥100的T细胞百分比显著增加(T检验,P值分别为0.0030和0.0074)。我们观察到,每个样本中的细胞类型组成因克隆大小而不同。scTCR-seq中检测到的不含αβTCR的T细胞主要为Vd2 gd T细胞,而只含一个细胞的克隆型主要为naïve CD4+ T细胞。较大的克隆型细胞类型分布不均匀,过渡和终末效应因子CD8+ T细胞富集。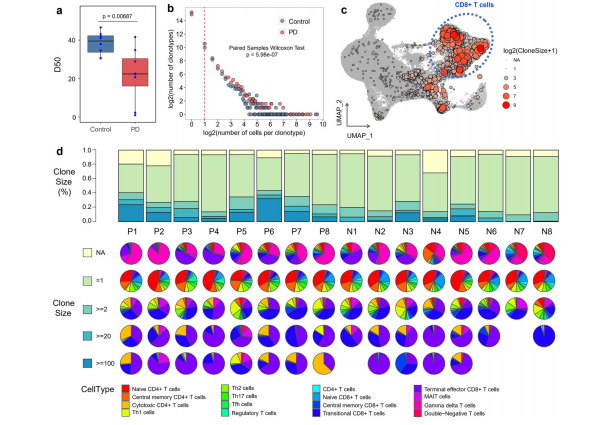
4. CD8+ T细胞的克隆连锁在PD中形成了一个梯度的转录状态 我们对所有PD患者和健康对照组的CD8+ T细胞进行了深入分析。有趣的是,PD患者血液中CD8+ T细胞表现出不均匀的功能状态分布,显著富集的终端效应CD8+ T细胞(C6簇,T检验,FDR = 0.015), 耗竭的naïve CD8+ T细胞(C5簇,T检验,FDR = 0.012)。在这5个CD8+ T细胞簇中,标记基因的表达明显波动,终端效应CD8+ T细胞表现出更广泛和更高的细胞毒性基因表达。Fisher确切检验显示PD患者克隆扩增的T细胞明显富集过渡性和终末效应因子CD8+ T细胞,尤其是C3和C6簇(Fisher确切检验,FDR分别为1.10e-46和1.02 -8)。 为了进一步了解CD8+ T细胞簇之间的关系,我们使用扩散图在伪时间轨迹上可视化这些细胞,有趣的是,第一个扩散成分将中央记忆细胞从活化的CD8+ T细胞中分离出来,并与细胞毒性相关基因(如GZMH、PRF1、FGFBP2)以及调节细胞迁移和粘附的蛋白(如CX3CR1和ADGRG)高度相关。第二个扩散组分显示末端效应因子CD8+ T细胞的两个不同分化方向。上层分支(C6簇)与细胞粘附蛋白ITGAM、ITGB1、组织驻T细胞转录调节蛋白ZNF683(编码Hobit)高度相关,下层分化分支(C11簇)与杀伤样受体KLRC3、KLRF1、杀伤细胞免疫球蛋白样受体KIR2DL3、KIR3DL2高度相关。 为了进一步了解末端效应因子CD8+ T细胞之间的功能差异,我们分析了上分化分支和下分化分支(C6和C11簇)之间的差异表达基因。上支(C6簇)高表达细胞粘附和迁移基因,如ITGAM、ITGB1、CD226和S100A4;T细胞活化和增殖标志物,如CD52和S100A6;和组织驻留T细胞转录调节蛋白ZNF683 (Hobit)。KEGG通路分析结果显示,C6上调基因与细胞粘附分子(KEGG: hsa04514, FDR = 0.0015)和白细胞跨内皮迁移(KEGG: hsa04670, FDR = 0.0047)高度相关。这表明这些细胞可能参与了组织免疫。与细胞存活和细胞毒功能相关的基因如PRSS23、SPON2和ZNF683 (Hobit)也在C6簇中高表达。低分支(C11簇)高表达基因富集于自然杀伤细胞介导的细胞毒性途径(KEGG: hsa04650, FDR = 2.78e−10),包括杀伤样受体KLRC3、KLRF1和KLRB1以及杀伤细胞免疫球蛋白样受体KIR3DL1、KIR3DL2和KIR2DL3。这组CD8+ T细胞的功能更像非经典的NKT细胞。 此外,从扩散轨迹中细胞的样本组成分布可以看出,PD患者血液中CD8+ T细胞的比例随着分化过程逐渐增加,尤其是在分化的上层分支。较大的克隆型往往位于执行器分支的末端。PD患者血液中由中枢记忆CD8+ T细胞(C15簇)向移行CD8+ T细胞(C3簇)转化,然后是末端效应CD8+ T细胞(C6簇)的过程。共享相同TCRs的T细胞克隆型的分布进一步支持了这种转化。追踪T细胞克隆型和转录表型,我们发现55种克隆型包含分布在中央记忆CD8+ T细胞(C15簇)、移行CD8+ T细胞(C3簇)和末端效应CD8+ T细胞(C6簇)中的细胞,如克隆23型、克隆24型、克隆38型和克隆103型。提示TCRs可能参与PD患者CD8+ T细胞分化过程。总之,这些结果揭示了一个独特的末端效应CD8+ T细胞簇(C6簇),它在PD患者中通过TCR激活表现出明显的克隆扩展和细胞毒性分化,并通过表达与细胞粘附、迁移、生存和细胞毒性相关的众多基因来区分。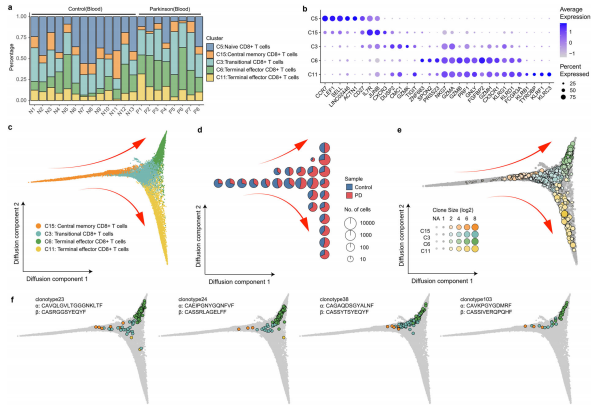
5. PD中细胞毒性CD4+ T细胞的明显克隆扩增 CD4+ T细胞是一大批在PD的外周免疫中发挥重要作用的细胞。我们注释了8种主要的CD4+ T细胞亚型,包括naïve CD4+ T细胞(C2、C4和C8簇)、中枢记忆CD4+ T细胞(C1簇)、细胞毒性CD4+ T细胞(CD4 CTL, C13簇)、Th1细胞(C9簇)、Th2细胞(C7簇)、Th17细胞(C12簇)、Tfh细胞(C19簇)和调节性T细胞(C17和C18簇)。每个簇中都有一些高表达的基因。CD4 ctl (C13簇)CD4和几种细胞毒基因如GZMA、GZMB、GZMH和NKG7的表达显著升高。PD患者与健康对照组CD4+ T细胞亚型组成无明显差异。为了了解这些CD4+ T细胞之间的关系,我们使用R包Monocle 2(2.14.0版本)构建了单细胞轨迹。选择中央记忆T细胞(C1簇,TCM)作为分化的起始细胞类型。与聚类分析一致,我们观察到一个从中央记忆T细胞(C1集群,TCM)到效应T细胞(C9, C7和C12集群,TEM)的转化过程,然后是CD4 CTL (C13集群,CTL)。调节性CD4+ T细胞(C17和C18簇,treg)合理地位于不同的分支。 为了深入了解CD4+ T细胞之间的克隆关系,我们使用Fisher 's精确测试来识别pd特异性克隆扩增的CD4+ T细胞簇。与健康对照组相比,PD患者血液中Th1细胞和CD4 ctl (C9和C13簇)中克隆扩增的CD4+ T细胞显著增加(Fisher确切检验,FDR分别为8.58e−28和3.92 2e−14)。具体而言,PD患者血液中的Th1细胞占Th1细胞总数(C9簇)的50.2%,当背景减少为克隆扩增的Th1细胞时,这一比例增加到65.5%。至于CD4 ctl (C13聚类),该人群中74.4%来自PD患者的血液,当背景减少到克隆扩增CD4 ctl时,这一比例增加到77.3%。PD患者的CD4 ctl具有较大的克隆型,从2301个细胞中检测出371个克隆型(每个克隆型6.2个细胞),而健康对照组的平均克隆大小为3.2(从829个细胞中检测出258个克隆型。我们使用扩散图进一步可视化TCM、Th1、Th2和CD4 ctl之间的关系。较大的克隆型倾向于分布在CTL分支的末端。PD细胞的比例沿轨迹逐渐增加。CD4 CTLs中富集的4个主要细胞毒基因GZMA、GZMB、PRF1和NKG7的平均表达量沿CD4 ctl分化轨迹增加。TCR共享的证据进一步支持从Th1细胞到CD4 ctl的状态转变。在Th1细胞和CD4 ctl中共鉴定出81种克隆型,如克隆型28和克隆型65。这些结果表明,一组来自TCR激活的Th1细胞的CD4 ctl在PD患者中显著克隆扩增。 Th1细胞可通过释放IFNγ对多巴胺能神经元产生细胞毒性作用,IFNγ激活并招募其他免疫细胞放大局部炎症。也有报道称CD4+ T细胞介导的多巴胺能毒性在PD11小鼠模型中不需要IFNγ的表达,提示细胞毒性CD4+ T细胞浸润中枢神经系统的存在。我们的研究发现,PD患者血液中Th1和CD4 CTL均通过tcr依赖性活化显著克隆扩增,提示血液中的这两种细胞类型可能是中央浸润性CD4+ T细胞的来源。直接或间接靶向这些T细胞类型的抑制剂可能通过阻止T细胞增殖来阻断PD患者的免疫反应。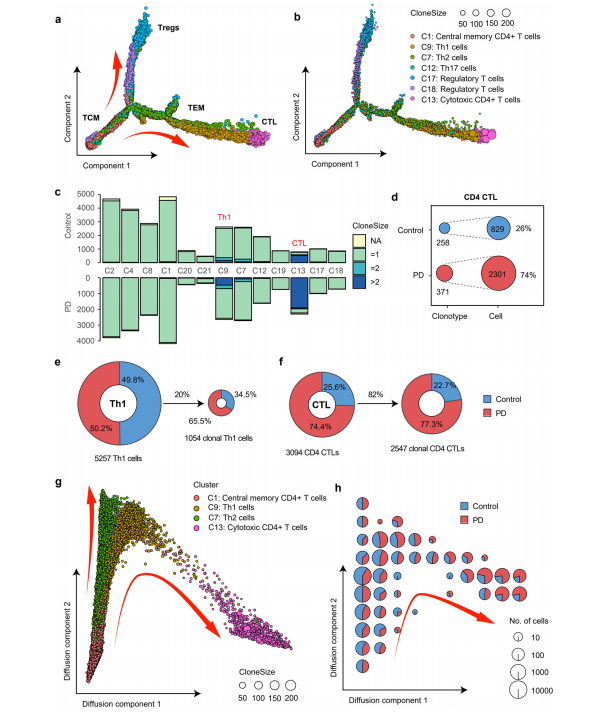
6. PD中的抗原特异性T细胞和候选抗原表位 越来越多的证据表明,自身蛋白的异常处理可在PD中产生抗原。T细胞识别这些抗原,协调局部先天免疫反应,并通过激活免疫途径驱动多巴胺能神经元死亡。α-突触核蛋白(α-syn)是一种突触前神经元蛋白,在遗传和病理上与PD相关。最近的研究表明,α-syn纤维可以在大鼠脑内神经退行性变之前招募外周免疫细胞。错误折叠α-syn蛋白不仅在中枢神经系统中普遍存在,还会引起周围免疫反应。一组来自α-syn的肽被报道为驱动PD患者T细胞应答的表位。此外,在PD中,线粒体抗原呈递途径也与适应性免疫相关。识别抗原特异性T细胞对于理解PD的适应性免疫反应至关重要。 基于CDR3序列相似性的TCR聚类是识别抗原特异性T细胞的有效方法,因为来自不同个体的TCR共享相似基序可能也共享抗原特异性。总的来说,我们从113,690个T细胞中获得了110,912个βCDR3s,并进行了成对比对。我们使用了一种特别设计用于处理大量TCR聚类的超快算法iSMART,检测到1778个TCR特异性组。为了识别PD特异性TCR,我们筛选了67个TCR特异性组,其中至少有一种TCR来自PD患者的血液,一种TCR来自PD患者的CSF。这些组被认为是PD特异性TCRs的候选者,其中大多数仅在PD患者中发现。 pd特异性TCRs的鉴定也使我们能够进一步从pd相关蛋白(如α-syn)中发现候选抗原表位。我们使用了几个步骤来寻找pd特异性TCRs和潜在抗原表位之间的关系。首先,从我们8例PD患者的全基因组测序数据中获得高分辨率HLA分型。其次,以“α- synuclein”和“线粒体”为关键词检索NCBI蛋白数据库,获得所有α-syn和线粒体蛋白序列;去除冗余后,将这些蛋白质序列分别分离为9-mer和15-mer多肽,以预测它们与MHC I和MHC II等位基因的结合亲和力。最后,我们利用MHC基因和TCRs共享的样本,构建了MHC肽和TCRs之间的关系。14个TCR特异性组和11个HLA等位基因之间存在相对强的样本共享关系。这些HLA等位基因被预测与α-syn蛋白或线粒体蛋白的至少一个肽结合。幸运的是,我们预测的两个肽' KTKEGVLYVGSKTKE '和' GKTKEGVLYVGSKTK '已被报道在PD患者中驱动辅助T细胞和细胞毒性T细胞应答。综上所述,我们利用TCR聚类和机器学习筛选了一组pd特异性TCR及其候选表位,为血和脑脊液T细胞参与神经元变性提供了潜在靶点。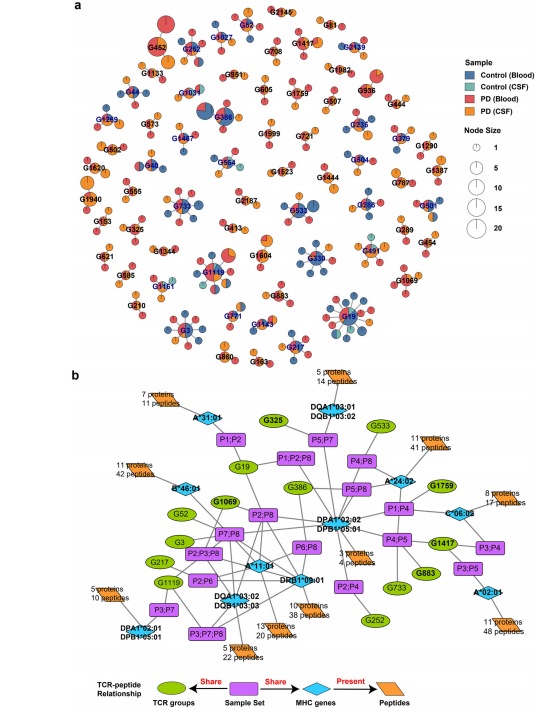
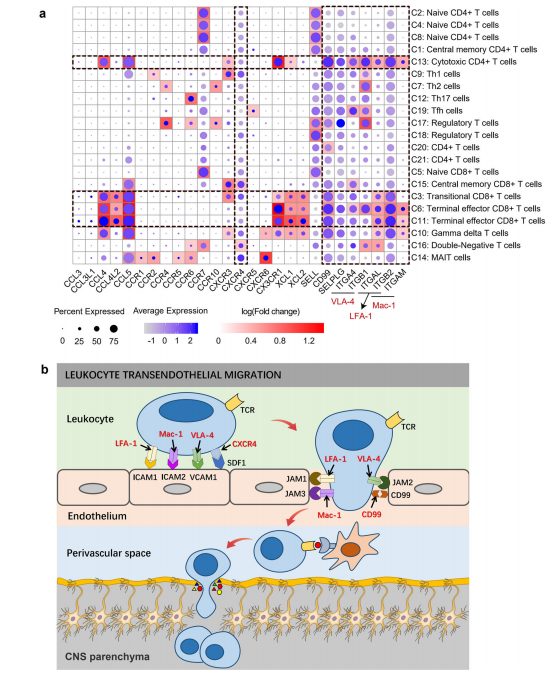
7. PD中细胞毒性T细胞通过血脑屏障的可能机制 血脑屏障(BBB)是内皮细胞形成的一种物理屏障,防止血液蛋白质、抗体和免疫细胞穿透脑实质。然而,在慢性炎症的持续作用下,内皮细胞之间的紧密连接被削弱或破坏,从而允许抗体或免疫细胞通过。脑的死后研究证实,淋巴细胞浸润大脑有助于pd9,11,46的神经退行性变。炎症期间白细胞,特别是淋巴细胞,在中枢神经系统(CNS)的招募中有大量的粘附分子参与。整合素白细胞功能相关抗原-1 (LFA-1)通过结合内皮细胞表面的ICAM-1(和ICAM-2)在白细胞粘附级联中发挥关键作用。极晚激活抗原-4 (VLA-4)介导淋巴细胞和单核细胞与激活内皮细胞表面VCAM-1的粘附。巨噬细胞-1抗原(MAC-1)结合ICAM-1(和ICAM-2)调节血管内爬行。此外,一些趋化因子及其受体与效应T细胞到血脑屏障的再循环有关。滚动白细胞上的趋化因子受体(如CXCR4)与内皮细胞上的趋化因子(如CXCL12)相互作用,激活若干信号通路(如PI3K、PLC、RAS-和rho -家族GTPase和MAPK),促进整合素构象的开放。选择素(SELE, SELP)及其对抗配体(SELPLG)依赖滚动是白细胞向炎症组织募集的最早可观察事件,它在多发性硬化症患者急性发作时脑血管中CD8+细胞募集中起着关键作用。 我们评估了许多与细胞迁移和粘附相关的分子,发现许多与血脑屏障渗透相关的分子在细胞毒性T细胞中高度表达。整合素家族基因(VLA-4, LFA-1, Mac-1)在过渡性CD8+ T细胞(C3簇)、末端效应CD8+ T细胞(C6, C11簇)和CD4 ctl (C13簇)中表现出较高的表达。其他细胞趋化因子、粘附分子及其受体,如CCL4、CCL5、CX3CR1、CD99和SELPLG,也在这些细胞毒性T细胞中广泛且相对高表达。部分基因在PD患者中表达明显上调。这些基因在白细胞跨内皮迁移通路中显著富集(KEGG: hsa04670),这可能代表了细胞毒性T细胞通过PD中血脑屏障的一种可能机制。