2023-02-02
自单细胞技术面世以来,肿瘤微环境研究一直是肿瘤方向的研究重点,今天小派就来给大家分享一篇22年8月发表的单细胞和空转技术联合解析肿瘤微环境的文章,一起看看吧:
一、技术路线

二、摘要
mTORC1 在多种肿瘤中过度激活,作者在这里对结节性硬化症复合物(TSC)与mTORC1活性亢进过度激活相关的肿瘤进行了单细胞转录组,TCR和单细胞空间转录组的联合分析。1. 识别了stem-like tumor cell state (SLS)通过调控已知性巨噬细胞与T细胞功能失调相关。雷帕霉素及其衍生物(rapalogs)是TSC肿瘤的主要治疗方法,干细胞样肿瘤细胞(SLS)在体外表现出雷帕霉素耐药,让人联想到这些药物对患者的细胞抑制作用。2. 促血管生成因子MDK在SLS细胞群中高表达,这与SLS居多的样本中内皮细胞的富集有关。体内外实验显示抑制MDK表达联合雷帕霉素能协同的减少TSC细胞系的生长。总之,这项研究揭示了mTORC1过度激活的干细胞特征的肿瘤细胞自发的雷帕霉素耐药机制和通过免疫抑制适应的肿瘤生存机制。
三、主要结果
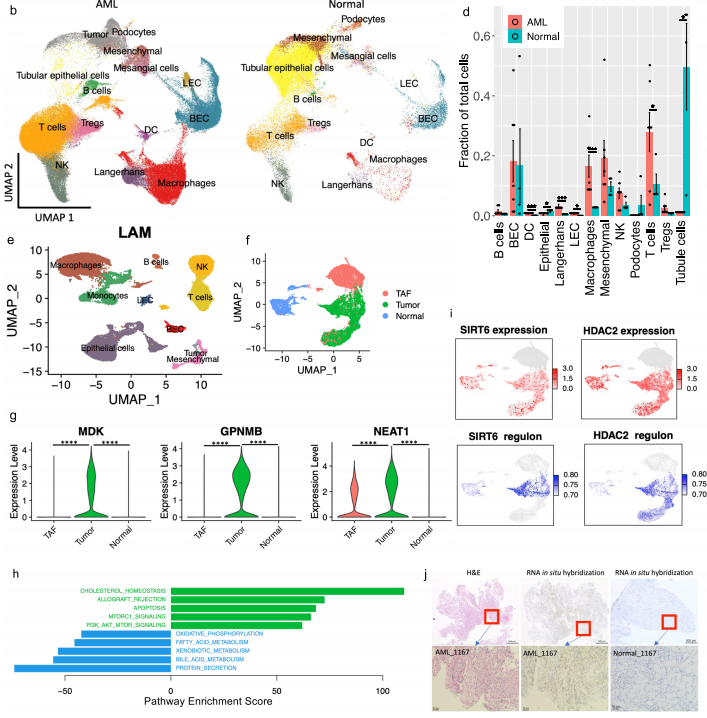
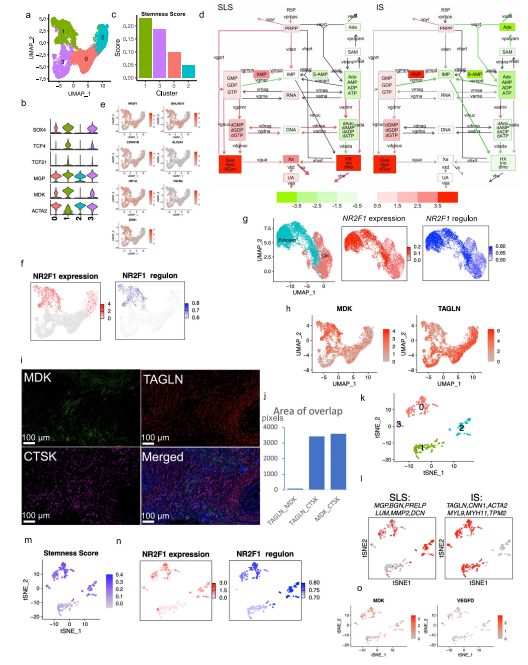
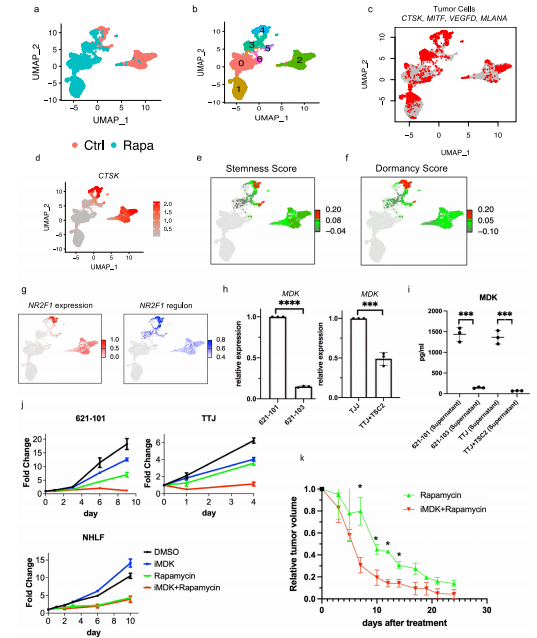
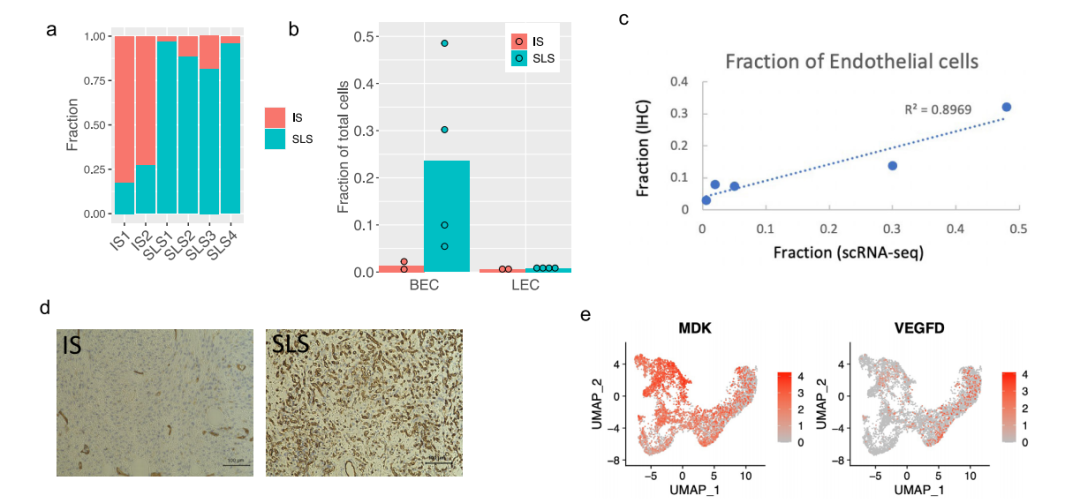
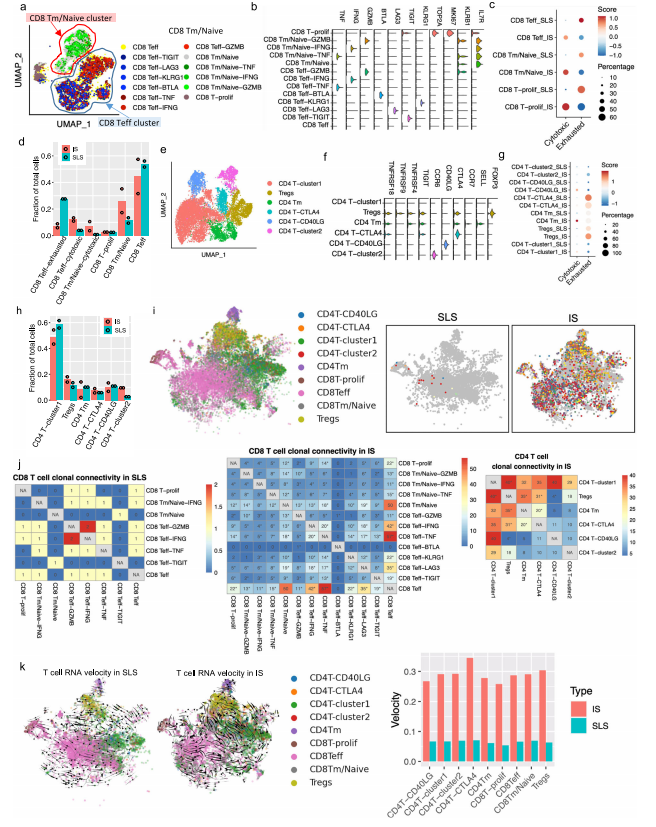
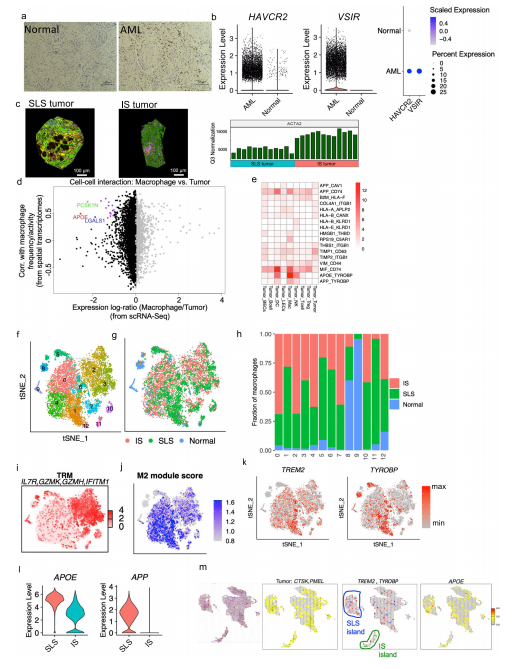
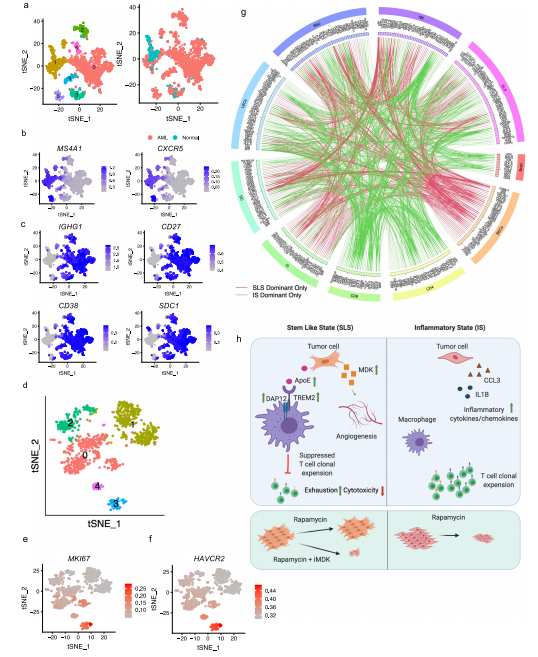
1.AML和LAM的单细胞概览和AML细胞中的通路和遗传调控网络的图谱 研究者对肿瘤切除时获得的6个肾性AML肿瘤和4个正常组织进行scRNA-Seq和scTCR-Seq(图1a)。在肺移植时获得的5个LAM组织也进行了scRNA-Seq。过滤掉低质量的细胞后,共分析了来自AML的108,071个细胞和来自匹配的正常肾脏的33,136个细胞;分析了LAM肺部样本的42,202个细胞。AML组织和正常组织的免疫和基质区的主要细胞类型见图1b, c。正常肾脏含有49%的上皮细胞,而AML中只有1.1%的上皮细胞(图1d)。与正常组织相比,许多免疫类细胞在肿瘤组织中被富集,包括巨噬细胞(18.3% vs 2.7%)、树突状细胞(4% vs 0.7%)和T细胞(32.6% vs 14.1%)。在LAM组织中发现的主要细胞类型包括免疫细胞(T细胞、NK细胞、B细胞、巨噬细胞和单核细胞)、间质细胞、上皮细胞和内皮细胞(淋巴细胞和血液)(图1e)。 对间质细胞群的重新聚类显示了来自正常肾组织和AML肿瘤组织的独立细胞群(图1f)。除了AML细胞(如上所述),该集群还包含肿瘤相关的成纤维细胞(TAF)。通过Seurat的差异基因表达分析发现,与TAF和正常肾脏相比,160个基因在肿瘤细胞中唯一上调,包括以前报道的基因(如GPNMB、SQSTM1/p62、MMP2、PTGDS)和参与肿瘤转移的基因(如MMP11、MDK、DCN、PDPN)(图1g,补充图3b,补充数据1)。与匹配的正常间质细胞相比,两个长的非编码RNAs(lncRNAs)(MALAT1,NEAT1)在肿瘤细胞和肿瘤相关的成纤维细胞中都被上调(图1g和补充图3c),表明AML细胞重塑了成纤维细胞。为了确定AML细胞与TAF和正常肾脏的不同调节途径,研究者使用了基因集变异分析(GSVA)。标志性的基因集分析(包含50个基因集)确定了参与胆固醇平衡的基因是AML细胞中上调最多的途径,而第二大上调途径是mTORC1信号传导,这是在AMLs和LAM中TSC2损失的一个众所周知的生化效应(图1h)。研究者使用SCENIC分析发现:在AML细胞中更多的调控因子被上调。该分析还确定了与AML相关的转录因子和调节子,包括参与表观遗传调控的几个因子,如HDAC2、SIRT6、FOXN3、MEF2A(图1i,补充图3d。补充资料2、3)。所关注的具体基因包括MDK(在此新发现的在AML中高表达的基因)和GPNMB(AML的一个已知标记)。研究者使用RNA原位杂交,在AML肿瘤中检测到MDK的表达,但在邻近的正常肾脏中没有检测到(图1j)。MDK是一种肝素结合的生长因子,能促进细胞生长和血管生成。 2.AML肿瘤细胞表现为两种主要状态:干细胞样和炎性 对6596个AML细胞进行重新聚类显示了四个细胞群(图2a,b)。Custer 1显示中胚层特异性转录因子21(TCF21)的相对高表达,这是平滑肌细胞表型调节的主调控因子(图2b,补充图4b)。他们注意到几个基因(SOX4,TCF4)(图2b,补充图4c),已知是干细胞标志物。研究者计算 "干性评分"并发现:群组1显示出最高的干性分数(图2c),并显示出炎症基因的高表达(图2b,补充图4e)。基于这些特征,他们将聚类1定义为干细胞样状态(SLS),聚类2定义为炎症状态(IS)。嘌呤相关的代谢与mTORC1途径有关,高水平的嘌呤核苷酸是维持癌症干性所必需的,而外部补充次黄嘌呤则会促进肿瘤干性。研究者从单细胞转录组中产生了伪Bulk RNA-seq数据,并发现与正常对照组相比,两种肿瘤细胞状态下嘌呤途径中鸟嘌呤/鸟苷的代谢都升高了(图2d)。 人们越来越认识到,缺氧的微环境以及转移过程中诱发的压力会引发休眠状态,使肿瘤细胞对药物治疗和压力产生抗性。研究者进一步分析一组休眠标记基因,发现在SLS群体中高表达(群集1),包括转录因子NR2F1(图2e)。NR2F1通过整合静止和生存的表观遗传程序,成为诱导和维持肿瘤干细胞休眠的一个关键节点。Regulon分析证实,NR2F1 regulon活性在SLS(群集1)中被上调(图2f)。并且雌二醇处理增加了NR2F1的表达和regulon活性(图2g)。研究者通过对SLS和IS的marker(MDK和TAGLN,图2i)以及Cathepsin K(AML/LAMmarker基因)进行共染色,在肿瘤样本中鉴定到了SLS和IS群体。量化显示MDK和TAGLN几乎没有共定位,而MDK与CTSK或TAGLN与CTSK广泛共染(图2j),支持存在两个不同的AML细胞群,MDK+和TAGLN+。 3.LAM中出现的细胞群与AML中观察到的两种类型相似 遗传学研究显示,AML和LAM的细胞来自一个共同的前体细胞。为了确定在AML中发现的两种细胞状态是否存在于肺部LAM中,研究者使用与AML相同的标记基因组和方法分析了五个LAM肺部的57186个细胞,共鉴定了375个LAM细胞(图1e)并聚类成了4个细胞群(图2k)。与AML相似,一个集群表达SLS/调节性平滑肌标志基因(集群2),另一个集群表达IS/收缩性平滑肌标志基因(集群1)(图2l)。还确定了一个表达所有这些基因的中间状态(簇0)。SLS群体和中间状态显示出较高的干性评分(图2m)。此外,与SLS AML细胞一样,LAM细胞的SLS群也有NF2F1表达和调节子活性的上调(图2n)。在LAM细胞中,VEGFD(一种有效的LAM生物标志物)的表达远远低于MDK(一种有效的血管生成和淋巴管生成的生长因子)(图2o),表明MDK在LAM相关的淋巴管生成中的潜在作用。 4.AML细胞的干细胞样细胞群可能与雷帕霉素耐药有关 研究者观察到肿瘤细胞亚群的干性和休眠性增强,这是耐药性肿瘤细胞的典型特征,这促使研究者直接研究雷帕霉素在AML细胞中的耐药性。他们从本研究分析的AML肿瘤之一做了原代培养,并用DMSO(对照)或雷帕霉素(实验)处理这些细胞,然后进行scRNA-Seq分析(图3a),聚类确定了7个细胞群(图3b),AML细胞占33%(图3c)。集群4包含来自对照组和雷帕霉素治疗组的AML细胞,表明它包含对雷帕霉素有抵抗力的细胞,或者至少是转录没有被雷帕霉素治疗改变的细胞。在这个集群中,许多AML肿瘤标志基因的表达不受雷帕霉素的影响,而在其他集群中雷帕霉素抑制了这些肿瘤基因的表达,例如CTSK(图3d)。此外,第4群中的细胞显示出高干性评分(图3e)和高休眠评分(图3f和补充图6c)。NR2F1调节子的活性在这个簇中也很高(图3g)。 据报道,MDK在其他肿瘤中介导耐药性,为了确定MDK是否参与雷帕霉素耐受,以及MDK是否受TSC途径的调节,研究者使用了两种TSC的细胞模型,发现与TSC2-reexpressing 621-103细胞相比,在TSC2缺陷的AML患者衍生的621-101细胞中,以及与TSC2-add back TTJ+ TSC2细胞相比,MDK的表达上调了(图3h)。与对照组相比,患者来源和小鼠来源的TSC2缺陷细胞系中的MDK水平都明显升高(图3i)。接下来,研究者用DMSO、雷帕霉素(20 nM)、iMDK(MDK抑制剂,1 µM)或雷帕霉素(20 nM)和iMDK(1 µM)的组合处理TSC2缺陷细胞(621-101,TTJ)和正常人类成纤维细胞(NHLF)。在所有3个细胞系中,单独使用iMDK处理的效果最小。当与雷帕霉素结合时,iMDK对两个TSC2缺失的细胞系有协同作用(图3j)。他们将协同作用定义为两种药物的综合效果大于每种药物的单独活性之和。为了确定iMDK是否在体内使肿瘤对雷帕霉素治疗敏感,他们使用TSC2缺陷的TTJ细胞在免疫缺陷的无胸肌裸鼠体内产生皮下肿瘤。与单独使用雷帕霉素相比,iMDK和雷帕霉素的联合治疗导致了更快的肿瘤反应的发生,以及更低的肿瘤负担,而单独使用iMDK没有明显的效果(图3k,补充图6d)。 5.异质性肿瘤细胞状态对内皮细胞的重塑 研究者探究了SLS和IS对肿瘤微环境的潜在不同影响。在6个AML样本中,2个AML主要由IS组成(>70%),4个主要是SLS(>80%)(图4a)。以SLS为主的肿瘤有更多的内皮细胞(图4b)。为了验证这一点,他们对每个AML进行了内皮细胞标记物CD31的免疫组化(IHC)染色,发现与scRNA-Seq预测的百分比有很强的相关性(图4c),在SLS主导的肿瘤中内皮细胞的百分比更高(图4d,补充图7a)。差异表达分析显示,MDK的表达要比VEGFD高得多,MDK在群集1(SLS)中表达较高,而VEGFD在群集3(IS)中表达较高 (图4e)。这些数据表明,SLS肿瘤中促血管生成的MDK的高表达可能是该亚型AML中富含内皮细胞的原因。 6.scRNA-Seq和scTCR-Seq的综合分析揭示了SLS优势肿瘤的T细胞功能障碍和抑制的克隆扩展 在人类TSC肿瘤中已经观察到T细胞的浸润和衰竭,并且在小鼠模型中观察到免疫疗法的明显益处。为了确定T细胞是否受到AML中肿瘤细胞状态的影响,研究者重点研究了4个与正常肾脏配对的AML,其中2个以SLS为主,2个以IS为主。对肿瘤来源的CD8+T细胞进行重新聚类,发现了3个主要的细胞群:记忆/免疫T细胞(CD8 Tm/naive)、效应T细胞(CD8 Teff)和增殖T细胞(CD8 T-prolif),以及每个主要细胞群中的亚群,它们具有不同的免疫检查点基因或细胞毒性效应基因的表达(图5a,b)。来自SLS优势肿瘤的CD8+T细胞与来自IS优势肿瘤的CD8+T细胞相比,显示出更低的细胞毒性分数,而且每个亚群内的细胞毒性细胞(定义为表达至少一种细胞毒性效应基因)的百分比也较低(图5c)。此外,SLS主导的肿瘤衍生细胞表现出更高的衰竭分数(图5c)。尽管每个亚群中衰竭细胞的频率大致相同(图5c),但SLS主导的肿瘤中衰竭的CD8+Teff细胞的比例高于IS主导的肿瘤,而IS主导的肿瘤显示出更高的细胞毒性CD8+Teff和CD8+Tm/Naive群体的频率(图5d)。对肿瘤来源的CD4+T细胞的类似分析显示了6种CD4+T细胞的亚型(图5e,f)。虽然来自IS显性肿瘤的记忆型CD4+T细胞和CD40LG高的群体显示出较高的细胞毒性分数(图5g),但在SLS显性肿瘤和IS显性肿瘤之间没有观察到任何亚型的细胞频率的明显差异(图5h)。 肿瘤激活的淋巴细胞会发生克隆性扩增,来自同一克隆的扩增T细胞具有相同的TCR序列(克隆型)。研究者发现在以IS为主的肿瘤中,有229个克隆型在CD8+T细胞亚型中共享,319个克隆型在CD4+T细胞亚型中共享,但在以SLS为主的肿瘤中只有5个克隆型在CD8+T亚型中共享(图5i)。SLS肿瘤在CD8+T群体中显示出相当有限的亚型之间的克隆型共享,而在CD4+T群体中没有克隆型共享,而IS肿瘤在CD8+T和CD4+T群体中都显示出亚型之间广泛的克隆型共享(图5j)。CD8+ Teff亚型中75%的扩增TCRs与IS肿瘤中的CD8+ Tm/Naive亚型共享,显示了这两种CD8+ T细胞状态之间的动态联系。在IS肿瘤中,大多数增殖的CD8+T细胞与CD8+Teff群体共享克隆型,这可能意味着肿瘤抗原反应性T细胞增殖(图5j)。增殖的T细胞与两个细胞毒性Taff群体(CD8 Teff-TNF和CD8 Teff-IFNG)共享大量的克隆型。此外,在CD8 Teff和两个细胞毒性Teff群体(CD8 Teff-TNF和CD8 Teff-IFNG)之间观察到广泛的克隆共享,这表明向功能性T细胞分化的轨迹是活跃和动态的。这些观察结果表明,在IS肿瘤中观察到的高频率的细胞毒性CD8+T细胞,至少部分是由于可能的肿瘤识别效应细胞的动态分化。研究者使用RNA速率分析支持了从CD8效应T细胞到增殖T细胞以及从多个CD4+T亚群到Tregs的分化轨迹(图5k)。相反,以SLS为主的肿瘤显示出亚型之间有限的分化潜力。 7.划分TSC中的抑制性免疫微环境 免疫抑制性骨髓细胞,如肿瘤相关巨噬细胞(TAMs),由于其强大的抑制功能和在肿瘤微环境中的高丰度,被认为是癌症免疫治疗的主要障碍。如上所述,巨噬细胞的富集是AML中最引人注目的免疫浸润(图1b,d)。这种巨噬细胞在AML中的富集被CD68 IHC证实(图6a)。与来自匹配的正常肾脏的巨噬细胞相比,这些AML衍生的巨噬细胞显示出更高的免疫检查点基因T细胞免疫球蛋白和含粘液结构域蛋白3(TIM3)的表达,以及由VSIR编码的V域免疫球蛋白抑制T细胞活化(VISTA)的表达(图6b)。肿瘤浸润性巨噬细胞上的VISTA和TIM3的表达与肿瘤微环境中的T细胞功能障碍有关。接下来,研究者使用DSP技术进一步分析了1个SLS肿瘤和1个IS肿瘤并证实IS标记基因ACTA2在IS主导的肿瘤中表达较高(图6c)。并发现主要在SLS肿瘤细胞中表达的APOE、LGALS1和PCSK1N与SLS为主的肿瘤中的巨噬细胞频率/活性有很高的相关性(图6d。补充数据6)。所有这些基因都编码分泌蛋白,表明SLS肿瘤细胞分泌组对巨噬细胞有特定的旁分泌调节作用。接下来,研究者使用配体-受体相互作用分析,并发现通过APOE-TYROBP(DAP12)的肿瘤巨噬细胞相互作用是肿瘤微环境相互作用中最强的相互作用(图6e)。 研究者对所有巨噬细胞(SLS+IS+正常)重新聚类并确定了12个聚类(图6f)。除了两个主要来自正常肾脏的小集群(集群8和集群9),大多数集群主要来自肿瘤(图6g,h)。在肿瘤衍生的巨噬细胞群中发现了两种主要类型的巨噬细胞(组织驻留巨噬细胞(TRM)和TAMs)。基于IL7R98和炎症基因的高表达,集群2和集群3被注释为TRM(图6i和补充图9e)。AML中的TAMs主要由4个簇(簇0、簇1、簇4和簇6)组成,其特点是M2模块得分高(图6h和补充图9f)。TAMs在SLS和IS肿瘤之间显示出惊人的差异(图6i)。第1群和第6群的细胞显示TREM2和TYROBP的高表达(图6k)。这些数据表明,来自SLS肿瘤的TREM2+/TYROBP+ TAMs的比例较高。这些观察结果表明,从SLS肿瘤细胞到TAMs的调节轴是通过APOE-TREM2/TYROBP的相互作用(图6l)。研究者在1个独立的AML样本中使用10 X Visium空间转录组分析验证了这一观察(图6m)。 8.对肿瘤和肿瘤微环境之间的分子相互作用的分析,为SLS和IS肿瘤的不同精确治疗策略提供了潜在的目标 在免疫区,研究者还观察到AML中的B淋巴细胞和树突状细胞相对于正常肾脏的富集情况。他们检测到1620个B细胞主要来自肿瘤(图7a,b),重新聚类显示了个细胞群。其中,有5个是特别富含肿瘤的。他们发现在肿瘤(群集5)和邻近的正常肾脏(群集1)中都有表达高水平的CD20(MS4A1)和CXCR5的滤泡B细胞(图7b)。相比之下,表达免疫球蛋白γ(IGHG1、CD27、CD38)的浆状B细胞只富集于肿瘤中(图7c)。他们又对树突状细胞重新聚类确定了一个增殖细胞的小集群(集群3)(图7d,e)。据报道,HAVCR2(TIM-3)是树突状细胞在抗肿瘤免疫中的一个重要调节因子。增殖的集群表现出高的HAVCR2表达(图7f),表明增殖的树突状细胞有促进肿瘤的功能。最后,研究者使用细胞互作分析对肿瘤微环境中所有细胞类型之间的潜在联系进行了探究。对SLS主导的肿瘤与IS主导的肿瘤中配体-受体相互作用的差异分析显示,在这两种肿瘤细胞状态下,肿瘤微环境串扰是不同的。例如,在SLS主导的肿瘤中发现了更多的肿瘤和血液内皮细胞之间的相互作用,这与SLS主导的肿瘤中丰富的内皮细胞一致(图7g)。在SLS主导的肿瘤中,CD8和CD4 T细胞与其他细胞类型的相互作用被剥夺,这可能是观察到的抑制T细胞克隆扩展的分子机制的原因(图7g)。