2023-06-29
前言
随着这几年单细胞项目在科研临床各个领域得到广泛应用,派森诺生物单细胞团队积攒了大量不同样本类型的单细胞悬液制备经验。单细胞悬液质量的好坏是实验成功与否的关键,然而一切实验成功的源头,都是基于对细胞状态的判断,所以了解自己的细胞特点及高质量细胞悬浮液的制备是重中之重。
单细胞悬浮液上机前细胞质量要求如下:
细胞浓度:700-1200cells/ul
细胞总量:> 1 * 105 cells
细胞直径:5 – 40um
细胞活率:≥80%
细胞背景:无组织碎片或其他颗粒物
单细胞悬液制备的具体方案因样本类型而异,根据自身实验的需要,我们需要从各类样本中制备单细胞悬液,例如血液样本中的PBMC;腹水;脑脊液;临床癌变组织样本中的细胞;动物组织模型的细胞;单核诱导贴壁后形成的巨噬细胞、树突状细胞;培养的细胞团、类器官、细胞系;悬浮细胞等等。成功制备高质量的单细胞悬液才是关键,下面就给大家详细介绍从多种样本中制备单细胞悬液的主要方法:
一:外周血单核细胞

全血制备PBMC(peripheral blood mononuclear cell)外周单个核细胞,其主要细胞类型为血液中具有单个核的细胞,主要包括淋巴细胞(T细胞、B细胞),单核细胞,吞噬细胞,树突状细胞和其他少量细胞类型,其中淋巴细胞占很大一部分。
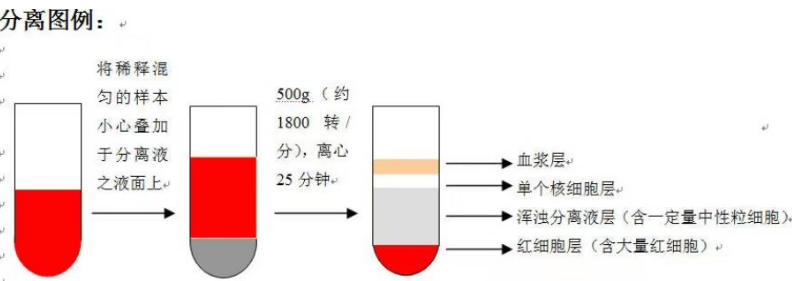
PBMC的制备采用密度梯度离心法:取2ml新鲜血液样本,与DPBS 1:1稀释,混匀后用无菌吸管吸取稀释后的血液,沿管壁缓慢加入至人淋巴细胞分离液液面上。将离心管缓缓地不要晃荡,保持界面清晰,放入水平离心机, 500g,4℃离心 25min,缓升缓降,离心完毕后,小心取出 15 mL 试管,离心后管内可分为三层,在上、中层界面处有 一层以单个核细胞为主的白色云雾层狭窄带,即为我们所需要的单个核细胞。用无菌吸管吸取白色云雾层狭窄带的单个核细胞,并置于另一 15 mL 离心管中,清洗后加入红细胞裂解液,室温静置裂解 2min,800rpm 离心 5min,再次清洗两遍,重悬细胞,进行细胞计数和活力测定,吸取适量体积细胞悬液进行后续实验。
二:哺乳动物组织样本
传统组织处理方法
研磨法
适用样本类型:脾脏、胸腺、淋巴结
实验步骤:
1、先将组织冲洗干净,剪成1-2mm大小;
2、放入研钵器中,搅动研磨棒,使组织成匀浆状态;
3、加入10mlDMEM至器皿中冲洗收集细胞悬浮液;
4、过70um细胞筛,4℃1500rpm离心5min;
5、弃上清,沉淀加入红细胞裂解液,室温3min,再过40um细胞筛;
6、加入等体积DMEM中止裂红后,4℃1500rpm 离心5min,弃上清;
7、用DMEM洗涤一次,在重悬细胞,计数后即可投入后续实验。
酶解法
适用样本类型:肿瘤、肝脏、肾脏、心脏、肺、胃肠道、脑、皮肤、骨
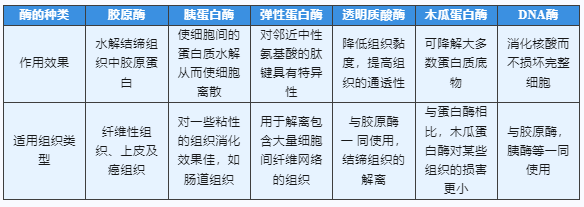
酶的种类选择:
实验步骤:
1、提前打开 37℃水浴锅,提前准备好冰盒;提前配制不含 Ca2+、Mg2+的 PBS(含 2%FBS),并且预冷。
2、配制解离液,混匀,待完全溶解后,0.22um 滤膜滤过消毒待用。
3、取组织样本,用预冷的 DPBS 冲洗,低速离心。
4、将收集的组织转移至装有 5mL解离液的 15mL 离心管中,将此离心管置于 37℃水浴中震荡消化 45 min,如没有震荡水浴锅可用手摇代替。
5、将消化后的溶液转移至 40um 的细胞筛,收集通过的细胞滤液至一新的无菌离心管中。
6、4℃ 1000 rpm 离心 10 min,弃上清。向细胞沉淀中加入 10mL 不含 Ca2+、Mg2+的DPBS(含2%FBS)重悬细胞,1000 rpm 离心 10 min,弃上清。
7、加入 10mL 不含 Ca2+、Mg2+的 PBS(含 2%FBS)重悬细胞,并计数。
8、弃去上清,加入 200 uL DPBS+2%FBS 重悬细胞,进行细胞计数和活力测定,吸取适量体积细胞悬液进行后续实验。
三:植物样本原生质体制备

适用样本类型:幼嫩根、茎、叶,果实,种子,瓜果
实验步骤:
1、收集植物样本:选择适当的植物材料,如嫩叶、幼茎或悬浮细胞等,以获取含有较高原生质体含量的组织。
2、细胞裂解:
a. 样本预处理:将植物材料洗净,并剪碎成小块或研磨成细胞悬浮液。
b. 细胞裂解缓冲液:准备适当的细胞裂解缓冲液,可以包括一些重要成分如Tris-HCl、NaCl、EDTA等,以维持细胞内部环境稳定。
c. 裂解方法:
🔹高压破碎法:将细胞悬浮液经过高压处理,使细胞破碎。需要注意调控破碎压力和时间。
🔹化学裂解法:添加适当的化学裂解剂,如酶解酶、有机溶剂或表面活性剂等,来破坏细胞膜和细胞壁。
3、离心步骤:
a. 低速离心:使用低速离心将细胞残渣、细胞核和大碎片沉淀下来,得到上清液。
b. 高速差速离心:通过高速离心,将原生质体从其他细胞器和碎片分离出来。可以使用不同的离心盛装,如离心管或密度梯度离心管。
4、悬浮和纯化:
a. 上清液取样:取出上清液中富含原生质体的上清部分,将其转移至新的离心管中。
b. 洗涤:通过加入适当的缓冲液,可以进行一定次数的洗涤步骤,去除杂质和污染物。
c. 纯化:使用密度梯度离心等技术,进一步纯化原生质体样品,以去除其他细胞器残留。
四:植物样本抽核


适用样本类型:幼嫩根、茎、叶,果实,种子,瓜果
实验步骤:
1、收集植物样本:选择适当的植物材料,如嫩叶、幼茎或悬浮细胞等,以获取含有较高原生质体含量的组织。
2、样本研磨
准备已消毒的研钵、研杵、药匙,并用液氮预冷。将叶片样本置于预冷研钵中,加入液氮适当研磨为颗粒状后,用预冷药匙将粉末加入含有NIB缓冲液管中匀浆1-3次,匀浆后放冰上静置。
3、裂解过筛
取50ml管放置于冰上预冷,取适当孔径大小筛网放于50ml管口。取步骤2中静置匀浆管,将悬液过筛,收集滤液至新2ml离心管内,加入LB,混匀后孵育5~20min,离心。
4、离心富集
离心后可观察到白色沉淀,在不干扰沉淀基础上尽量弃净上清,向沉淀中加入NIB-wash重悬,取50ml管预冷,取适当孔径大小筛网放置于管口,将悬液过筛,收集滤液。
5、纯化除杂
将步骤4得到的滤液叠加至percoll层上,进行密度梯度离心;(若正叠加难以控制出现分层,可选择先将滤液加入至干净2ml离心管中,枪头吸取percoll后直接插入管底缓慢打出液体)。
6、收集核层:
离心后可见两层液体中间存在分层,即为细胞核层。收集核层至新2ml离心管,加入NIB-wash稀释,离心。
7、重悬计数:
离心后弃上清保留沉淀(若无明显沉淀可弃上清时残留10ul),加入NB溶液进行重悬,AO/PI染色进行镜检。
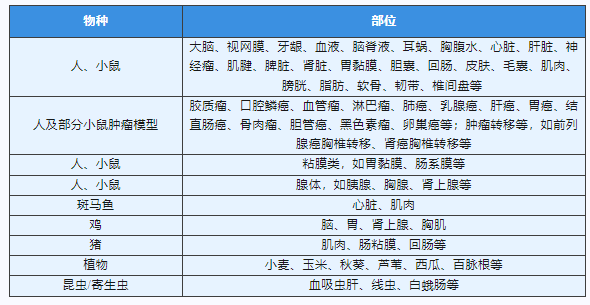
派森诺单细胞团队成功制备细胞悬浮液样本类型汇总:
派森诺单细胞团队制备部分单细胞悬液结果展示:
人-胃黏膜:
细胞浓度:1300个/微升,活性83%
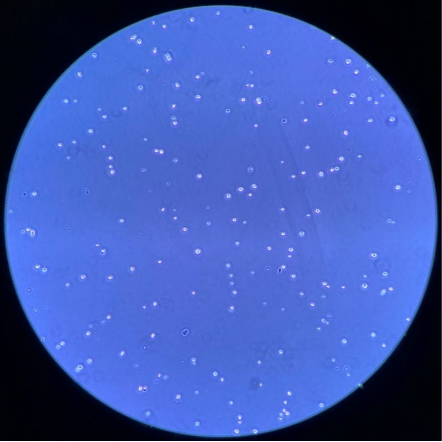
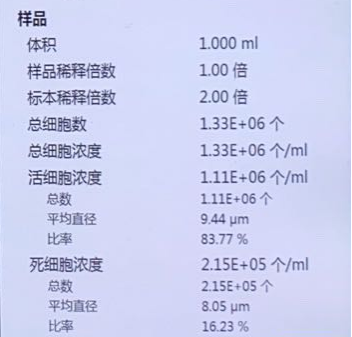
人-前列腺癌腰椎转移:
细胞浓度:1000个/微升,活性94%
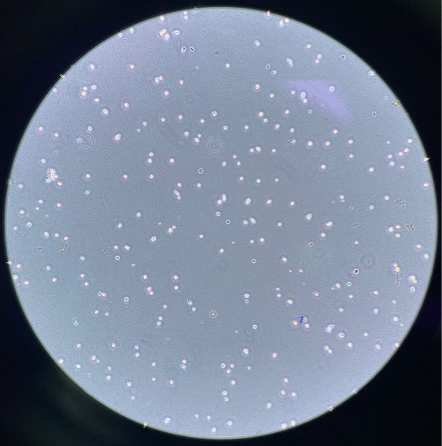
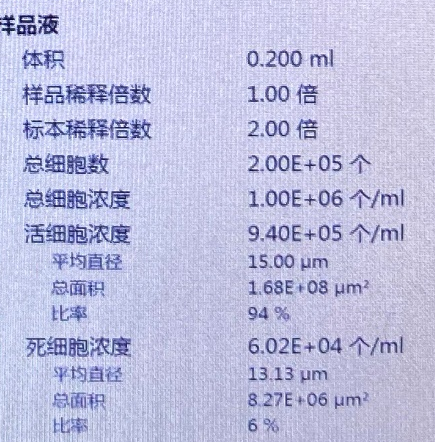
人-韧带:
细胞浓度(未稀释):2300个/微升,活性87%

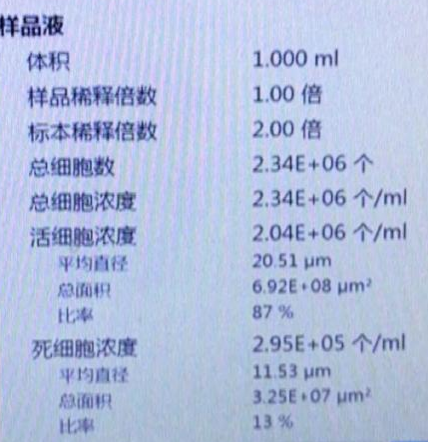
人-结肠癌:
细胞浓度:867个/微升,活性88%

小鼠-视网膜:
细胞浓度(未稀释):2000个/微升,活性94%

小鼠-黑色素细胞瘤:
细胞浓度(未稀释):2900个/微升,活性86%
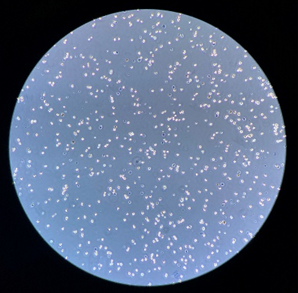

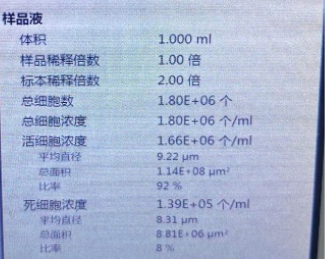
猪肠黏膜:
细胞浓度(未稀释):1800个/微升,活性92%

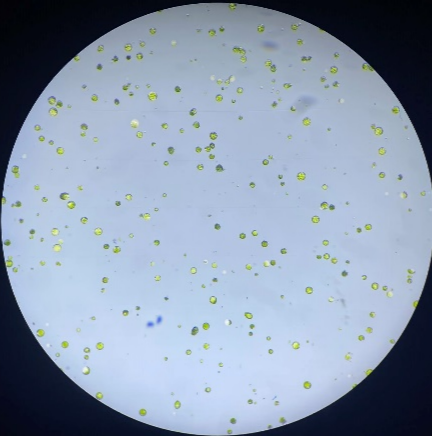
玉米-叶片原生质体:
原生质体浓度(未稀释):855个/微升,活性88%
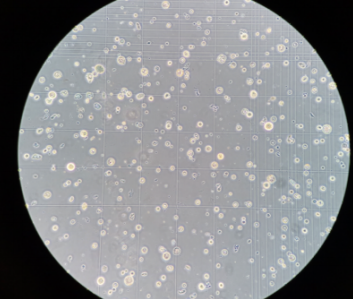
西瓜-维管束果肉原生质体:
原生质体浓度(未稀释):910个/微升,活性90%
人参-叶片原生质体:
原生质体浓度(未稀释):1300个/微升,活性80%
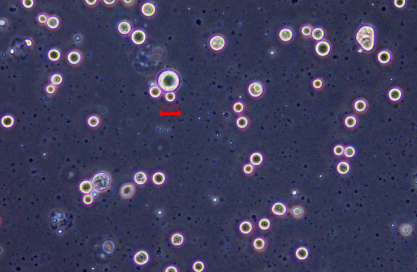
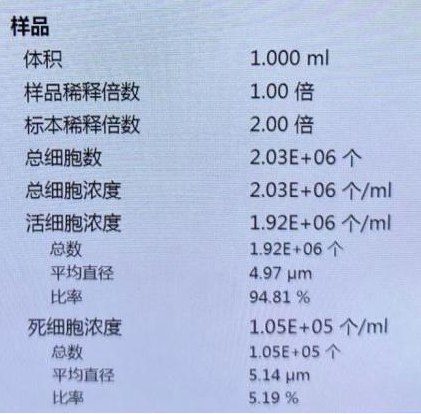
玉米叶片-细胞核:
细胞核数量(未稀释):1880个/ul,细胞核完整性较好
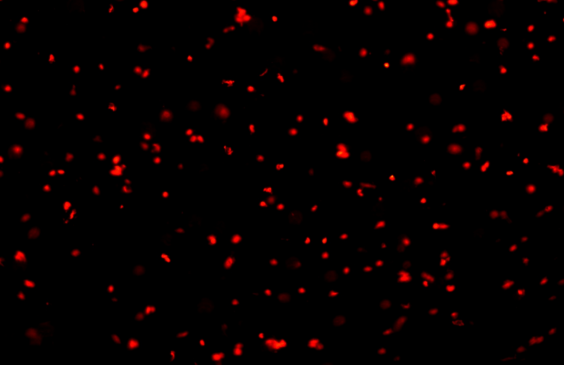
牛至叶片-细胞核:
细胞核数量(未稀释):1410个/ul,细胞核完整性较好